贵州天名精化学成分及抗菌活性研究
陈 洁,王 丹,张 雄,彭明友,徐 冉,2,晏 英,2,王 颖,2*
1贵州医科大学药学院,贵阳 550025;2贵州医科大学 贵州省化学合成药物研发利用工程技术研究中心,贵阳 550004
菊科天名精属(Carpesium)植物为多年生草本,全世界约有21种,其中少数种分布于欧亚大陆,大部分分布于亚洲中部,尤其是在我国的西南片区有丰富的植物资源,其中的天名精、烟管头草和金挖耳已被列入中国法定药用植物,贵州天名精(Carpesiumfaberi)因其止血、抗寄生虫、抗炎和解毒特性,长期以来被用作民间药物[1,2]。文献报道已从天名精属植物中至少分离得到277个化合物,结构类型包括萜类,黄酮,酚类,甾体等,其中从贵州天名精中分离得到37个化合物,其中倍半萜是其主要活性成分[2]。药理研究显示倍半萜类化合物具有抗肿瘤、抗疟原虫、抗炎、抗菌等多种生物活性[3]。近年来对于贵州天名精的活性报道主要是抗肿瘤活性[4-6]以及抗炎活性[7,8],尚未对其抗菌活性进行报道。为促进天名精植物资源的综合开发与利用,本研究对采自贵州凯里的天名精全草开展化学成分研究,并对所得化合物进行抗菌活性测试。
1 材料与方法
1.1 仪器与试剂
旋转蒸发仪(东京理化,N-1300D-WD);Bruker AV-600 MHz核磁共振仪(德国布鲁克公司);四甲基硅烷(TMS)为内标;Bruker HTC/Esquire 质谱仪(德国布鲁克公司);高效液相色谱仪为Agilent 1200型(美国安捷伦科技司);色谱柱Waters sunfire C18(10 mm × 150 mm,4.6 mm× 250 mm)(沃特世公司);BP211D电子天平(Sartorouius公司);UV-2700型紫外可见分光光度计(岛津仪器有限公司);FTIR-650傅里叶变换红外光谱仪(天津港东科技发展股份有限公司);超低温保存箱(海尔医疗公司);高压灭菌锅(上海博讯实业有限公司);电热恒温培养箱(上海一恒科学仪器有限公司);恒温振荡培养箱(上海跃进医疗器械有限公司);96孔一次性细胞培养板(耐思生命科技有限公司);移液枪(Eppendorf公司)。二甲基亚砜(索莱宝科技有限公司);MHB培养基(北京奥博星生物技术公司);Sephadex LH-20(三菱公司);C18反相硅胶(日本YMC公司);正相硅胶和薄层色谱板(青岛海洋化工厂);核磁用氘代试剂(美国CIL氘代试剂);液相用水(娃哈哈纯净水20181109);色谱级甲醇、乙腈(科密欧试剂公司);化学实验用溶剂为工业重蒸溶剂,显色剂为8%的硫酸乙醇溶液。
1.2 实验材料
菌株:大肠杆菌(Escherichiacoli)、白色念珠菌(Candidaalbicans)、金黄色葡萄球菌(Staphylococcusaureus)、铜绿假单胞杆菌(Pseudomonasaeruginosa)、枯草芽孢杆菌(Bacillussubtilis),均购于上海中科康泰生物有限公司,保存于-80 ℃。
样品采自贵省州凯里市,经过贵阳中医学院孙庆文老师鉴定为贵州天名精(Carpesiumfaberi),凭证标本(TMJ201909)保存于贵州医科大学药学实验室。
1.3 实验方法
1.3.1 化合物的提取与分离
将贵州天名精全草30 kg切碎后,以乙醇在室温条件下浸泡48 h后提取,每次提取时间为3 h,所得提取液在55 ℃条件下用旋转蒸发仪浓缩,将所得浸膏放置于通风橱中,挥干至无醇味,所得浸膏大约12 kg。将上述所得浸膏加水充分混悬后用乙酸乙酯萃取3次。萃取液在旋转蒸发仪(温度:55 ℃)上浓缩。所得萃取物放置于通风橱中,待溶剂挥干,最后称取浸膏的重量为:乙酸乙酯部分重1.5 kg。取乙酸乙酯部位浸膏,用乙酸乙酯充分溶解后,加入适量正相硅胶(40~80目)拌样。正相硅胶(100~200目)用石油醚湿法装柱,边加边敲打柱体,以确保装柱结实无气泡,反复利用石油醚冲洗,待液面降至与硅胶面基本相平,采用干法上样,以石油醚-乙酸乙酯(50∶1→0∶1)梯度洗脱样品,经TLC检测,合并相似流分,共得10个组分,记为Fr1~Fr10。
其中Fr5(67.5 g)经过MCI(甲醇-水50%→100%)得到8个亚馏分,记为Fr5-1~Fr5-8,其中Fr5-3(1 g)经过反相(甲醇-水40%→100%),得到6个亚馏分,记为Fr5-3a~Fr5-3f,其中Fr5-3e再经过制备型HPLC(流动相为98%甲醇-水,流速3 mL/min,保留时间23 min)得到化合物11(4 mg);Fr5-5(10 g)经过反相柱(甲醇-水40%→100%)得到8个亚馏分,记为Fr55-1~Fr55-8,其中Fr55-5经过凝胶柱层析(甲醇)再经过硅胶柱层析(二氯甲烷∶甲醇1∶0→100∶1),得到化合物13(4.6 mg);Fr55-6经过凝胶柱层析(甲醇),再经过硅胶柱层析(石油醚∶乙酸乙酯35∶1→0∶1)得到6个亚馏分,记为Fr55-6a~Fr55-6f,其中Fr55-6d经过制备型HPLC(流动相为70%甲醇-水,流速3 mL/min,保留时间25.6 min)得到化合物10(3 mg);Fr55-6b经过制备型HPLC(流动相为100%甲醇,流速3 mL/min,保留时间27.2 min)得到化合物9(5.5 mg);Fr55-7经过凝胶柱层析(甲醇),再经过硅胶柱层析(石油醚∶丙酮20∶1→0∶1),得到3个亚馏分Fr55-7a~Fr55-7c,其中Fr55-7b经过制备型HPLC(流动相为98%甲醇-水,流速3 mL/min,保留时间21 min)得到化合物14(3 mg);Fr55-7a经过制备型HPLC(流动相为100%甲醇-水,流速3 mL/min,保留时间22 min)得到化合物8(4.9 mg);Fr55-8经过2次硅胶柱(石油醚:乙酸乙酯40∶1→0∶1),得到化合物12(4.8 mg)。
Fr7(78 g)经过MCI(甲醇-水20%→100%)得到9个亚馏分,记为Fr7-1~Fr7-9,其中Fr7-2经过反相柱层析(甲醇-水10%→50%)得到5个亚馏分,记为Fr7-2-1~Fr7-2-5,其中Fr7-2-3经硅胶柱层析(5∶1→0∶1)得到5个亚馏分记为Fr7-2-3a~Fr7-2-3e,其中Fr7-2-3b经过制备型HPLC(流动相为30%甲醇-水,流速3 mL/min,保留时间15 min)得到化合物7(10.9 mg);Fr7-2-3c经过制备型HPLC(流动相为30%甲醇-水,流速2.5 mL/min,保留时间18.2 min、24 min),得到化合物2(6.8 mg)、化合物3(4.4 mg);Fr7-4经过反相柱层析(甲醇-水10%→60%)得到10个亚馏分,记为Fr7-4-1~Fr7-4-10,其中Fr7-4-3、Fr7-4-6用甲醇重结晶得到化合物5(10 mg)、化合物1(20 mg);Fr7-4-8经过硅胶柱层析(二氯甲烷∶甲醇200∶1→0∶1)再经过制备型HPLC(流动相为40%甲醇-水,流速2.5 mL/min,保留时间26 min),得到化合物4(5.1 mg);Fr7-7用甲醇重结晶得到化合物6(24 mg)。
1.3.2 化合物1单晶结构的测定
将化合物1在1 mL液相瓶中用甲醇溶解,瓶口用塑料膜覆盖,并在膜上扎2个小孔,室温挥发,得到若干晶体。对于单晶分析,选择尺寸为0.40 mm × 0.07 mm × 0.04 mm的晶体。所有衍射数据均在装备铜靶的Bruker Smart Apex CCD diffractometer衍射仪上获得。
1.3.3 化合物活性筛选
1.3.3.1 样品供试液制备
精确称取一定量的化合物溶于二甲基亚砜中,配制成浓度为15.36 mg/mL的溶液,低温避光保存备用。
1.3.3.2 菌株活化
MHB液体培养基:称取12 g固体培养基,加蒸馏水1 000 mL,加热使培养基完全溶解,于高压灭菌锅中,121 ℃灭菌30 min。
将细菌接种在MHB液体培养基中,于37 ℃、130 r/min条件下活化培养24 h;利用平板划线法蘸取活化菌液于固体培养基,37 ℃静置培养12~24 h,获得单个菌落。用接种环挑取单菌落于MHB液体培养基中,37 ℃、130 r/min条件下培养24 h,制得菌悬液,用MHB培养液将菌悬液浓度稀释至1×106~1×107CFU/mL备用。
1.3.3.3 最小抑菌浓度(MIC)的测定
使用无菌96孔一次性细胞培养板,做好标记后,在1号孔中加入300 μL培养基溶液为空白对照,在2号孔中加入10 μL DMSO,140 μL培养基溶液,在3号孔中加入10 μL硫酸庆大霉素,140 μL培养基溶液,5~12号孔预先加入150 μL培养基溶液,4号孔加入290 μL培养基溶液,再加入10 μL样品溶液混匀后吸取150 μL至5号孔,采用二倍稀释法依次进行稀释至12号孔,每个梯度重复3次;2~12孔均加入100 μL,1×106~107CFU/mL菌悬液,接种后,置于37 ℃摇床培养24 h后取出观察。如小孔内澄清即视为细菌生长受到了抑制,澄清小孔中所对应的最低药物浓度为对该菌的最低抑菌浓度。实验方法参考Wang等[9]的研究。
2 实验结果
2.1 结构鉴定
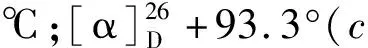
化合物1的晶体数据:C15H20O4,M = 264.31,晶胞参数:a= 6.462 1(2)nm,b= 6.462 1(2)nm,c= 62.496(2)nm,α= 90°,β= 90°,γ= 90°;晶胞体积:V= 2 609.75(18)nm3;晶胞内分子数:Z= 8;T= 100(2)K,空间群P41 212,μ(Cu Kα)= 0.790 mm-1,共收集24 445个衍射点,对其中2 548个独立点(Rint=0.027 9)进行分析。R1=0.033 5,wR2=0.089 8,Flack 参数为0.02(2),如图2所示。

图2 化合物1的单晶X射线衍射结构
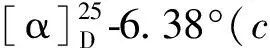
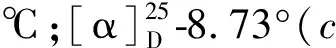

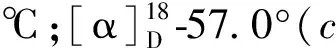

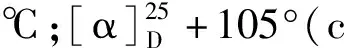







2.2 最小抑菌浓度(MIC)的测定结果
评估了化合物1~14对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、枯草芽孢菌和白色念珠菌的抑菌活性。结果表明,化合物1对枯草芽孢杆菌表现出微弱抑菌活性,化合物1的MIC值为256 μg/mL,化合物10和化合物6对白色念珠菌显示出弱活性,化合物10的MIC值为128 μg/mL,化合物6的MIC值为128 μg/mL,其余化合物则未显示抗菌活性。
3 结论
利用多种色谱方法,从黔产天名精中分离鉴定得到14个化合物,如图1所示,包括倍半萜、二萜、甾体类等成分,其中化合物2、7~14为首次从该植物中得到。针对分离得到的化合物进行抗菌活性筛选。采用二倍稀释法,测定化合物对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、枯草芽孢菌和白色念珠菌的抑菌活性,使用处于对数生长期的菌种,所有样品均使用DMSO溶解配制成15.36 mg/mL的药液。活性测试结果显示,抗菌活性测试表明,化合物1对枯草芽孢杆菌有微弱抑菌活性,化合物1的MIC值为256 μg/mL,化合物10、化合物6对白色念珠菌显示出弱活性,化合物10的MIC值为128 μg/mL,化合物6的MIC值为128 μg/mL,其余化合物则未显示出抗菌活性。本研究成果丰富了贵州天名精中的化学成分及生物活性内容,为其进一步的研究开发提供参考资料。

图1 化合物1~14化学结构

