牡荆素对1型糖尿病小鼠体内抗氧化酶活性及相关基因表达的影响
张泽鹏,徐兴军,刘佳人,张伟伟,邵淑丽
齐齐哈尔大学生命科学与农林学院 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,齐齐哈尔 161006
牡荆素(vitexin)是一种在山楂中含量很高的黄酮类化合物[1],具有明确的抗炎、抑制脂肪氧化酶等多种药理活性作用[2]。其化学分子式为C21H20O10,分子量为432.377 5,呈黄色粉末状。
Yuan等[3]研究表明,牡荆素通过Sirt1/p53信号通路保护乙醇诱导的肝损伤。Chen等[4]报道牡荆素可通过调节巨噬细胞极化抑制结肠炎相关的小鼠癌变;国外也有研究发现[5],白癜风与氧化应激有关,牡荆素可激活MAPK-Nrf2/ARE通路,进而保护黑色素细胞免受氧化应激,从而改善白癜风症状。Wang等[6]发现牡荆素可经过抑制HMGB1的释放缓解脂多糖诱导的胰岛细胞损伤。还有研究[7]表明了牡荆素能够抑制小肠刷状缘的α-葡萄糖苷酶,从而减少碳水化合物的分解和吸收。研究和开发牡荆素具有重要的意义。
糖尿病(diabetes mellitus,DM)是一种以高血糖为特征的代谢性疾病,其患病率在全球逐年增长,现已成为第四位需要优先考虑的疾病[8]。血糖浓度过高会引起机体代谢紊乱,导致组织损伤和功能障碍[9]。糖尿病根据体内胰岛素水平可分为1型和2型,其中,1型糖尿病的发病原因是胰岛β细胞被破坏,导致胰岛素分泌严重不足[10],使肝糖原不能作为直接能源物质被分解和利用。当机体维持生命活动所需能量供应不足时,体内中性脂肪分解,分解产物主要为游离脂肪酸,游离脂肪酸含量过高会增加活性氧簇(reactive oxygen species,ROS)的生成。1型糖尿病患者由于体内ROS含量过多,导致氧化应激反应。氧化应激反应是指体内的抗氧化系统不足以平衡促氧化的状态,是自由基在体内产生的消极作用,对所有生物的生命活动都具有严重的影响,甚至可导致细胞凋亡、器官组织变性以及癌症的发生。由于胰岛β细胞抗氧化酶含量较低,对ROS更为敏感,被ROS攻击会导致胰岛β细胞功能损伤,胰岛β细胞凋亡增加,进一步引起胰岛β细胞功能衰竭,最终导致糖尿病的形成[11]。2型糖尿病患者体内具备产生胰岛素的能力,甚至胰岛素含量多于正常个体。
本研究以不同剂量的牡荆素连续灌胃1型糖尿病小鼠4周,检测小鼠血清和肝脏中SOD、GSH-PX、T-AOC、MDA酶活性,利用qRT-PCR方法检测小鼠肝脏组织中抗氧化基因铜锌超氧化物歧化酶(SOD-1)、锰超氧化物歧化酶(SOD-2)、谷胱甘肽过氧化物酶-1(GPX-1)、谷胱甘肽过氧化物酶-4(GPX-4)的mRNA的相对表达量,从酶学及基因水平研究其对小鼠体内抗氧化酶活性及抗氧化基因表达的影响。
1 材料与方法
1.1 主要材料与试剂
1.1.1 实验动物
SPF级ICR小鼠84只(22.00 ± 2.00)g,购自长春市亿斯实验动物技术有限责任公司,许可证号:SCXK(吉)-2020-0001。
1.1.2 实验药物与试剂
牡荆素(南京道斯夫生物科技有限公司,98%,批号:200713M);链脲佐菌素(STZ,上海懋康生物科技有限公司,批号:MS1601);BCA蛋白定量试剂盒(武汉赛维尔生物科技有限公司,批号:CR2101016);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、总抗氧化能力(T-AOC)试剂盒(合肥莱尔生物科技有限公司,批号:20191022);反转录试剂盒、荧光定量PCR试剂盒(北京百泰克生物技术有限公司,批号:B012010020)。
1.1.3 主要仪器设备
7220G可见分光光度计(上海精密科学仪器有限公司);TGL-16M高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);数显恒温水浴锅DK-S26(上海三发科学仪器有限公司);DYY-7C型电泳仪(北京市六一仪器厂);BS124S电子天平(德国赛多利斯股份公司);TSE-240(-80 ℃)超低温冰箱(赛默飞世尔科技公司);TS-DI-20L/H实验室超纯水设备(陶氏水处理设备工程有限公司);Applied biosystems PCR仪(美国应用生物系统公司);三诺血糖仪(三诺生物传感股份有限公司,GA-3型)。
1.2 实验方法
1.2.1 动物分组、造模及给药
实验室适应性饲养1周后,测定小鼠初始血糖及体质量,按体质量随机分为空白对照组、水模型对照组、DMSO模型对照组、牡荆素高剂量组(以下简称高牡组)、牡荆素中剂量组(以下简称中牡组)、牡荆素低剂量组(以下简称低牡组)、阳性对照组,每组12只,组间体质量差异不显著。各模型组小鼠按150 mg/kg腹腔注射浓度为1%的链脲佐菌素,构建1型糖尿病小鼠模型,空白对照组注射等量的柠檬酸钠溶液,注射前禁食12 h,注射后可自由饮食、饮水,并于注射72 h后测定小鼠空腹血糖浓度,小鼠空腹血糖≥11.1 mmol/L,造模成功[12,13]。模型制备成功后,每天定时灌胃,设置灌胃梯度剂量[14],高牡组、中牡组、低牡组分别灌胃40、20、10 mg/kg的牡荆素,阳性对照组灌胃300 mg/kg的盐酸二甲双胍,DMSO模型对照组灌胃DMSO,水模型对照组及空白对照组灌胃等量蒸馏水。各组小鼠自由饮食、饮水,自然光照,室温下灌胃4周。
1.2.2 生化指标检测
末次灌胃结束后,小鼠禁食禁水12 h后,各组小鼠摘眼球取血后脱颈处死,用试剂盒法测定各组动物血清及肝脏中SOD、MDA、T-AOC、GSH-PX含量水平,用试剂盒法测定小鼠血清和肝脏组织中SOD、GSH-PX、T-AOC酶活性。
1.2.3 抗氧化酶相关基因表达测定
引物根据Collin[15]和Bult[16]设计(见表1),由上海生物工程有限公司进行合成。qRT-PCR反应体系见表2。

表1 引物信息

表2 qRT-PCR反应体系
利用Trizol法提取各组小鼠肝脏的总RNA,根据反转录试剂盒说明书操作,将总RNA反转录成cDNA并作为模板。
按照表2的反应体系,以肝脏cDNA为模板,GAPDH引物为内参,使用荧光定量PCR进行测定,两步法流程:94 ℃预变性2 min,94 ℃变性15 s,60 ℃退火/延伸30 s,重复上述,循环40次,循环结束后检测其溶解曲线,计算2-△△Ct。
1.2.4 数据分析
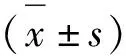
2 结果与分析
2.1 牡荆素对1型糖尿病小鼠血糖的影响
不同剂量牡荆素对1型糖尿病小鼠血糖的影响见表3。实验期间,DMSO对照组和水模型对照组小鼠血糖浓度持续上升,各牡荆素实验组和阳性对照组小鼠血糖浓度总体呈下降趋势。实验结束后,各牡荆素实验组小鼠血糖均极显著低于DMSO模型对照组和水模型对照组(P<0.01),并且中牡组和低牡组与阳性对照组相比组间差异不显著(P>0.05)。
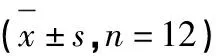
表3 不同剂量牡荆素对1型糖尿病小鼠血糖的影响
2.2 牡荆素对1型糖尿病小鼠血清中SOD、T-AOC、GSH-PX和MDA的影响
不同剂量牡荆素对1型糖尿病小鼠血清中SOD、T-AOC、GSH-PX和MDA的影响见表4。小鼠血清中各牡荆素实验组SOD和T-AOC酶活性极显著高于空白对照组、DMSO模型对照组和水模型对照组(P<0.01),GSH-PX酶活性极显著高于DMSO模型对照组和水模型对照组(P<0.01),MDA含量极显著低于DMSO模型对照组和水模型对照组(P<0.01)。
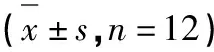
表4 不同剂量牡荆素对1型糖尿病小鼠血清中SOD、T-AOC、GSH-PX和MDA的影响
2.3 牡荆素对1型糖尿病小鼠肝脏中SOD、T-AOC、GSH-PX和MDA的影响
不同剂量牡荆素对1型糖尿病小鼠肝脏中SOD、T-AOC、GSH-PX和MDA的影响见表5。小鼠肝脏中各牡荆素实验组SOD、T-AOC、GSH-PX酶活性均极显著高于DMSO模型对照组和水模型对照组(P<0.01),其中T-AOC酶活性极显著高于阳性对照组(P<0.01);各牡荆素实验组MDA含量比DMSO模型对照组和水模型对照组极显著降低(P<0.01)。
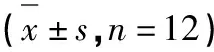
表5 不同剂量牡荆素对1型糖尿病小鼠肝脏中SOD、T-AOC、GSH-PX和MDA的影响
2.4 牡荆素对1型糖尿病小鼠体内抗氧化基因相对表达量的影响结果
不同剂量牡荆素对1型糖尿病小鼠体内抗氧化基因相对表达量的影响结果见图1、2。小鼠肝脏中各牡荆素实验组SOD-1、SOD-2、GPX-1、GPX-4基因的表达量均极显著高于DMSO模型对照组和水模型对照组(P<0.01),其中中牡组SOD-2和GPX-4基因表达量与阳性对照组相比差异不显著(P>0.05)。
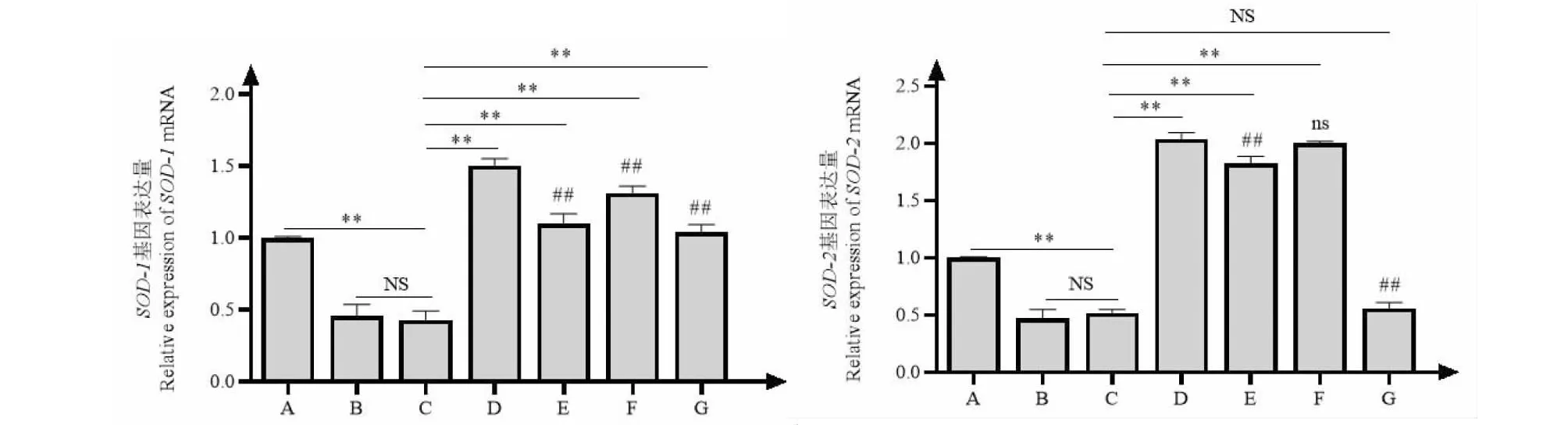
图1 不同剂量牡荆素对Ⅰ型糖尿病小鼠SOD-1基因和SOD-2基因的表达
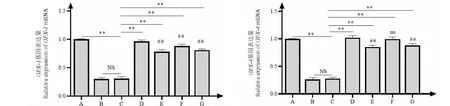
图2 不同剂量牡荆素对1型糖尿病小鼠GPX-1和GPX-4基因的表达
3 讨论与结论
本研究发现牡荆素能降低1型糖尿病小鼠血糖浓度,明显增强总抗氧化能力T-AOC,显著增加SOD、GSH-PX的酶活性及相关基因的表达,极显著降低MDA含量。
血糖是身体细胞、组织、器官重要的能量来源[17]。Ayeh等[18]研究表明,槲皮素具有降糖作用。也有研究表明,鱼腥草总黄酮能降低1型糖尿病小鼠的血糖。上述研究均表明黄酮类化合物具有降糖作用。本实验结果显示,牡荆素可降低1型糖尿病小鼠血糖浓度,与上述研究结果相一致。胰岛素是体内唯一降糖激素[19],通过其含量可判断糖尿病病变程度。糖尿病患者体内自由基含量多于正常个体,过多的自由基攻击胰岛β细胞使胰岛素含量严重不足,导致葡萄糖无法被利用,使得糖尿病患者体内血糖浓度上升。牡荆素之所以能够降低1型糖尿病小鼠血糖浓度,其原因可能是牡荆素可清除体内自由基,抑制自由基对胰岛β细胞的攻击,从而减少胰岛素含量的下降,增加葡萄糖的利用率,从而达到降血糖的作用,体内葡萄糖含量降低。
高糖状态下可升高机体氧化应激,增加体内自由基含量,下调抗氧化能力。由于心脏代谢活性很高,抗氧化能力很低,所以更容易造成氧化损伤,糖尿病患者体内一氧化氮合酶(NOS)和NO含量显著增加或是糖尿病心肌病产生的原因之一。氧化应激可通过多种途径改变血流动力学,对肾脏造成损伤,造成肾功能异常。过多的自由基会攻击胰岛β细胞造成胰腺损伤,并随着体内自由基含量的增多,胰岛β细胞逐渐减少,胰岛素含量下降,导致机体抑制肝糖原分解的能力下降,使肝糖原含量降低,故而造成肝脏损伤,除此之外,过多的自由基还会增加炎症因子含量,使机体免疫力降低,造成脾脏损伤的同时也会造成肺脏损伤。牡荆素对各器官具有保护作用的原因可能是牡荆素可抑制体内自由基的产生,减少NOS和NO含量,从而起到保护心脏的作用,自由基的减少还可削弱对胰岛β细胞的攻击,保护胰腺并增加胰岛素含量,使葡萄糖利用率提高,抑制肝糖原糖异生,使肝糖原含量得到有效提高,从而起到保护肝脏的效果。由于体内自由基含量的减少,体内的炎症因子含量也逐渐减少,降低了炎症因子对肺脏的攻击,由于机体免疫力逐渐恢复,参与免疫调节的脾脏也得到了很好的改善。抗氧化能力得到有效提升,氧化应激降低,血流动力学得到改善,从而降低肾脏的损伤。
目前研究显示,糖尿病发病机制复杂,其重要的发病机制为活性氧自由基积累使机体抗氧化能力下降[20]。Luo等[21]研究表明,牡荆素可抑制自由基生成。本试验结果显示,牡荆素均能显著提高血清和肝脏中SOD、GSH-PX以及T-AOC酶活性,并降低MDA含量,其原因可能有以下几个方面,一是自由基能与牡荆素中的酚羟基发生反应,生成半琨式自由基,由于其性质较稳定,自由基链式反应被终止,机体抗氧化能力提高。二是自由基过多会引起脂质过氧化反应,使MDA含量增加,牡荆素可抑制脂质过氧化,从而降低血清和肝脏中MDA的含量,提高机体抗氧化作用。三是在细胞中存在Fenton反应(Fe2++ H2O2→Fe3++·OH+·OH-),牡荆素可与Fe2+发生络合反应,络合位点在4-羰基和5-羟基之间,络合Fe2+可有效减少·OH的生成,形成络合物沉淀,减少自由基,提高机体抗氧化能力。牡荆素可提高1型糖尿病小鼠肝脏和血清中SOD、GSH-PX以及T-AOC的酶活性,降低MDA含量,使机体抗氧化能力得到有效提高。抗氧化酶的抗氧化作用与其基因表达密切相关。
机体氧化程度超出氧化物清除能力,氧化和抗氧化系统稳定性被破坏,造成氧化损伤[22]。低水平氧化应激状态下机体的抗氧化蛋白在抗氧化反应元件(antioxidant-response element,ARE)或亲电反应元件(electrophilic response element,EpRE)的顺式作用元件介导下被激活。ARE可从转录水平上调控抗氧化酶对机体氧化应激状态下的反应[23]。正常生理情况下,核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)与Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)相结合于胞浆中,活性被抑制,在泛素蛋白酶作用下降解,以保持在生理状态下Nrf2的低转录活性[24],当细胞处于氧化应激状态下时,原本相结合的Nrf2与Keap1解偶联,活化了的Nrf2进入细胞核后与小Maf蛋白形成二聚体,进而识别并结合ARE元件,启动下游基因转录,机体抗氧化酶的转录活性因此被提高,故而平衡机体氧化损伤[25]。
在本实验中,1型糖尿病小鼠经牡荆素灌胃4周后,肝脏中SOD-1、SOD-2、GPX-1及GPX-4四种抗氧化基因的表达量均有极显著提升,其原因可能有两方面,一方面可能由于1型糖尿病小鼠体内氧化应激较为严重,使机体抗氧化系统不足以平衡自由基的攻击,导致细胞严重氧化损伤,机体内源性抗氧化系统不足以清除自由基,牡荆素不但可消除体内自由基,亦可与金属离子发生络合作用,减少自由基和金属离子对细胞的氧化损伤,促进Nrf2的核内转位,增加Nrf2的表达,进而增加1型糖尿病小鼠肝脏中SOD-1、SOD-2、GPX-1及GPX-4基因的表达量。另一方面可能由于1型糖尿病小鼠SOD、GSH-PX、T-AOC酶活性降低,导致体内自由基增加,造成细胞氧化损伤,引起线粒体系统供能不足以及DNA、RNA转录受阻,使患病小鼠肝脏中抗氧化基因的表达量极显著降低。由于牡荆素具有清除体内自由基的作用,灌胃后,小鼠细胞中DNA、RNA转录得到改善,使1型糖尿病小鼠肝脏中SOD-1、SOD-2、GPX-1及GPX-4基因的表达量得到提高。Deng等[26]研究表明,槲皮素可激活乙醇孵育的人原代肝细胞中Nrf2的核转位表达。Ganesan等[27]研究表明,牡荆素通过激活β细胞调节凋亡的关键蛋白,包括NF-κB和Nrf2,从而改善胰岛素分泌。以上研究结果均与本实验结果相一致。
结果表明,牡荆素能极显著提高1型糖尿病小鼠血清和肝脏中SOD、GSH-PX以及T-AOC酶活性,降低MDA含量;显著上调1型糖尿病小鼠肝脏中SOD-1、SOD-2、GPX-1、GPX-4基因的表达量。综上,牡荆素可改善1型糖尿病氧化损伤,具有良好的抗氧化作用。

