千年健的化学成分及抗肿瘤活性研究
尹 伟,胡 琪,李新章,周清浩,郁 阳,胥振国,范高福,张国升
1合肥职业技术学院 生物工程学院,合肥 238000;2南通睿沣新材料技术有限公司 化学成分分离鉴定中心,南通 226000;3中国科学技术大学高分子科学与工程系 中科院软物质化学重点实验室,合肥 230026;4中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201;5安徽中医药大学 药学院,合肥 230031
千年健(Homalomenaocculta(Lour.)Schott.)作为天南星科千年健属植物,本属植物约有140余种,主要分布于亚洲及美洲等地区,在我国的云南、海南、广西、广东等地为主要分布区域[1]。千年健于2000年收录入《中国药典》,主要用于风寒,风湿等疾病的治疗。《本草纲目拾遗》中记载:“形如藤,长数尺,气极香烈”。千年健传统上主要以其干燥的根茎作为药用,同时为少数民族习用,在针对痉挛麻木、风湿、类风湿关节炎、腰腿疼痛、胃肠功能炎症以及骨折等方面具有很好的治疗作用[2]。有研究报道[3],该植物含有倍半萜、生物碱、酚酸以及挥发油等成分,具有很强的抗氧化、杀线虫、细胞毒性以及抑菌活性,同时具有一定程度的抗炎作用[4]。亦有研究表明[5],千年健中所含的倍半萜成分,能促进骨细胞增殖分化,间接抑制炎症因子一氧化氮、前列腺素E2以及环氧化酶2的释放,具有潜在的抗骨质疏松作用。本文在前期研究的基础上,进一步对千年健的化学成分进行分析,旨在发现具有抗肿瘤生理活性的化学成分,为完善天南星科植物的药用价值奠定基础。
1 材料与方法
1.1 仪器
质谱仪(VG Auto-Spec-3000,Micromass公司);核磁共振仪(Bruker DRX-500 MHz);Büchi B-688型高效液相制备色谱仪(Büchi公司,瑞士);旋转蒸发仪(RE-201,上海科兴仪器有限公司);酶标仪(BXS01-ELx-800,美国)。
1.2 药材与试剂
千年健(Homalomenaocculta(Lour.)Schott.)由南通睿沣新材料技术有限公司提供(No.rfzy20201008),由李新章、胡琪研究员鉴定为千年健。宫颈癌细胞(Hela)、人肺癌细胞(A549)、小鼠乳腺癌细胞(4T1)及人肝癌细胞(HepG2)(中国科学技术大学生科院)。肝癌细胞小鼠(H22、BALB/c),清洁级,4~5周(中国科学技术大学生科院);RPMI-1640培养基(北京君立康生物科技有限公司);乙酸乙酯、甲醇、乙醇、三氯甲烷(成都金山化学试剂有限公司);MTT(四甲基偶氮唑盐,上海拜力生物技术有限公司);甲氨蝶呤(河北阿尔泰生物科技有限公司);DMSO(二甲基亚砜,Sigma公司);Sephadex LH-20(50 μm,GE公司);硅胶和薄层色谱硅胶(青岛海洋化工公司);显色剂为碘蒸气或10%硫酸-乙醇溶液(105 ℃加热显色)或在紫外灯254 nm及365 nm处观察荧光。
1.3 提取与分离
称取8.0 kg干燥千年健,粉碎后,室温下用95%的乙醇浸提3次(每次36 h),用旋转蒸发仪将溶剂减压浓缩,最终得到浸膏约260 g。将浸膏中加入适量水混悬,依次用石油醚、乙酸乙酯、正丁醇有机溶剂进行充分萃取。随后,浓缩乙酸乙酯萃取部分,得到浸膏约120 g。
乙酸乙酯部分通过正相硅胶色谱分离(200~300目),三氯甲烷-甲醇洗脱系统(100∶0、100∶5、100∶10、100∶20、100∶50、100∶100,V/V)梯度顺序洗脱,经过薄层色谱(TLC)检测合并,最终得到6个部分(Fr.1~6)。Fr.1(29.7 g)经反复硅胶柱洗脱、纯化,最终使用Sephadex-LH20凝胶柱(三氯甲烷∶甲醇 = 1∶1,V/V)纯化,得到化合物1(22.3 mg)。Fr.2(22.7 g)通过反复硅胶柱分离,分别石油醚-丙酮洗脱(10∶1→0∶1,V/V),MPLC(中压制备,30%~100%乙腈,流速为1 mL/min),随后经过Sephadex-LH20(纯甲醇)凝胶柱纯化,得到化合物8(10.2 mg)、2(22.7 mg)、4(24.8 mg)、5(11.9 mg)。Fr.3(30.5 g)通过硅胶柱色谱分离,分别石油醚-乙酸乙酯洗脱(10∶1→0∶1,V/V),经Sephadex-LH20(三氯甲烷∶甲醇 = 1∶1,V/V)凝胶柱洗脱,丙酮重结晶得到化合物10(10.3 mg)、3(11.9 mg)。Fr.4(28.6 g)通过硅胶柱纯化,石油醚-三氯甲烷-甲醇(5∶4∶1,V/V)洗脱,通过制备薄层色谱,三氯甲烷-丙酮(3∶2,V/V)得化合物7(25.1 mg);经Sephadex-LH20凝胶柱(三氯甲烷∶甲醇 = 1∶1,V/V)洗脱纯化,得到化合物9(12.4 mg);经三氯甲烷-丙酮(3∶1,V/V),丙酮重结晶得化合物6(16.2 mg)。
1.4 细胞毒性试验
称取一定量化合物1~10,将其用DMSO溶解(二甲亚砜,浓度<3‰培养液体积分数),随后超声30 min,放冰箱冷藏,备用。体外抗肿瘤活性试验,采取MTT法进行[6]。将对数生长期的各种肿瘤细胞(HepG2、A549、4T1及Hela),稀释成单细胞混悬液,以约1×104个/mL,接种于96孔培养板上,每孔100 μL,放置培养箱中(37 ℃,5%的CO2),培养24 h后,除去培养液,加入不同浓度的待测化合物,继续培养48 h。在测试前,在接种板的每孔加入MTT(5 mg/mL,30 μL),继续孵育3 h。使用酶联免疫检测仪,测定各个化合物吸光度(A,490 nm波长)。其中,细胞抑制率=(1-OD试验组/OD对照组)×100%,分别计算得出每个化合物对各肿瘤细胞增殖抑制数值,其中,阳性对照药物为甲氨蝶呤,最终得出IC50值(50%的肿瘤细胞增殖抑制数值对应的每个化合物的具体浓度)。
2 实验结果
2.1 结构鉴定
化合物1白色粉末;ESI-MS:m/z479[M+Na]+,C30H48O3;1H NMR(500 MHz,DMSO-d6)δ:3.09(1H,dd,J= 11.3,5.0 Hz,H-3),3.02(1H,dt,J=10.9,4.8 Hz,H-19),4.58(1H,br s,H-20),0.92(3H,s,H-23),0.70(3H,s,H-24),0.80(3H,s,H-25),0.90(3H,s,H-26),0.90(3H,s,H-27),4.69(1H,br s,H-29a),4.47(1H,br s,H-29b),1.60(3H,s,H-30);13C NMR(125 MHz,DMSO-d6)δ:38.7(C-1),C-2(27.1),76.5(C-3),38.5(C-4),54.6(C-5),18.2(C-6),34.0(C-7),40.4(C-8),50.1(C-9),37.0(C-10),20.7(C-11),25.3(C-12),37.8(C-13),42.2(C-14),30.4(C-15),31.9(C-16),55.5(C-17),46.8(C-18),48.9(C-19),150.4(C-20),29.1(C-21),36.8(C-22),28.4(C-23),15.7(C-24),16.1(C-25),15.9(C-26),14.5(C-27),177.6(C-28),19.1(C-29),109.9(C-30)。以上数据与文献[7]报道基本一致,故鉴定化合物1为桦木酸。
化合物2白色粉末;ESI-MS:m/z521[M + Na]+,C32H50O4;1H NMR(500 MHz,CDCl3)δ:5.30(s,1H,H-12),4.53(s,1H,H-3a),2.86(dd,J= 13.4,3.5 Hz,1H,H-18b),2.10(s,3H,OAc),1.29(s,3H,Me),1.17(s,3H,Me),0.99(d,J= 8.8 Hz,6H,2×Me),0.93(s,3H,Me),0.91(s,3H,Me),0.78(s,3H,Me);13C NMR(125 MHz,CDCl3)δ:38.2(C-1),23.6(C-2),80.8(C-3),37.8(C-4),55.3(C-5),18.3(C-6),32.7(C-7),39.3(C-8),47.4(C-9),37.0(C-10),22.7(C-11),122.4(C-12),143.7(C-13),41.3(C-14),40.7(C-15),23.4(C-16),45.9(C-17),46.7(C-19),30.8(C-20),33.8(C-21),32.5(C-22),28.2(C-23),16.8(C-24),15.5(C-25),17.3(C-26),25.8(C-27),27.6(C-15),184.5(C-28),23.7(C-29),33.2(C-30),21.5(CH3CO),171.1(C=O)。以上数据与文献[8]报道基本一致,故鉴定该化合物2为 3β-acetoxyolean-12-en-28-oic acid。
化合物3白色粉末;ESI-MS:m/z479[M+Na]+,C30H48O3;1H NMR(500 MHz,DMSO-d6)δ:5.17(1H,t,J= 3.4 Hz,H-12),2.99(1H,dd,J= 5.1 Hz,H-3),1.10(3H,s,H-27),0.94(3H,s,H-23),0.97(3H,d,J= 6.8 Hz,H-29),0.90(3H,s,H-26),0.83(3H,d,J= 6.7 Hz,H-30),0.78(3H,s,H-24),0.71(3H,s,H-25);13C NMR(125 MHz,DMSO-d6)δ:38.1(C-1),22.6(C-2),76.9(C-3),38.6(C-4),52.6(C-5),17.2(C-6),36.4(C-7),38.8(C-8),47.3(C-9),38.0(C-10),23.4(C-11,C-23),124.8(C-12),138.7(C-13),41.8(C-14),32.8(C-15),21.4(C-16),47.0(C-17),54.7(C-18),30.1(C-19),28.5(C-20),27.6(C-21),36.2(C-22),16.7(C-24),16.4(C-25),15.3(C-26),27.1(C-27),178.6(C-28),18.3(C-29),23.9(C-30)。以上数据与文献[9]报道基本一致,故鉴定化合物3为熊果酸。
化合物4白色固体粉末;ESI-MS:m/z341[M + Na]+,C20H30O3;1H NMR(500 MHz,CDCl3)δ:5.24(dd,J= 12.1,2.5 Hz,1H,H-20),4.21(d,J= 12.1 Hz,1H,H-20),2.20~0.81(m,27H,Me);13C NMR(125 MHz,CDCl3)δ:19.8(C-2),36.8(C-3),37.5(C-4),50.2(C-5),21.5(C-6),38.7(C-7),43.8(C-8),49.3(C-9),42.1(C-10),16.6(C-11),24.8(C-12),47.2(C-13),39.7(C-14),56.8(C-15),78.1(C-16),23.5(C-17),22.2(C-18),175.7(C-19),73.0(C-20)。以上数据与文献[10]报道基本一致,故鉴定该化合物4为antriptolactone。
化合物5白色粉末;ESI-MS:m/z415[M-H]-,C21H20O9;1H NMR(500 MHz,DMSO-d6)δ:8.60(1H,s,OH),8.00(1H,d,J= 9.8 Hz,H-4),6.98(1H,s,H-5),6.79(2H,s,H-2′,6′),6.42(1H,d,J= 9.8 Hz,H-3),4.99(1H,d,J= 8.2 Hz,H-7′),4.41(1H,m,H-8′),3.86(3H,s,OMe),3.91(6H,s,2×OMe),3.76(1H,s,H-9′a),3.41(1H,m,H-9′b);13C NMR(125 MHz,DMSO-d6)δ:160.2(C-2),113.6(C-3),145.8(C-4),101.2(C-5),145.6(C-6),137.8(C-7),131.3(C-8),138.2(C-9),111.8(C-10),125.3(C-1′),105.7(C-2′,6′),148.2(C-3′,5′),136.7(C-4′),76.9(C-7′),77.5(C-8′),60.2(C-9′),56.7(3′,5′-OMe),56.1(6-OMe)。以上数据与文献[11]报道基本一致,故鉴定化合物5为黄花菜木脂素C。
化合物6无色针晶;ESI-MS:m/z257.1[M+H]+;1H NMR(500 MHz,DMSO-d6)δ:4.21(1H,d,J= 4.5 Hz,OH),4.00(1H,s,OH),3.71(1H,s,OH),3.21(1H,ddd,J= 11.5,4.5,4.5 Hz,H-1),1.92(1H,d,J= 13.6 Hz,H-5),1.17(3H,s,H-15),1.13(3H,s,H-12),1.12(3H,s,H-13),0.91(3H,s,H-14);13C NMR(125 MHz,DMSO-d6)δ:78.9(C-1),40.6(C-2),41.8(C-3),70.5(C-4),59.6(C-5),32.2(C-6),51.9(C-7),32.6(C-8),28.6(C-9),47.3(C-10),70.8(C-11),31.9(C-12),30.8(C-13),15.3(C-14),30.7(C-15)。以上数据与文献[12]报道基本一致,故鉴定化合物6为bullatantriol。
化合物7白色无定形粉末;ESI-MS:m/z257.1[M+ H]+;1H NMR(500 MHz,(CD3)2CO)δ:4.38(1H,dd,J=11.3,4.3Hz,H-6),3.29(1H,dd,J=9.9,4.4 Hz,H-1),1.80(1H,d,J=11.2 Hz,H-5),1.32(3H,s,H-15),1.17(3H,d,J=6.9 Hz,H-12),0.97(3H,d,J=6.8 Hz,H-13);13C NMR(125 MHz,(CD3)2CO)δ:78.9(C-1),28.6(C-2),36.1(C-3),73.0(C-4),50.9(C-5),72.3(C-6),47.5(C-7),22.7(C-8),36.1(C-9),40.9(C-10),25.4(C-11),21.7(C-12),24.1(C-13),13.8(C-14),23.8(C-15)。以上数据与文献[13]报道基本一致,故鉴定化合物7为菠萝香藤素。
化合物8白色无定形粉末;ESI-MS:m/z257.2[M+H]+;1H NMR(500 MHz,(CD3)2CO)δ:3.90(1H,dd,J= 12.9,9.7 Hz,H-6),3.15(1H,dd,J= 11.5,4.6 Hz,H-1),1.10(1H,d,J= 9.5 Hz,H-5),1.47(3H,s,H-15),1.08(3H,s,H-14),0.91(3H,d,J= 6.6 Hz,H-12),0.86(3H,d,J= 6.9 Hz,H-13);13C NMR(125 MHz,(CD3)2CO)δ:78.6(C-1),27.3(C-2),41.7(C-3),71.3(C-4),57.0(C-5),68.7(C-6),52.0(C-7),18.6(C-8),38.0(C-9),41.0(C-10),25.9(C-11),20.8(C-12),15.7(C-13),12.2(C-14),34.0(C-15)。以上数据与文献[14]报道基本一致,故鉴定化合物8为mucrolidin。
化合物9黄色粉末;ESI-MS:m/z257[M+H]+,C15H14O4;1H NMR(500 MHz,CDCl3)δ:12.13(1H,s,5-OH),10.87(1H,s,7-OH),7.33~7.57(5H,m,Ph),5.95(1H,d,J= 2.1 Hz,H-8),5.61(1H,d,J= 2.1 Hz,H-6),5.53(1H,dd,J= 12.3,2.5 Hz,H-2),3.21(1H,dd,J= 17.2,12.4 Hz,H-3a),2.73(1H,dd,J= 17.2,3.7 Hz,H-3b);13C NMR(125 MHz,CDCl3)δ:79.4(C-2),43.6(C-3),193.2(C-4),163.8(C-5),95.0(C-6),167.1(C-7),96.3(C-8),162.6(C-9),100.3(C-10),138.1(C-1′),127.8(C-2′,6′),129.1(C-3′,5′),127.6(C-4′)。以上数据与文献[15]报道基本一致,故鉴定该化合物9为 pinocembrin。
化合物10黄色固体粉末;ESI-MS:m/z177[M-H]-,C10H10O3;1H NMR(500MHz,CDCl3)δ:9.57(1H,t,J= 6.7 Hz,H-3),7.33~7.37(1H,m,H-2′),7.11(1H,dd,J= 8.1,1.7 Hz,H-6′),7.07(1H,d,J= 1.5 Hz,H-5′),6.85(1H,dd,J= 11.4,7.6 Hz,H-1),6.50(1H,dd,J= 15.3,7.9 Hz,H-2),3.84(3H,d,J= 4.4 Hz,OMe);13C NMR(125 MHz,CDCl3)δ:126.2(C-1),126.7(C-2),194.3(C-3),55.8(-OMe),147.4(C-1′),109.9(C-2′),153.6(C-3′),149.5(C-4′),115.2(C-5′),124.3(C-6′)。以上数据与文献[16]报道基本一致,故鉴定该化合物10为 3-(4-hydroxy-3-methoxyphenyl)-propenal。
2.2 体外抗肿瘤活性试验
2.2.1 细胞毒性试验
采用SPSS 22.0软件,数据分析采用t检验,检验水准α= 0.05,以P< 0.05表示差异符合统计学概念。对各化合物进行体外抗肿瘤活性筛选,通过抗肿瘤药物甲氨蝶呤作为阳性对照,研究各化合物对肿瘤细胞的细胞毒活性。细胞毒活性试验结果显示,化合物2、4、9对四株肿瘤细胞(Hela、HepG2、4T1、A549)的增殖具有相应的抑制作用,能够在一定程度抑制上述四种肿瘤细胞的生长。化合物2、4、9的细胞毒活性数据见表1。

表1 化合物2、4、9的细胞毒活性
2.2.2 化合物的细胞毒性(活细胞/死细胞分析)
为了直观的分析化合物2、4、9的细胞毒性,本研究选取4T1肿瘤细胞,具体实验步骤,参考了文献[17]。分析各化合物对4T1的细胞毒性。直接观察化合物处理后的细胞状态(经AM/PI染色处理后的各种图像),其中活细胞(绿色)、死细胞(红色),与不同剂量抗肿瘤药物甲氨蝶呤(2 μg/mL,20 μg/mL)对比,化合物2、4、9也具有良好的抗癌能力,与上述细胞毒性的试验(MTT法)结论一致。结果如图1所示。

图1 化合物2、4、9及甲氨蝶呤药物对4T1细胞处理后状态
2.2.3 细胞毒性机理试验
通过上述“2.2.2”的各化合物对肿瘤细胞的毒性试验,发现化合物2、4、9对各肿瘤细胞有较强的损伤,为了具体评估各化合物对肿瘤细胞的损伤情况,本研究进行了单细胞凝胶电泳实验,即“彗星”试验。选取4T1肿瘤细胞,使用不同剂量抗肿瘤药物甲氨蝶呤(2 μg/mL,20 μg/mL)作为对照,分析其细胞DNA的损伤情况。试验步骤参照文献[18]进行,结果如图2所示。
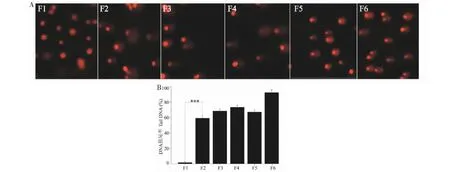
图2 单细胞凝胶电泳实验
2.3 化合物体内抑瘤试验
通过4T1荷瘤小鼠,观察化合物2、4、9的抑瘤效果,参照文献方法[19,20],得到小鼠肿瘤的指标生长曲线。将4T1荷瘤小鼠随机分成5组(PBS组、化合物2组、化合物4组、化合物9组、甲氨蝶呤组),在随后的第0、3、6、9天,对小鼠腹腔注射待测化合物2、4、9及抗肿瘤药物甲氨蝶呤(阳性对照组),药物浓度均为10 mg/kg(按小鼠体重计),其中,PBS组(生理盐水)为对照组。给药后的21天,将小鼠处死,记录小鼠的肿瘤的生长状态(体积、重量等)。结果如图3所示。

图3 荷瘤小鼠的抑瘤试验
3 结论
本文主要研究了千年健的化学成分及抗肿瘤作用,应用中压制备液相、Sephadex LH-20等分离手段,从千年健醇提溶液中分离得到10个化合物。除化合物7、8外,本实验所分离得到的其余化合物,均为首次从千年健植物中分离。
研究发现了化合物2、4、9对4T1、A549、Hela及HepG2肿瘤细胞有很强的毒性。在对4T1荷瘤小鼠的体内试验时,化合物2、4、9组对荷瘤小鼠小的肿瘤生长指标(肿瘤体积、重量等)方面,与甲氨蝶呤的治疗对比,有较强的效果。
本文在前期研究的基础上,针对千年健的化学成分、体内、外的抗肿瘤作用等多方面进行研究,旨在发现千年健中具有抗肿瘤生理活性的化学成分,从而进一步完善天南星科植物的药用价值。

