汉黄芩苷通过上调SIRT1表达减轻糖尿病视网膜病变引起的细胞和组织损伤
糖尿病视网膜病变(DR)是糖尿病引起的严重并发症之一,也是糖尿病患者致盲的主要原因。糖尿病视网膜病变的主要病理过程是视网膜微血管内皮细胞(hRMECs)功能障碍。有研究发现高血糖介导的炎症、氧化应激可导致hRMECs功能障碍,血管壁削弱的同时内皮细胞异常增殖,促进血管渗漏和功能不全,进而引起正常血管的失衡和异常新生血管的形成,最终导致出血、牵拉性视网膜脱离,甚至视力丧失。因此,抑制hRMECs功能障碍和视网膜组织损伤,有助于延缓或阻止DR的病理进程。
SIRT1 是一种依赖烟酰胺腺嘌呤二核苷酸辅酶(NAD+)的去乙酰化酶,与许多蛋白质的翻译修饰密切相关,SIRT1通过去除转录因子中的乙酰基,参与调节血管内皮生长因子(VEGF)、缺氧诱导因子(hif)、转化生长因子β1 等多种细胞因子的表达。因此,它可能参与了多种与DR进展相关的生物学过程,如细胞增殖、迁移和凋亡。
黄连解毒汤是一种中药汤剂,因其具有降糖、改善糖尿病肾损伤的作用,临床上常应用于糖尿病的治疗。汉黄芩苷是黄连解毒汤中黄芩的主要类黄酮有效成分,具有抗炎、抗氧化的作用。研究发现汉黄芩苷可以有效改善小鼠关节炎和脂多糖诱导的急性肺损伤,能通过保护肠屏障功能障碍和抑制NF-κB及NLRP3炎症小体的激活来减轻结肠炎。此外,汉黄芩苷通过Toll-like receptor 4、Wnt/β-catenin及hedgehog等信号通路抑制血管形成。以上研究表明汉黄芩苷通过抑制炎症和氧化应激在多种疾病中发挥作用。此外,有报道称汉黄芩苷可通过促进SIRT1表达和抑制p53激活,在大鼠脑水肿发展中发挥作用。而MiR-221/SIRT1/Nrf2信号轴也是调控DR进展的主要调控机制之一。但是关于汉黄芩甙在糖尿病视网膜病变中的作用尚未被报道。
本研究一方面通过高糖诱导人视网膜微血管内皮细胞(hRMECs)构建体外DR模型,另一方面通过链脲佐菌素(STZ)诱导的SD大鼠糖尿病视网膜的损伤构建体内DR模型,探讨汉黄芩苷对在体内外对细胞和视网膜组织损伤的影响及其对SIRT1的调控作用,为治疗糖尿病视网膜病变提供新的方向和理论基础。
1 材料和方法
1.1 材料和主要试剂
hRMECs(ATCC);DMEM培养基、胰蛋白酶、胎牛血清(Thermo Fisher)。SPF级雄性SD大鼠40只(上海市实验动物研究中心),体质量250~300 g,周龄8~10周。根据随机数字表法将小鼠分为对照组(Sham组)、模型组(STZ组)、汉黄芩苷组(Wog组)和汉黄芩苷治疗组(STZ+Wog 组),10 只/组。链脲佐菌素、汉黄芩苷、葡萄糖和甘露醇(西格玛奥德里奇(上海)贸易有限公司);ROS试剂盒、CCK-8试剂盒(北京碧云天生物科技有限公司);NO 试剂盒、IL-1β ELISA 检测试剂盒、IL-6 ELISA检测试剂盒(上海酶联生物科技有限公司);谷胱甘肽-S转移酶(GSH-ST)试剂盒(上海沪峥生物科技有限公司);SIRT1兔单克隆抗体、VEGF兔单克隆抗体、HIF-1α兔单克隆抗体、actin兔多克隆抗体以及辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白IgG 二抗(Abcam)。
1.2 方法
1.2.1 细胞培养与模型构建 hRMECs 生长于含10%FBS、100 μg/mL链霉素和100 μg/mL青霉素的DMEM培养基中,在37 ℃、5%CO的培养箱中进行培养,每2~3 d更换一次培养基。将处于对数生长期的hRMECs细胞分为4组:对照组(NG),用5 mmol/L的葡萄糖处理hRMECs;渗透对照组(MA),用5 mmol/L的葡萄糖加上25 mmol/L 的甘露醇(MA)处理hRMECs;高糖组(HG),用30 mmol/L的葡萄糖处理hRMECs,模拟糖尿病的体外模型;处理组(HG+Wog):在30 mmol/L的葡萄糖诱导条件下,加入不同浓度的汉黄芩苷(10、20、30、40 μmol/L)处理hRMECs。
易太太道:“不买还要听你这些话!”说着打出一张五筒,马太太对面的黑斗篷啪啦摊下牌来,顿时一片笑叹怨尤声,方剪断话锋。
1.2.5 Transwell实验检测细胞迁移 将各组细胞重悬于无血清的高糖DMEM中,根据说明书取200 μL细胞悬液放置在小室上层,下室加入500 μL培养基,培养箱孵育24 h后,用干净棉签轻轻拭去上室细胞,甲醇固定20 min并用0.1%结晶紫染色15 min后,在显微镜下观察并拍照、计算迁移细胞数。
后续实验中将hRMECs 细胞分为5 组:对照组(NG),用5 mmol/L 的葡萄糖处理hRMECs;高糖组(HG),用30 mmol/L的葡萄糖处理hRMECs,模拟糖尿病的体外模型;汉黄芩苷组[HG+Wog(30 μmol/L)],在30 mmol/L的葡萄糖诱导条件下,加入30 μmol/L汉黄芩苷处理hRMECs;HG+Wog(30 μmol/L)+si-NC组,在30 mmol/L葡萄糖和30 μmol/L汉黄芩苷共处理条件下,转染si-NC至hRMECs;HG+Wog(30 μmol/L)+si-SIRT1组,在30 mmol/L葡萄糖和30 μmol/L汉黄芩苷共处理条件下,转染si-SITR1至hRMECs。
炸薯条、醋熘土豆丝、土豆饼、土豆沙拉、土豆泥,这些想想就会让人垂涎欲滴的美味菜肴都是用土豆做出来的。不过,土豆这种再普通不过的蔬菜却有着坎坷的历史。
1.2.2 动物模型构建 所有大鼠入组前均给予适应性喂养,时间持续1周;试验前所有大鼠均禁食12 h,STZ组和STZ+Wog 组腹腔注射腹腔注射0.1 mol/L柠檬酸缓冲液(pH=4.5)溶解的STZ,剂量为60 mg/kg,Sham组和Wog组则注射等剂量的柠檬酸缓冲液;在注射48 h后通过血糖仪测定大鼠尾静脉的血糖,如果血糖在16.7 mol/L以上则表示糖尿病大鼠模型建立成功。模型建立1周后,Wog组和STZ+Wog组给予30 mg/(kg·d)的汉黄芩苷治疗,连续治疗6周。模型组和对照组大鼠给予等量的生理盐水,连续注射6周。在最后1 d,3%戊巴比妥钠(50 mg/kg)腹腔麻醉,并摘除双侧眼球分离视网膜,一部分用于HE染色,一部分保留在-80 ℃用于其他实验。
取得综合所得,需要办理汇算清缴的情形包括:一)从两处以上取得综合所得,且综合所得年收入额减除专项扣除的余额超过6万元;(二)取得劳务报酬所得、稿酬所得、特许权使用费所得中一项或者多项所得,且综合所得年收入额减除专项扣除的余额超过6万元;(三)纳税年度内预缴税额低于应纳税额;(四)纳税人申请退税。
1.2.4 CCK-8检测细胞活性 将处理后的各组细胞接种于96孔板中,细胞密度为4×10/孔。培养24 h后,向细胞中加入10 μL/孔CCK-8溶液,37 ℃孵育1.5 h后,酶标仪检测波长450 nm处的细胞吸光度()。
1.2.3 细胞转染 为了敲低SIRT1表达,si-SIRT1干扰序列及其阴性对照(广州锐博生物)按照脂质体转染试剂Lipofectamine2000说明书将si-SIRT1干扰序列及其阴性对照分别转染至对应细胞分组中。qRT-PCR检测转染效率。
本评分模型纳入预后因素时未加入双磷酸盐的使用,原因是本研究中几乎所有骨转移患者皆使用过双膦酸盐,且双膦酸盐的使用对骨转移患者预后的影响已基本明确,已成为常规治疗方案[14]。本评分模型的缺点在于只基于一家医疗机构的数据,存在选择偏倚,且纳入因素有九个之多,准确性和实用性尚需更大样本数据的检验,需要本机构和其他医疗机构在日后临床工作中进行实践,不断改进,更加准确的指导临床。
1.2.6 小管形成实验检测血管生成 将300 μL Matrigel均匀铺在24孔板中,37 ℃静置1 h后,将各组细胞接种于24孔板中,细胞密度为1×10/孔,37 ℃、5%CO培养24 h后,在显微镜下观察并拍照。
1.2.13 Western blot检测VEGF、HIF-1α、SIRT1蛋白水平 收集各组细胞和大鼠视网膜组织,用预冷的全蛋白裂解液冰上裂解10 min后,分别提取细胞以及视网膜组织的总蛋白,BCA法测定蛋白浓度。定量20 μg上样,10%凝胶电泳SDS-PAGE 100 mV恒压,60 mV恒压转膜,封闭,加一抗4 ℃下孵育过夜,加辣根过氧化酶标记的二抗山羊抗兔IgG,室温下孵育120 min,之后用ECL试剂盒(Solarbio)进行发光反应,拍照观察蛋白印记;并用Image J软件分析蛋白的相对表达水平。
1.2.8 ELISA检测IL-1β、IL-6水平 将处于对数生长期的细胞接种于24孔板中,收集各组细胞上清培养液,随后按照试剂盒说明书检测促炎因子IL-1β、IL-6的水平,多功能酶标仪在450 nm处测定吸光度。
1.2.9 NO含量检测 将处于对数生长期的细胞接种于24孔板中,收集各组细胞上清培养液,随后按照试剂盒说明书检测上清液中NO的含量,使用多功能酶标仪在550 nm处测定。
1.2.10 ROS水平检测 将处于对数生长期的细胞接种于6孔板中,按照分组处理各组细胞后,弃上清,PBS洗涤3次。将视网膜组织同样用PBS洗涤3次后,通过匀浆法充分匀浆后离心20~30 min(2000 r/min),仔细收集上清,加入1 mL浓度为10 μmol/L 的DCFH-DA,37 ℃黑暗条件下孵育20 min。多功能酶标仪使用488 nm激发波长,521 nm发射波长检测细胞和组织中的ROS活性。
在Amos 24.0中输出标准化路径系数图,结果显示,免费开放感知对公园满意度、地方依赖以及地方认同有正向影响,公园满意度对地方依赖和地方认同有正向影响,但是“免费开放→地方认同”和“满意度→地方认同”的路径系数太小,地方依赖对地方认同有正向影响且路径系数最大,与预测测量模型大致相同.在研究后对模型进行修改,将“满意度→地方认同”以及“免费开放→地方认同”这两条路径删除,得到现模型(图3)以及变量相互之间的关系(表3),并进行拟合度检验,所有指标都达到标准水平(表4).
1.2.12 qRT-PCR检测IL-1β、IL-6 mRNA水平 收集各组细胞和视网膜组织,使用Trizol(Invitrogen)试剂盒分别从细胞和视网膜组织中提取总RNA。使用反转录系统试剂盒(Invitrogen)合成cDNA。按照说明书使用miScript SYBR Green PCR Kit(Qiagen,Germany)进行qRT-PCR。以GAPDH为内参进行归一化处理,结果用2值来比较目的基因相对表达量的差异。实验所用引物见表1。

1.2.7 单层细胞膜通透性检测 将5×10细胞接种在Transwell小室上室中,37 ℃、5%CO培养至细胞融合成单层后,按上述实验分组处理各组细胞。在上室加入100 μL的异硫氰酸荧光素-右旋糖酐(FITC-Dextran),下室加入600 μL不含血清的DMEM培养基,培养1 h后,取下室100 μL培养基置于96孔板中,多功能酶标仪在492 nm处测定荧光强度。
1.2.14 苏木精伊红(HE)染色实验 大鼠眼球切除术后,4%多聚甲醛浸泡固定48 h,梯度乙醇脱水视网膜,石蜡包埋切片后用二甲苯脱蜡,依次用浓度下降的乙醇(99.9%、97%、75%、50%)和蒸馏水冲洗。切片用苏木精染色1~3 min,1%盐酸乙醇分化20 s用PBS冲洗30 s。切片用伊红染色1 min,梯度乙醇脱水,二甲苯清洗后密封。各组切片在高倍光学显微镜下观察大鼠视网膜结构完整性、视网膜组织厚度以及有无增生并拍照。
1.3 统计学分析
汉黄芩苷结构式如图1A,CCK-8实验结果显示0~40 μmol/L的汉黄芩苷单独处理对hRMECs细胞活性影响无统计学意义(>0.05,图1B)。高糖处理后,汉黄芩苷可浓度依赖性地抑制hRMECs异常增殖(<0.05,图1C)。Transwell小室实验结果显示,与对照组相比,高糖诱导下的hRMECs迁移能力增加(<0.001);与高糖组相比,汉黄芩苷的处理抑制高糖条件下hRMECs的迁移,且该影响呈浓度依赖性(<0.05,图1D)。
1.2.11 GSH-ST活性检测 将处于对数生长期的细胞接种于6孔板中,按照分组处理各组细胞后,弃上清,加入500 μL PBS制成细胞混悬液,超声裂解后,按照试剂盒说明书检测GSH-ST含量,采用多功能酶标仪在540 nm处测定吸光度。
2 结果
2.1 汉黄芩苷呈浓度依赖性抑制高糖诱导的hRMECs异常增殖和迁移
所有实验均进行3 次平行实验,并用GraphPad Prism8.0进行统计学分析,计量资料采用均数±标准差表示,两组间比较采用独立样本检验,多组间比较采用单因素方差分析,<0.05为差异具有统计学意义。
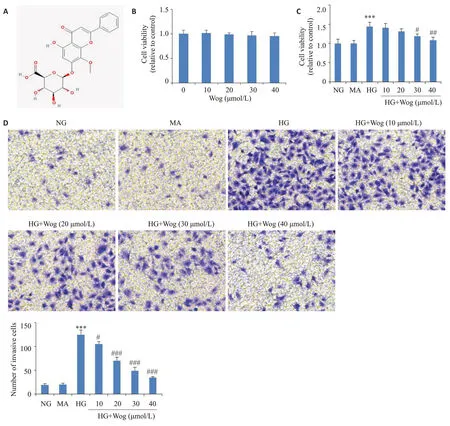
2.2 汉黄芩苷呈浓度依赖性抑制高糖条件下hRMECs的小管形成和细胞膜通透性
小管形成实验结果显示,与对照组相比,高糖环境促进hRMECs的小管形成能力(<0.05);与高糖组相比,不同浓度的汉黄芩苷抑制高糖诱导hRMECs的小管形成,且呈剂量依赖性(<0.05,图2A)。Western blot结果显示,与对照组相比,高糖组新血管相关蛋白(VEGF、HIF-1α)表达升高(<0.05);与高糖组相比,汉黄芩苷处理后,新血管相关蛋白(VEGF、HIF-1α)表达降低,且随着剂量增大,抑制作用愈发明显(<0.001,图2B)。单层细胞膜通透性检测实验发现,与对照组相比,高糖组细胞膜通透性增加(<0.001);与高糖组相比,经10 μmol/L汉黄芩苷处理后细胞膜通透性未发生明显改变,经20、30、40 μmol/L汉黄芩苷处理后,细胞膜通透性随汉黄芩苷浓度梯度增加而降低(<0.001,图2C)。
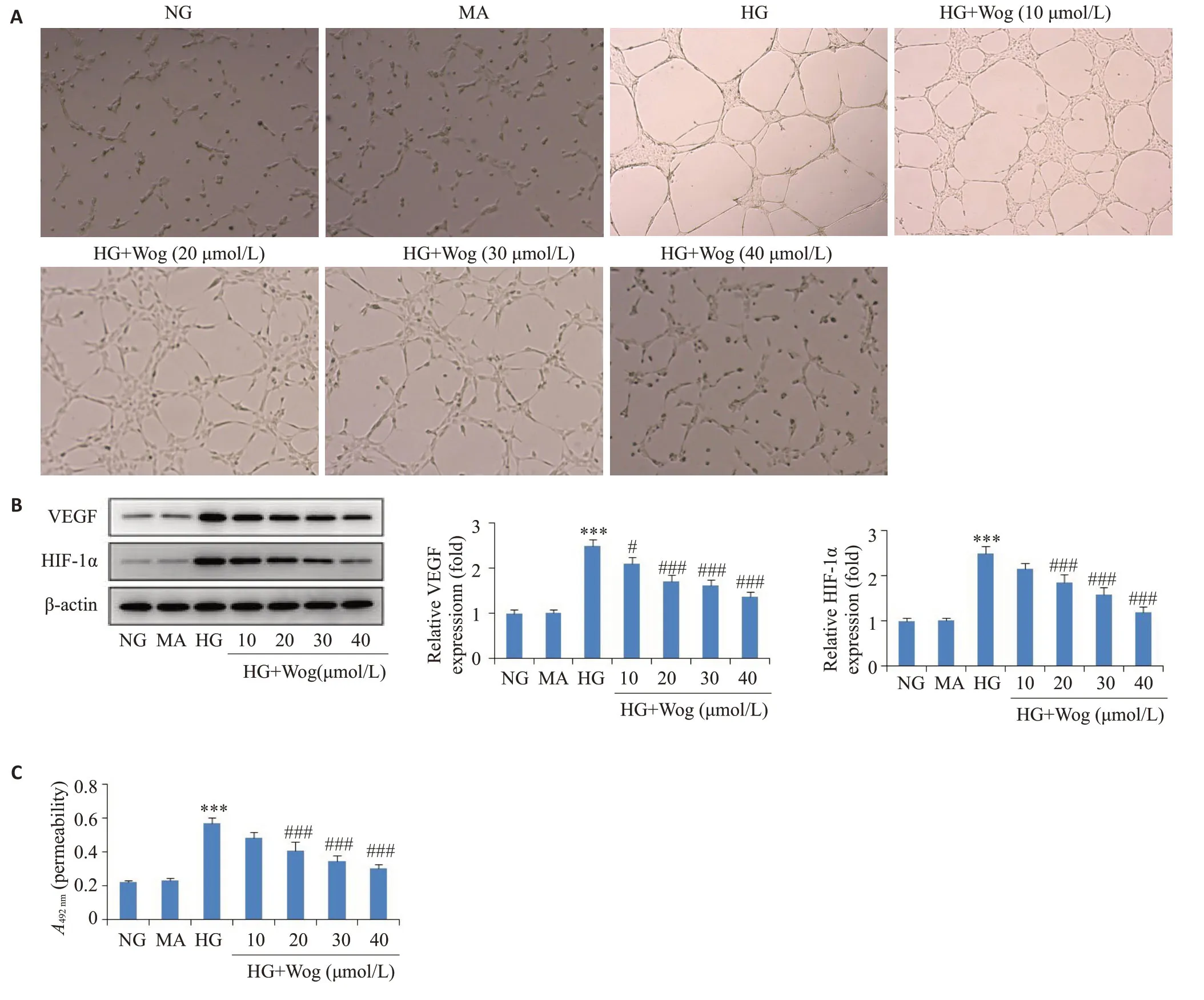
2.3 汉黄芩苷呈浓度依赖性减轻高糖诱导的hRMECs的氧化应激和炎症反应
ROS和NO实验结果显示,与对照组相比,高糖条件促进ROS和NO生成(<0.001);与高糖组相比,汉黄芩苷处理抑制高糖条件下ROS和NO的生成,且该抑制作用呈浓度依赖性(<0.001,图3A、B)。GSH-ST检测结果显示,与对照组相比,高糖诱导抑制抗氧化酶GSHST产生(<0.001),与高糖组相比,汉黄芩苷呈剂量依赖性促进高糖环境下GSH-ST 的生成(<0.001,图3C)。qRT-PCR和ELISA结果显示,与对照组相比,高糖诱导促进炎症因子(IL-1β,IL-6)产生(<0.001);与高糖组相比,随着汉黄芩苷剂量的增大,IL-1β、IL-6表达水平逐渐降低(<0.001,图3D、E)。
2.4 汉黄芩苷上调SIRT1在高糖环境下hRMECs中的表达
Western blot 实验显示,与对照组相比,高糖组SIRT1表达降低(<0.001);与高糖组相比,10~30 μmol/L汉黄芩苷处理后SIRT1 表达呈浓度依赖性升高(<0.001),而与HG+Wog(30 μmol/L)组相比,HG+Wog(40 μmol/L)组的细胞中SIRT1的蛋白表达水平差异无统计学意义(>0.05,图4)。因此选用30 μmol/L汉黄芩苷进行后续研究。
这种雕刻不再是一棵树对自然的反映,而是通过雕塑的介入,用其代表着人的行为去塑造自然。简单地说,就是通过雕塑的运转,令它拥有改造自然的功能,这件雕塑与变化的自然重新组合成更大的动态雕塑。大自然也变成动态雕塑作品的组成部分,自然不再是作品周围的环境,而是作品的必要组成部分。

2.5 汉黄芩苷通过上调SIRT1减轻高糖诱导的细胞活力和迁移
为验证汉黄芩苷是否通过调控SIRT1表达而影响高糖条件下hRMECs,首先对SIRT1 进行敲低。Western blotting检测干扰序列的干扰效率,实验结果显示si-SIRT1-1和si-SIRT1-2均能降低SIRT1表达(<0.001,图5A)。由于si-SIRT1-2的干扰效率较高,故选择si-SIRT1-2进行下一步研究。CCK-8实验结果发现,与高糖组相比,30 μmol/L 汉黄芩苷抑制高糖环境下hRMECs的异常增殖(<0.05),而抑制SIRT1表达能够在一定程度上减轻汉黄芩苷的抑制作用,但无统计学意义(>0.05,图5B)。Transwell小室实验结果显示,与高糖组相比,30 μmol/L汉黄芩苷抑制高糖诱导hRMECs迁移(<0.05),而抑制SIRT1表达能够在一定程度上减轻汉黄芩苷的抑制作用(<0.001,图5C)。
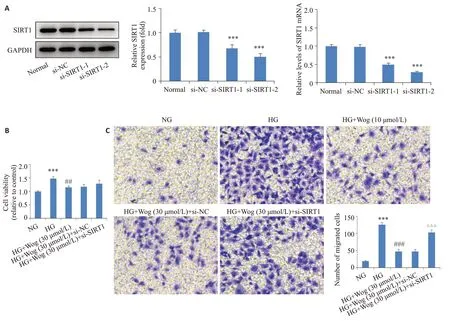
2.6 汉黄芩苷通过上调SIRT1抑制高糖诱导的hRMECs管形成和细胞膜通透性
小管形成实验结果显示,和高糖组相比,30 μmol/L汉黄芩苷抑制高糖诱导的hRMECs小管形成(<0.05),而抑制SIRT1表达可逆转汉黄芩苷对小管形成的抑制作用(<0.05,图6A)。Western blotting实验显示,和高糖组相比,30 μmol/L 汉黄芩苷抑制新血管相关蛋白(VEGF、HIF-1α)表达(<0.05),而抑制SIRT1表达可逆转汉黄芩甙对VEGF、HIF-1α蛋白表达的抑制作用(<0.05,图6B)。细胞膜通透性实验结果显示,和高糖组相比,30 μmol/L汉黄芩苷可抑制高糖诱导的hRMECs细胞膜通透性(<0.05),而抑制SIRT1表达可逆转汉黄芩苷对hRMECs细胞膜通透性的抑制作用(<0.05,图6C)。

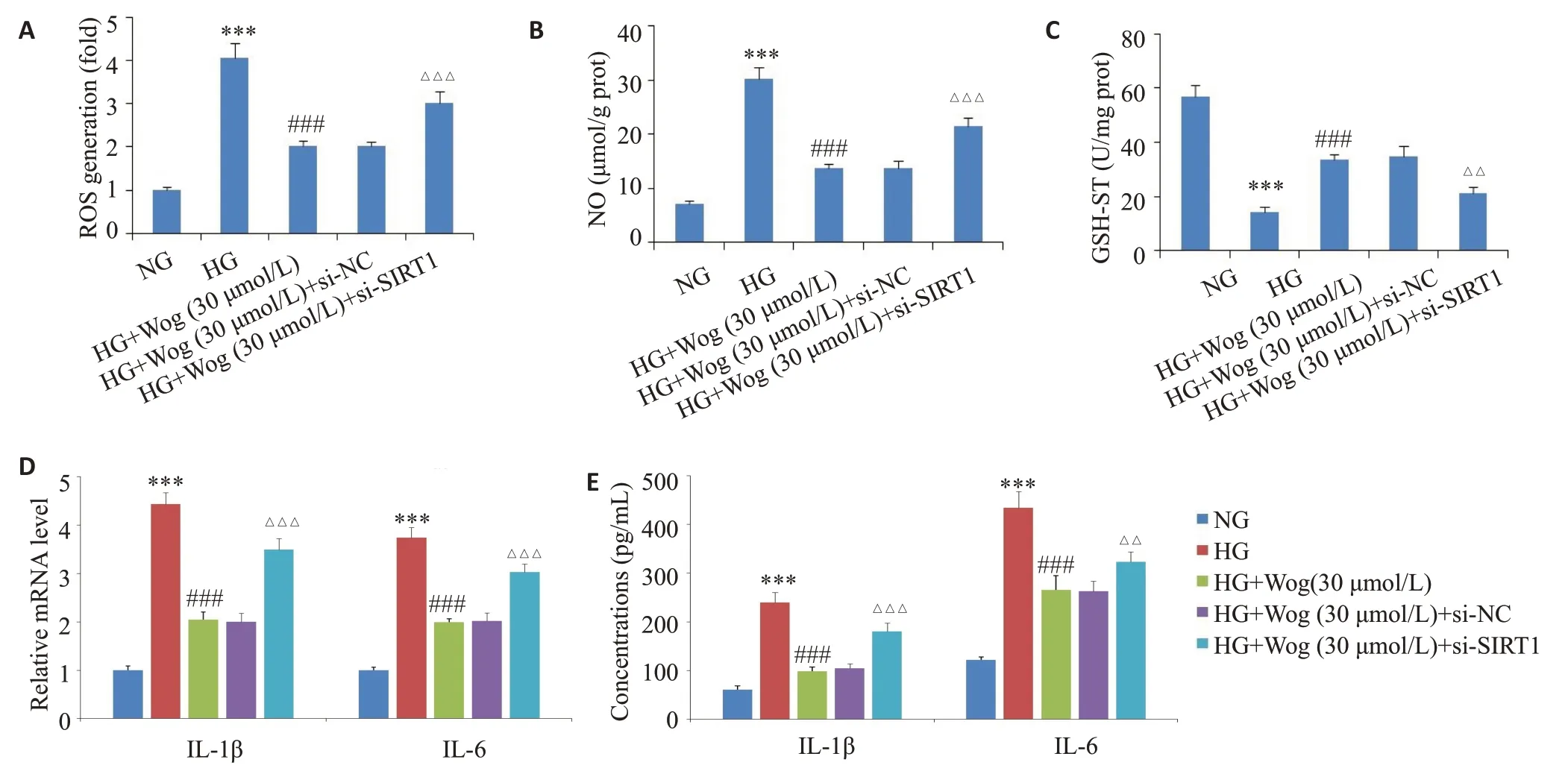
2.7 汉黄芩苷通过上调SIRT1 减轻高糖诱导的hRMECs的氧化应激和炎症反应
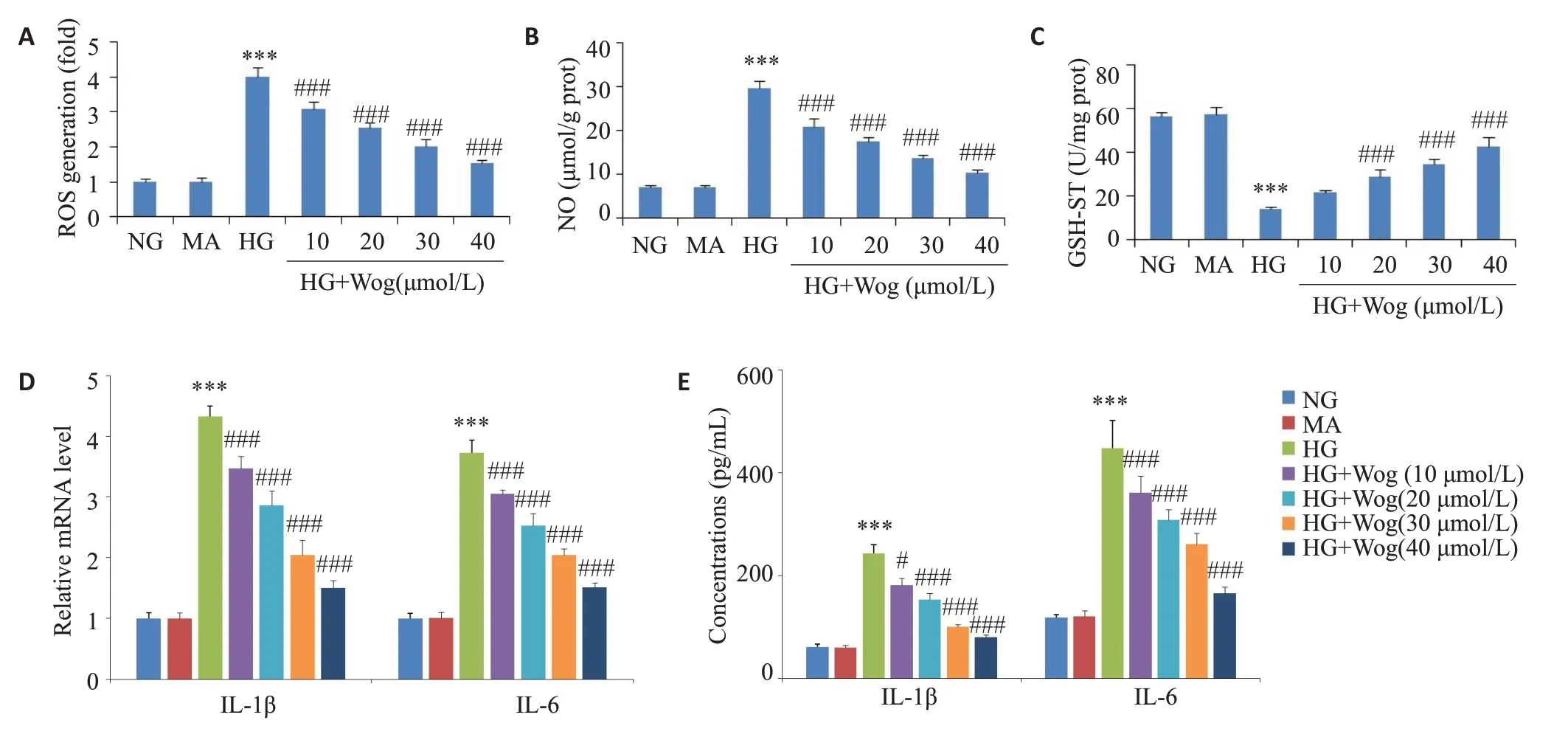
ROS和NO实验结果显示,与高糖组相比,30 μmol/L汉黄芩苷抑制高糖诱导的ROS和NO生成(<0.001),而抑制SIRT1表达可逆转汉黄芩苷对高糖环境下ROS和NO生成的抑制作用(<0.001,图7A、B)。GSH-ST检测结果显示,与高糖组相比,30 μmol/L汉黄芩苷可促进高糖诱导的GSH-ST生成(<0.001),而抑制SIRT1表达逆转其生成(<0.01,图7C)。qRT-PCR和ELISA结果显示,与高糖组相比,30 μmol/L汉黄芩苷可抑制高糖条件下IL-1β、IL-6的生成(<0.001),而抑制SIRT1表达逆转上述作用(<0.001,图7D、E)。
北京大学教务长、哲学系主任的徐炳昶甚至提出了全国教育农业化的主张。1933年初,他以“旭生”为名在《独立评论》中连续发表《教育罪言》系列文章,指出当前教育制度不适合国情需要,应当提倡农村教育代替都市教育,“中国是以农立国的,我们相信不惟今日如是,即将来亦仍如是”,“由无限农村组成的中国,应该创造出来一种农村的教育;至于从前所用的都市教育应行废弃”,改革中国教育方法“一定是与生产联合,尤其要与农业相联合”[10]。
对图2所示区域进行多次不同目标、不同负荷情况下的电动汽车最优出行路径规划结果进行对比。由于区域比较小,取电动汽车总容量为较小的16kWh,
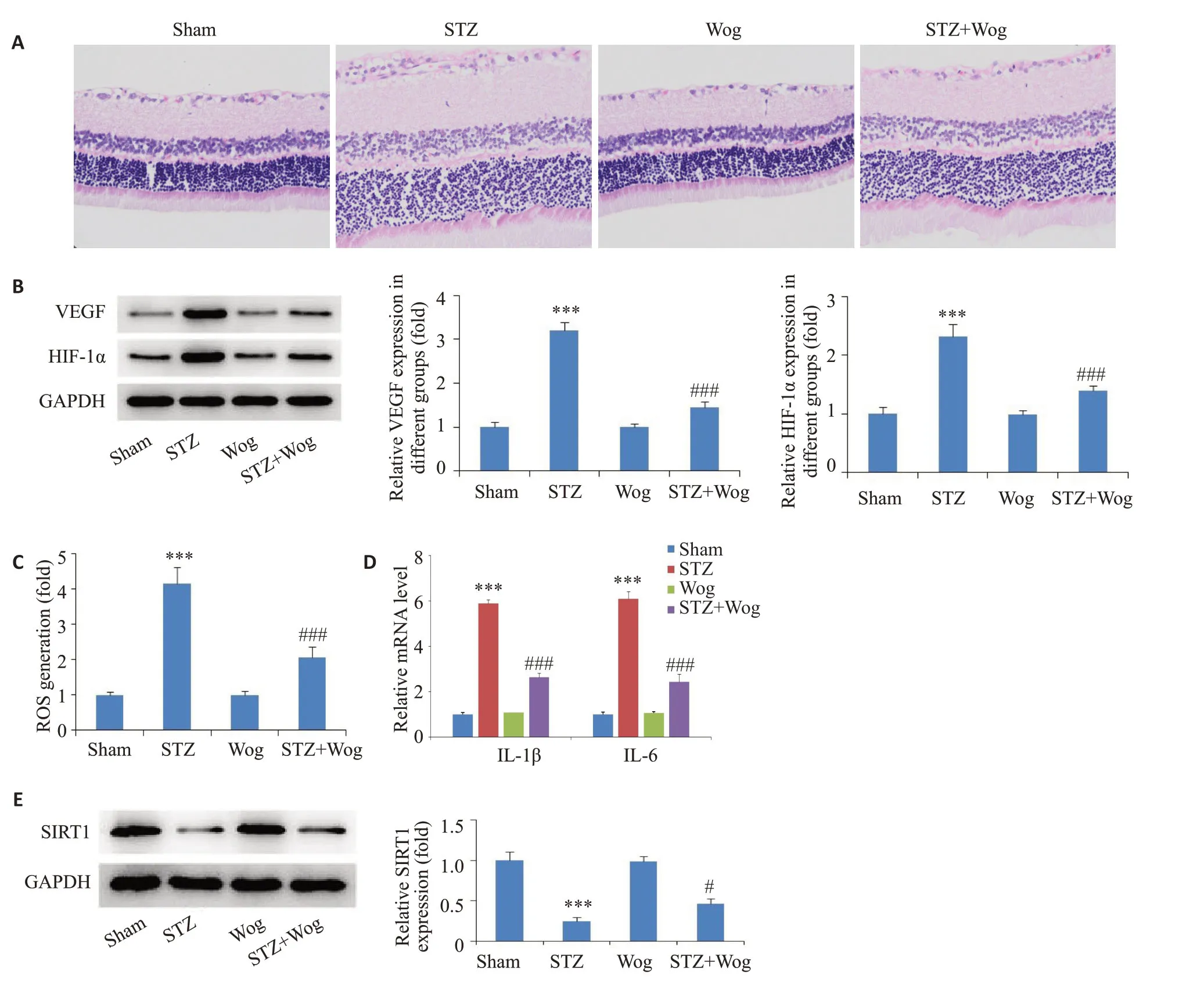
2.8 汉黄芩苷降低DR大鼠视网膜损伤并上调SIRT1的表达
HE染色结果显示,Sham组和Wog组视网膜各层排列整齐,结构清晰完整,血管内膜由一层完整且连续的内皮细胞组成,没有增生。而与对照组(Sham组)相比,STZ组诱导了显著的视网膜组织损伤,表现为视网膜组织厚度明显增加(<0.05),在30 mg/kg汉黄芩苷治疗后有效缓解了糖尿病引起的大鼠视网膜增厚(<0.05,图8A)。Western blot结果显示,与对照组相比,STZ促进了视网膜组织中新血管相关蛋白(VEGF、HIF-1α)表达(<0.001),而汉黄芩苷的处理很大程度上降低了视网膜组织中VEGF和HIF-1α蛋白的表达(<0.001,图8B)。qRT-PCR结果显示,与对照组相比,汉黄芩苷可抑制STZ诱导的视网膜组织中炎症因子(IL-1β、IL-6)和ROS的生成(<0.001,图8C、D)。此外,Western blot的结果显示,与STZ诱导组相比,汉黄芩苷的处理上调了视网膜组织中SIRT1表达(<0.05,图8E)。
俄国著名心理学家巴甫洛夫说:“快乐是养生的唯一秘诀。”有一件真事:“文革”中一位音乐老师和一位中文老师被下放到农村劳改,干一样的活儿——铡草。艰苦的劳动和精神折磨使中文老师去世了,而音乐老师过得好好的。
3 讨论
糖尿病视网膜病变是糖尿病最常见的微血管并发症之一,同时也是造成成年人视力损伤和致盲的重要眼部疾病之一。研究显示持续高糖环境可导致hRMECs功能障碍,如细胞异常增殖、迁移、氧化应激和炎症反应等。因此,本研究一方面通过高糖诱导hRMECs异常增殖、迁移、小管形成、氧化应激和炎症反应,另一方面通过STZ诱导构建SD大鼠糖尿病视网膜的损伤模型,分别模拟糖尿病视网膜病变在体内外的病理状态。
汉黄芩苷的抗氧化应激以及抗炎作用在多种疾病中都得到了广泛的验证。汉黄芩苷可显著抑制多糖刺激所诱导的巨噬细胞炎症反应;通过调控MLCK/pMLC2信号通路保护肠道屏障功能障碍,缓解结肠炎;对非酒精性脂肪肝小鼠炎症反应和氧化应激也表现出积极的治疗作用。但目前其在糖尿病视网膜病变的作用尚未见报道。本研究通过CCK-8实验和Transwell实验发现汉黄芩苷能够抑制高糖诱导的hRMECs异常增殖和迁移。小管形成实验结果表明汉黄芩苷能够抑制高糖诱导的hRMECs小管形成。VEGF是血管生成的关键因子,HIF-1α能够促进VEGF表达,进而促进血管生成。本研究通过Western blotting 检测细胞VEGF、HIF-1α表达水平,发现汉黄芩苷能够降低VEGF、HIF-1α表达,说明汉黄芩苷可抑制异常的高糖诱导的hRMECs 的血管形成。此外,qRT-PCR 和ELISA 检测试剂盒发现汉黄芩苷抑制高糖诱导hRMECs炎症相关因子(IL-1β、IL-6)的产生,减轻高糖诱导hRMECs的炎症反应。同时可显著抑制高糖诱导hRMECs 氧化应激相关因子(ROS、NO)的产生,促进GSH-ST生成,减轻高糖诱导hRMECs的氧化应激。此外,体内实验的结果也显示汉黄芩苷可抑制STZ诱导的视网膜组织损伤、VEGF、HIF-1α、ROS以及炎症因子的表达水平。因此,上述研究结果表明汉黄芩苷能够缓解糖尿病视网膜病变引起的细胞和组织损伤。
SIRT1作为一种负责细胞调控的蛋白质去乙酰化的酶,通过组蛋白、非组蛋白和转录因子的脱乙酰作用抑制氧化应激、炎症反应和细胞凋亡以及各种其他代谢途径,被认为是治疗糖尿病视网膜病变的潜在靶点。本研究通过汉黄芩苷的干预治疗,发现汉黄芩苷上调了高糖诱导的hRMECs中SIRT1表达,这与他人研究在治疗蛛网膜下腔出血中发现汉黄芩苷可促进SIRT1的表达结果一致,从而得出汉黄芩苷可能通过上调SIRT1表达减轻高糖诱导hRMECs的异常增殖、迁移、血管形成、细胞膜通透性、氧化应激及炎症反应。本研究在视网膜微血管内皮细胞中转染SIRT1 的干扰质粒下调SRIT1的表达,检测汉黄芩苷对高糖诱导hRMECs的治疗作用,结果发现干扰SIRT1表达能够逆转汉黄芩苷对高糖诱导hRMECs的异常增殖、迁移、小管形成、细胞膜通透性、氧化应激及炎症反应抑制作用。此外,在动物实验中,汉黄芩苷的处理显著提高了STZ诱导的DR大鼠视网膜组织中srit1的表达水平。该结果进一步证实汉黄芩苷通过上调SIRT1减轻糖尿病视网膜病变所致的视网膜微血管内皮细胞功能障碍和组织损伤。
综上所述,本研究首次证明了汉黄芩苷通过上调SIRT1在糖尿病视网膜病变中发挥作用,该研究为开发糖尿病视网膜病变的临床治疗药物提供了新的发现,同时也为SIRT1可作为糖尿病视网膜病变治疗的靶点提供了实验依据。
- 南方医科大学学报的其它文章
- Differential diagnosis of benign and malignant breast lesions using quantitative synthetic magnetic resonance imaging
- 泛癌分析长链非编码RNA MIR22HG的表达特征
- RUNX3调控胃癌细胞对曲妥珠单抗耐药的机制:基于超效高液相色谱-四极杆/静电场轨道阱质谱的代谢组学分析
- 甲基转移酶样蛋白27是结肠癌预后的生物标志物并与免疫浸润相关
- 二氢杨梅素的体外护肝作用:基于脂噬介导的LO2 细胞脂质蓄积及HepG2细胞增殖
- 负载骨髓干细胞来源外泌体的3D 水凝胶通过调节免疫促进损伤软骨的修复

