血脂康对SD大鼠心脏缺血/再灌注心肌细胞凋亡的影响*
左汉恒, 李银平△, 黄剑锋, 朱文雅, 肖善花, 黄绍烈
(1.济宁医学院附属医院心内监护室,山东 济宁 272013; 2.南昌大学第一附属医院a.超声科;b.肾内科; c.心内科,南昌 330006)
心肌缺血/再灌注损伤引起心肌细胞死亡包括坏死和凋亡两种方式。在缺血/再灌注损伤的早期以细胞凋亡为主,后期以坏死为主,梗死灶的周边以细胞凋亡为主,中央部分以坏死为主[1]。在心肌缺血/再灌注早期应用天冬氨酸特异性半胱氨酸蛋白酶(cysteinyl aspartate-specific protease, Caspase)抑制剂能减少细胞凋亡[2]。在缺血-再灌注16 h内危险区的心肌5%~30%发生细胞凋亡,梗死区及其周围心肌均会发生凋亡,应用Caspase抑制剂能减少21%~52%的梗死面积[3]。甘草酸预处理能抑制大鼠心肌缺血再灌注心肌B淋巴细胞瘤-2基因(Bcl-2)和Bcl2-Associated X的蛋白质(Bax)表达,进而减少心肌细胞凋亡[4]。
脂肪酸合成酶(Fas)又名CD95或APO-1,是细胞凋亡信号受体,通过与Fas配体(FasL)结合诱导细胞凋亡[5]。Fas/FasL凋亡通路在心脏缺血/再灌注心肌细胞凋亡中起到重要作用, 抑制其表达能减少心肌细胞凋亡[5]。血脂康主要成分为洛伐他汀[6]。本课题组前期研究[7]发现,血脂康减少大鼠急性缺血-再灌注心肌Fas/FasL mRNA的表达。LIU等[8]研究发现,大鼠模型心肌缺血再灌注过程中Fas/FasL诱导心肌细胞凋亡。ZHANG等[9]研究发现,辛伐他汀能抑制血管内皮细胞的凋亡。然而,有研究[10]发现,他汀类药物通过抑制Ras信号通路,增强人造血肿瘤细胞中Bim和p27的表达来诱导细胞凋亡。因此,本实验探讨血脂康能否抑制SD大鼠心肌缺血/再灌注心肌细胞Fas/FasL表达,从而最终抑制心肌细胞凋亡。
1 材料与方法
1.1 实验药品与试剂 血脂康原粉北大维信生物科技有限公司惠赠,DeadEndTMColorimetric TUNEL System Kit 购自美国Promega公司,抗体购自美国Abcam公司。
1.2 方法
1.2.1 动物与分组 健康SD成年大鼠,体质量200~250 g,在南昌大学医学院动科部饲养,实验动物生产许可证号[SCXK(京)2016-0009 ],实验动物质量合格证号(No.110364200100066481),实验经南昌大学第一附属医院伦理委员会批准(NO:20071876)。
SD大鼠适应性饲养1周,随机分为5组,各8只。假手术组:双蒸水2 mL·d-1灌胃1周;模型对照组:双蒸水2 mL·d-1灌胃1周;甲羟戊酸组:甲羟戊酸150 mg·kg-1·d-1溶于双蒸水2 mL灌胃1周;血脂康组:血脂康2.8 g·kg-1·d-1,用双蒸水2 mL配成悬液灌胃1周;血脂康+甲羟维酸组:血脂康2.8 g·kg-1·d-1联合甲羟戊酸150 mg·kg-1·d-1溶于双蒸水2 mL配成悬液灌胃1周。
1.2.2 缺血-再灌注模型复制 根据本课题组前期发表文献方法复制在体心脏缺血-再灌注模型[5],简要步骤如下。
腹腔注射质量分数3%戊巴比妥钠(40 mg·kg-1)麻醉。气管切开插管,连接小动物呼吸机(频率60次·min-1,呼/吸=1∶1.5,压力0.04 MPa)。沿胸骨旁左侧0.5 cm剪开皮肤、皮下组织,于左侧第四肋间钝性分离,剪断第4肋,打开胸腔,在距左心耳根部下方2 mm处带4-0手术丝线无创手术圆针进针,肺动脉圆锥旁出针,进针深度1.0~1.5 mm,宽2~3 mm,结扎左冠状动脉前降支 (假手术组只穿线不结扎),结扎前放2根4号双股手术丝线。结扎30 min后解开活结,拉动2根4号丝线,使左前降支血流再通120 min。描记肢体Ⅱ导联心电图。造模成功标准:心电图R波增宽、增高;结扎远端的左心室变苍白、室壁运动减弱[11]。
1.2.3 原位末端转移酶标记技术(TUNEL)检测心肌细胞凋亡 再灌注120 min后在同一部位垂直心室长轴取左心室组织,质量分数10%中性甲醛溶液固定,制作常规石蜡切片,末端脱氧核苷酸转移酶介导的TUNEL检测心肌细胞凋亡。实验严格按照DeadEndTMColorimetric TUNEL System 试剂盒说明书步骤操作,具体步骤如下。
左心室心肌组织经自动脱水机脱水、二甲苯透明、组织浸蜡和石蜡包埋后,制作4 μm的石蜡切片。石蜡切片65 ℃恒温箱内烤片60 min;二甲苯脱蜡两次,每次5 min;室温下依次体积分数100%乙醇、体积分数85%乙醇、体积分数70%乙醇和体积分数50%乙醇各3 min组织切片水合;在室温下用质量分数0.85% NaCl浸洗5 min,再用PBS液在室温下浸洗5 min;室温下质量分数4%多聚甲醛溶液(溶于PBS液中)溶液固定15 min;室温下切片在PBS液中浸泡5 min,重复一次,每片切片加100 μL蛋白酶K(20 μg·mL-1)室温孵育20 min;室温下在PBS液中浸洗5 min,再用质量分数4%多聚甲醛重复固定5 min;室温下PBS浸洗5 min,重复一次;阳性对照切片加用100 μL/切片DnaseⅠ缓冲液5 min,去除缓冲液,再每片加100 μL溶于DNaseⅠ缓冲液的DNaseⅠ(5 U·mL-1),室温下孵育10 min,去离子水洗3次,再用PBS液浸洗5 min,随后步骤相同,但应分开处理。除去切片上过多的水,每片加100 μL平衡液,室温下平衡10 min;加100 μL rTdT反应混合液到每片组织切片上,用塑料盖玻片覆盖,37 ℃孵育60 min,阴性对照不含有rTdT,用去离子水代替;室温下浸入2×SSC中15 min以终止反应;PBS浸洗5 min,再重复2次;室温下浸在质量分数0.3%的过氧化氢溶液中5 min,阻断内源性过氧化酶;室温下PBS浸洗5 min,3次;每个切片加100 μL 1∶500的streptavidin HRP(用PBS稀释),室温孵育30 min;在PBS液中浸洗5 min,3次;每个玻片加100 μL DAB液,避光显影10 min,在光学显微镜下观察背景呈浅黄色时用去离子水冲洗终止反应;苏木精衬染;晾干玻片,常规树胶封片。在光学显微镜下观察:TUNEL阳性的凋亡细胞的细胞核呈棕黄色,正常心肌细胞的细胞核呈蓝色[12]。应用HMIAS-2000高清晰度彩色医学图文分析系统采集图像并计数TUNEL阳性凋亡心肌细胞和总心肌细胞数。采用双盲的方法,每只大鼠观察4张切片,每张切片计数4个高倍视野(×200)下的TUNEL阳性凋亡心肌细胞和总心肌细胞数。计算心肌细胞凋亡指数,心肌细胞凋亡指数=TUNEL阳性心肌细胞/总心肌细胞×100%。
1.2.4 实时荧光定量PCR 运用Trizol法提取大鼠心肌组织的总RNA,用Nano Drop超微量分光光度计检测RNA浓度后进行定量。
将RNA(x μL)加DEPC水(8-x μL)混合后,加入5×PrimeScript RT Master Mix(2 μL)制成10 μL逆转录体系,行逆转录PCR反应:25 ℃,5 min; 42 ℃,30 min;85 ℃,5 min;最后12 ℃。运用SYBR GREEN法行实时荧光定量PCR反应:95 ℃,3 min;95 ℃,15 s;60 ℃,30 s;72 ℃,30 s,40个循环。实验结果采用2-ΔΔCt方法进行计算,以18 s作为内参。
1.2.5 蛋白免疫印迹 运用RIPA裂解液添加质量分数1% PMSF裂解大鼠心肌组织,运用BCA Protein Assay Kit测定总蛋白浓度。
将蛋白上清液和5×Loading buffer(4∶1)混匀后,用100 ℃水浴5 min,待温度冷却后放置-20 ℃储存。配制所需浓度的SDS凝胶,将等量总蛋白上样,经凝胶电泳后转移至PVDF膜。用质量分数5%脱脂奶粉封闭2 h。用质量分数5%脱脂奶粉按1∶1 000比例配置相关一抗,于4 ℃摇床孵育一抗过夜。次日,用TBST清洗(每次10 min,洗3次),用质量分数5%脱脂奶粉按1∶10 000比例配置相应二抗,室温孵育2 h。用TBST清洗,最后使用ECL发光试剂盒在显色仪中曝光显影,蛋白条带使用Image J软件进行灰度值测量,用β-actin作为内参。
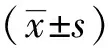
2 结果
2.1 心肌细胞凋亡 TUNEL阳性凋亡心肌细胞的细胞核呈棕褐色,非凋亡心肌细胞的细胞核呈蓝色。
假手术组大鼠心肌细胞偶有凋亡,TUNEL阳性心肌细胞(3.84±1.64)%。缺血-再灌注损伤引起心肌细胞凋亡增加,模型对照组TUNEL阳性心肌(30.27±6.52)%,同假手术组比较差异有统计学意义(P<0.001)。血脂康预处理能减少缺血-再灌注损伤引起的心肌细胞凋亡[血脂康组(17.84±4.55)%vs模型对照组,P<0.001],但仍比假手术组心肌细胞凋亡增多(血脂康组vs假手术组,P<0.001)。甲羟戊酸减弱血脂康对缺血-再灌注心肌细胞凋亡的抑制[血脂康+甲羟戊酸组(28.32±6.17)%vs血脂康组,P<0.001;血脂康+甲羟戊酸组vs模型对照组,P=0.481],而单独甲羟戊酸预处理对缺血-再灌注损伤心肌细胞凋亡无影响[甲羟戊酸组(31.93±6.82)%vs模型对照组,P=0.549]。见图1。
2.2 心肌组织实时荧光定量Fas、FasL mRNA表达
模型对照组凋亡基因mRNA表达水平同假手术组比较差异有统计学意义(P<0.05);血脂康组与模型对照组相比能减少凋亡基因mRNA表达水平(P<0.01);血脂康+甲羟戊酸组可以逆转血脂康组的保护效应(P<0.05)。见表1。
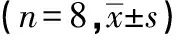
表1 各组心肌组织实时荧光定量Fas、FasL mRNA表达比较
2.3 蛋白免疫印迹法检测心肌组织Fas、FasL 蛋白表达 模型对照组凋亡蛋白表达水平同假手术组比较,差异有统计学意义(P<0.05);血脂康组与模型对照组相比可减少凋亡蛋白表达水平(P<0.01);血脂康+甲羟戊酸组可以逆转血脂康组的保护效应(P<0.05)。见表2、图2。
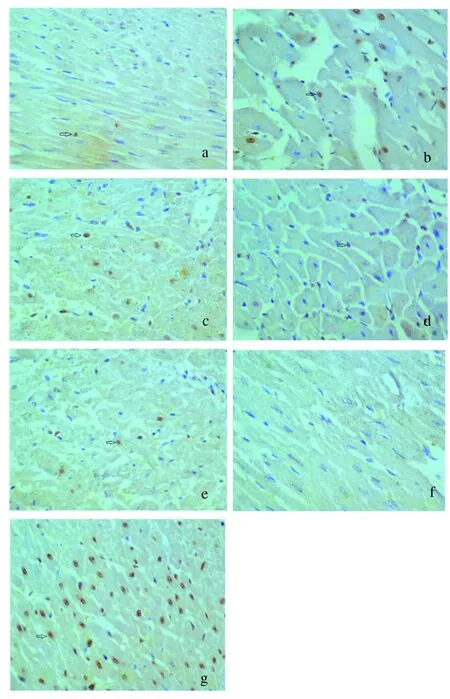
注:a:假手术组;b:血脂康+甲羟戊酸组;c:甲羟戊酸组;d:模型对照组;e:血脂康组;f:阴性对照;g:阳性对照。TUNEL-阳性心肌细胞即凋亡细胞呈棕褐色(见箭头所示),正常非凋亡心肌细胞细胞核呈蓝色。
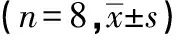
表2 缺血-再灌注损伤心肌Fas/FasL蛋白表达比较

注:a:假手术组;b:模型对照组;c:血脂康组;d:血脂康+甲羟戊酸组;e:甲羟戊酸组。
3 讨论
血脂康为粳米接种特殊红曲菌,采用现代生物制药工艺发酵、精制而成,主要成分为无晶型结构的洛伐他汀等13种同系物,含有8%的不饱和脂肪酸、甾醇和少量黄酮类物质等[6],与化学合成的洛伐他汀相比,血脂康所含洛伐他汀结晶度较低,体内溶出度高[13]。本研究结果发现,缺血/再灌注引起SD大鼠心肌细胞凋亡增加,血脂康预处理能明显抑制SD大鼠缺血/再灌注引起的心肌细胞凋亡。应用甲羟戊酸拮抗血脂康中的洛伐他汀发现血脂康抑制SD大鼠缺血/再灌注心肌细胞凋亡作用减弱,提示血脂康中的主要成分洛伐他汀起抑制心肌细胞凋亡作用,与张晓捷等[14]研究发现一致。张晓捷等[14]研究发现,洛伐他汀预处理后,大鼠心肌缺血/再灌注时心肌细胞凋亡减少,心功能明显改善。ZHANG等[9]研究发现,辛伐他汀可抑制氧化型低密度脂蛋白诱导的内质网应激和血管内皮细胞凋亡。然而,他汀类药物在影响肿瘤细胞凋亡中得到相反的结果。FUJIWARA等[10]研究发现,他汀类药物通过降低线粒体跨膜电位、增加 Caspase-9和Caspase-3的活化、增强Bim表达以及通过抑制Ras/细胞外信号调节激酶和 Ras/哺乳动物靶标诱导细胞周期停滞在G1期来诱导细胞凋亡。
本课题组前期研究发现,缺血/再灌注使大鼠心肌Fas/FasL mRNA表达增加, 血脂康预处理后能抑制缺血/再灌注心肌Fas/FasL mRNA的表达[7]。本实验再次验证,血脂康抑制缺血/再灌注大鼠心肌Fas和FasL mRNA的表达,同时可抑制Fas和FasL蛋白的生成。Fas/FasL通路在缺血/灌注心肌细胞凋亡中起到重要作用,缺血/再灌注时心肌Fas/FasL表达增加,抑制Fas/FasL表达可减少心肌细胞凋亡。LEE等[5]研究发现,淋巴组织增生病小鼠(Fas无功能)同野生型小鼠相比,缺血/再灌注时心肌细胞凋亡减少63.8%,梗死面积减少62.3%。LIU等[8]研究发现,在缺血和再灌注时间延长后的心肌缺血/再灌注中,心肌细胞凋亡增强,细胞凋亡和Fas/FasL参与心脏缺血/再灌注的发病,阻断细胞凋亡或Fas/FasL表达是预防和治疗心脏缺血/再灌注损伤的一种方法。
总之,血脂康抑制缺血/再灌注大鼠心肌细胞Fas/FasL凋亡通路,进而抑制缺血/再灌注心肌细胞凋亡,其抑制心肌细胞凋亡的主要成分为洛伐他汀。

