儿童噬血细胞综合征临床特征及预后相关因素分析*
魏 琛, 程志伟, 牛 铭, 陶琳琳, 郝长付
(1.郑州大学第三附属医院a.儿内科;b.病案管理科,郑州 450052;2.郑州大学公共卫生学院儿童少年卫生学教研室, 郑州 450001)
噬血细胞综合征(hemophagocytic syndrome,HPS)又称为噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis,HLH)[1-4]。作为全身性异常炎症反应综合征,其特征在于淋巴细胞(LYM)、单核细胞(MON)和巨噬细胞不受控制的活化以及炎症细胞因子的过度生长。该病症表现为持续发热,肝脾肿大,全血细胞减少,骨髓、肝脏、脾脏和淋巴结中噬血细胞增多。作为临床综合征,其临床表现呈非特异性,病程进展快,预后差,短期病死率较高。本研究对42例不同病因的儿童HPS临床资料进行回顾性分析,分析与预后相关的临床特征和实验室结果,以期为早期判断该病的预后提供相应依据。
1 资料与方法
1.1 资料 选取2010年1月—2020年12月郑州大学第三附属医院儿科确诊的HPS患儿42例作为研究对象,进行回顾性分析。纳入标准:符合国际组织细胞协会修订的HPS-2004诊断标准[5]和我国2018年《噬血细胞综合征诊治中国专家共识》[6]。排除标准:失访者;年龄>18岁者。
1.2 方法
1.2.1 观察指标 收集患儿年龄、性别、发病最初的症状和体征(发热总时长、最高体温、皮肤情况)、入院后第一次辅助检查结果以及病程28 d内的转归(生存/死亡)。辅助检查数据收集项目包括:血常规、C反应蛋白(CRP)、降钙素原(PCT)、肝功能、肾功能、甘油三酯(TG)、电解质、铁蛋白、血凝分析、动脉血气分析、腹部肝胆彩超及骨髓象结果。骨髓细胞学检查方法为取患儿髂前上棘骨髓0.1 mL推片,待干燥后予瑞氏染色,观察骨髓中有无组织细胞吞噬正常血细胞现象。
1.2.2 治疗与随访 治疗按照HPS-2004方案[5]进行规范治疗。根据病案资料和电话随访记录患儿生存情况。根据确诊后28 d生存情况分为存活组和病死组。时间变量起点是患儿确诊日期,终点时间为末次随访时间或者发生死亡时间。

2 结果
2.1 研究对象的临床一般特征 42例儿童HPS患者中男性占45.24%(19例),女性占54.76%(23例),发病性别比例为男:女=1∶1.21(19例∶23例)。在确诊28 d内死亡共18例,病死率为42.86%,存活率为57.14%;男女死亡比例为男:女=1∶1.25(8例∶10例)。起病年龄中位数和上下四分位数分别为1.00(0.75,2.25)岁。2组患者性别和起病年龄比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组儿童HPS患者28 d不同预后的性别、起病年龄比较
2.2 42例HPS病因分布情况 42例患者中血培养均未培养出细菌感染,疱疹病毒(EBV)感染22例(52.38%)。19例考虑原发性噬血,其中7例合并EBV感染。病毒感染16例,其中15例为EBV感染。进行穿孔素基因检查8例,均未发现穿孔素基因变异。见表2。

表2 42例HPS病因分布

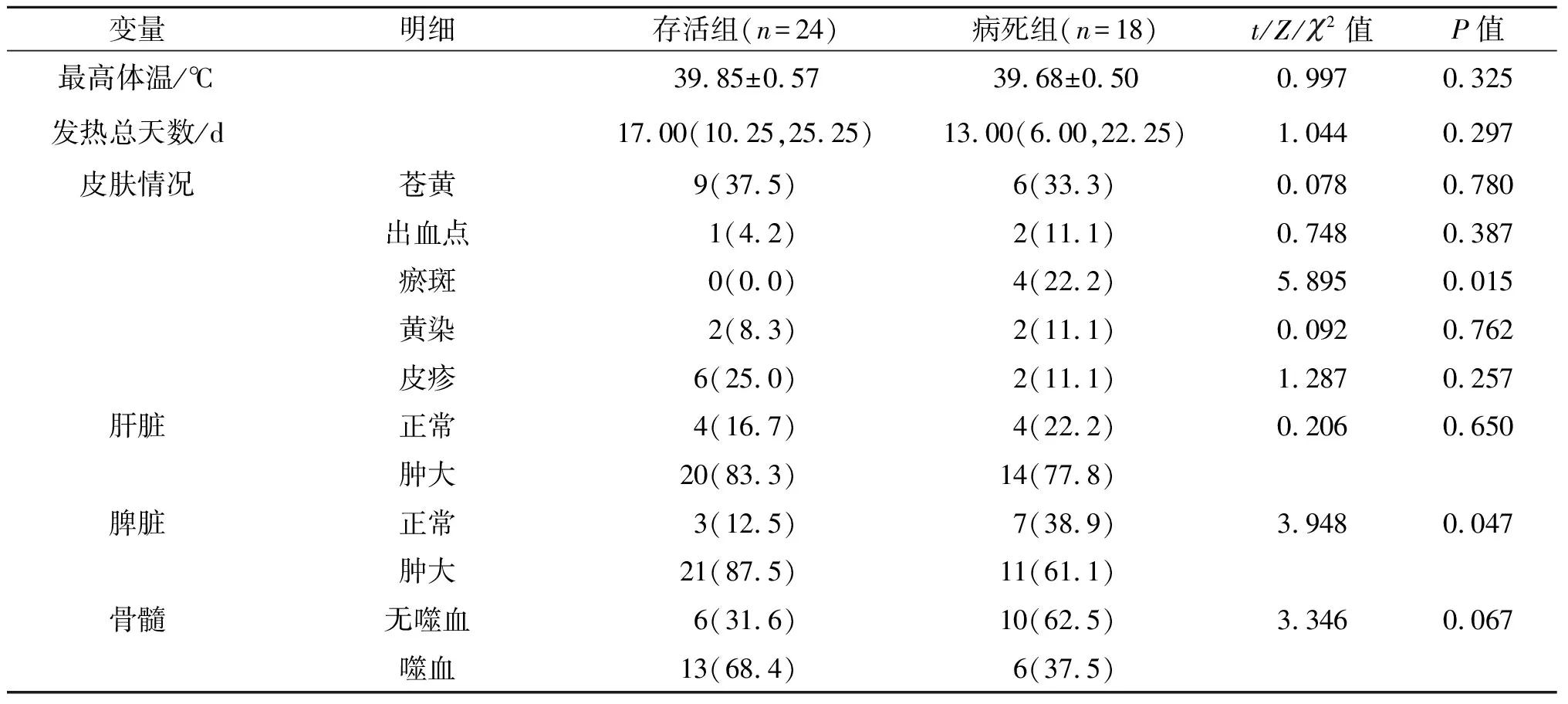
表3 2组儿童HPS患者28 d不同预后的临床症状、体征比较

表4 2组儿童HPS患者28 d不同预后的化验室结果比较

表4(续)
2.4 死亡危险因素分析 将单因素分析中差异有统计学意义的变量纳入多因素logistic回归分析。结果显示,RBC降低和LDH升高是儿童HPS患者28 d死亡的危险因素,优势比(OR)分别为0.277,1.001,P<0.05。其中RBC是保护因素,即RBC每增加一个单位,死亡风险是原来的0.277倍。LDH是危险因素,即LDH 每提高一个单位,死亡风险是原来的1.001倍。见表5-6。

表5 变量赋值表
2.5 ROC曲线分析 LYM、RBC、PLT、LDH、PT对儿童HPS患者28 d预后均有预测价值,以LYM的曲线下面积(AUC)最大,为0.802。当RBC最佳截断值为3.595×1012L-1时,敏感度为83.3%,特异度为54.2%;当LDH最佳截断值为978.5 U·L-1时,敏感度为61.1%,特异度为75.0%;当PLT最佳截断值为33×109L-1时,敏感度为44.4%,特异度为95.8%。当PT最佳截断值为17.7 s时,敏感度为50.0%,特异度为95.8%。见图1、见表7。

表7 儿童HPS患者28 d死亡的ROC曲线分析

图1 实验室指标预测儿童HLH患者28 d死亡的ROC曲线
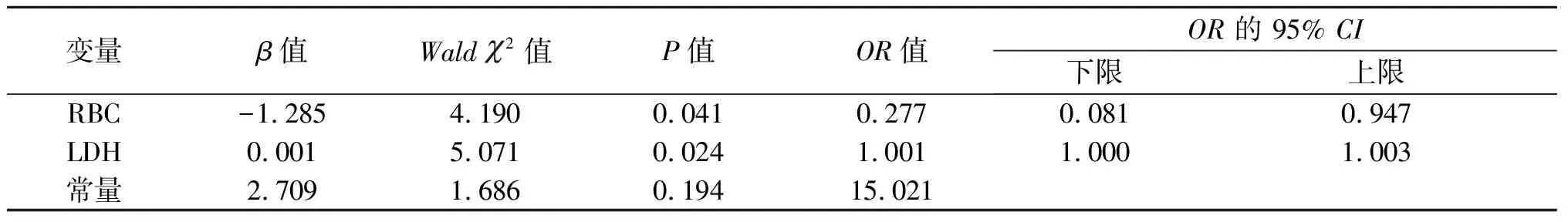
表6 儿童HPS患者28 d死亡危险因素的logistic回归分析
3 讨论
HPS的首发可能发生在患者生命中的任何时候[7]。本研究对象的42例发病年龄的中位数为1岁,最小仅2 d,最大为11岁。与HENTER等[8]的报道相近,存活率为57.14%。HENTER等[8]通过平均3.1 a的随访时间,报告儿童HPS生存率为 55%。本研究发现,该病确诊后28 d与3 a的整体生存率相近,提示儿童HPS在急性期积极治疗并且度过确诊后前4周的高危阶段,其长期生存率不会下降。本研究中存活组和病死组的性别比例(男∶女)分别为1∶1.21和1∶1.25,显示该病患者女性多于男性,患儿的起病年龄、性别和预后情况无关。
本研究结果表明,诱发HPS最常见的感染性因素为EBV。根据病因,HPS可分为原发性和继发性。原发性HPS,又称为家族性HPS,是以基因型突变作为基础。基因检测对于临床确诊,预测患者未来复发的风险以及确定无症状家庭成员的HPS易感性最为有用。原发性HPS占发病人群的80%[9-10],通常在婴儿期或幼儿期发病。本研究结果发现,原发性病因19例(45.24%),考虑可能与单中心病例数相对较少、研究年限跨度大、基因检测不够完善有关。本课题8例检查穿孔素基因,结果均未发现异常。本研究42例HPS患儿22例(52.38%)存在EBV感染,提示EBV是最常见的HPS感染触发因素。这与其他研究者报道相似[9,11]。家族性HPS分为非EBV诱发的家族性HPS、EBV诱发的HPS和免疫缺陷综合征相关的HPS。后两种形式的家族性HPS均与EBV感染有关[12]。EBV-HPS尤其容易在幼儿和青少年中出现复发,提示即便目前考虑为EBV感染引起的HPS,也依然需要筛查,排除家族遗传性可能。
尽管对HPS遗传学和免疫学基础的认识不断增强,其目前仍是一种全身性免疫激活性临床综合征,可以由各种遗传因素和后天因素触发,其诊断主要依靠由临床医师建立的临床和实验室标准进行确诊。确诊目前借助组织细胞学会推荐的HPS-94方案和HPS-2004方案,通常认为凡是满足以下8个标准中的5个[13],可确诊HPS,包括发热,脾肿大,至少2个系统的血细胞减少,高TG血症和(或)血FIB减少,在骨髓、脾脏、淋巴结、肝脏中发现有吞噬作用的组织细胞,自然杀伤细胞(NK细胞)活性低或无,铁蛋白升高,可溶性白细胞介素-2受体升高。但是这些标准有以下缺点[14]:①许多HPS患者在疾病早期可能未达到5/8标准,并且一些患者表现出不完全或者非典型疾病表现。②一些患有严重感染、风湿病、血液系统恶性疾病或原发性免疫缺陷的患者可能符合标准,并被误诊为仅患有HPS,直到潜在的疾病过程变得更加明显为止。在8个诊断指标中,发热作为最主要的临床特征之一,发生概率基本为100%[15]。本研究中所有的HPS患儿均存在发热症状,持续时间平均14 d(存活组中位数17 d,病死组中位数13 d)。提示当儿童发热超过2周,进行疾病鉴别诊断时应该考虑为HPS可能。诊断HPS是成功治疗的第一步,但早期诊断仍然充满挑战。因为早期诊断大多依靠临床和实验室的综合分析。本研究结果发现,病死组皮肤瘀斑出现率高于存活组,早期瘀斑的出现提示凝血功能严重障碍。
HPS常为多器官功能受累,进行性加重,由于临床表现非特异性,故诊断往往延迟。初诊时实验室往往发现血常规、肝肾功能、电解质、血凝分析、铁蛋白均出现异常。通过ROC曲线分析,本研究发现LYM、RBC、PLT、LDH、PT均可能与儿童HPS患者28 d预后有关。当PLT<33×109L-1、PT>17.7 s时,患儿发病4周内预后不良,敏感度分别为44.4%、50.0%,特异度为95.8%、95.8%。结合临床资料的结果,提示凝血功能障碍早发生是重症患者的早期征象。目前国外某些学者试图通过临床和实验室的指标进行HScore评分[16-17],以期能早发现、早确诊HPS。除了凝血功能障碍,骨髓生成障碍和肝功能障碍也需引起重视。经logistic回归和ROC曲线分析显示,RBC降低和LDH升高是儿童HPS患者28 d死亡的危险因素。RBC快速下降意味着机体各脏器处于缺氧状态。LDH在肿瘤性疾病或细胞出现坏死时,可显著升高[18]。
综上所述,儿童HPS可发生于儿童各个年龄段,病程前4周为病死高发阶段,女性发病更多见。病因以原发性为主,继发性多见于EBV感染。发热超过2周,临床诊断时应考虑HPS,病程中出现皮肤瘀斑可能提示预后不良。对于儿童HPS发病初期,RBC计数<3.595×1012L-1或LDH>978.5 U·L-1提示患儿28 d内预后不良。

