刺芒柄花素对顺铂所致大鼠急性肾损伤的保护作用及其机制
郝炎,李治成,陈越,刘文佳,钟卿
(自贡市第一人民医院肾脏内科,四川 自贡 643000)
急性肾损伤(acute kidney injury,AKI)是一组表现为短期内肾小球滤过率急剧下降,并伴有水电解质及酸碱平衡紊乱和循环系统、消化系统等全身症状的临床综合征[1]。引发急性肾损伤的病因很多,药物使用是其中之一。顺铂是一种细胞周期非特异性药物,主要通过肾排泄,依赖肾小球的过滤或部分肾小管的分泌,肾毒性较大,易引发肾损伤。Wang等[2]研究报道使用顺铂治疗后,25%~30%的患者出现急性肾损伤,严重影响生存质量。大量研究[3-6]表明,顺铂致细胞损伤的主要机制包括DNA损伤、氧化应激、炎症反应、内质网应激和线粒体功能障碍及凋亡等,且促进和抑制线粒体的分裂及凋亡途径均可改变急性肾损伤程度。因此,研究抑制细胞线粒体的分裂及凋亡的分子机制对顺铂诱导的急性肾损伤的防治具有重要的临床意义。刺芒柄花素是一种广泛存在于红车轴草中的异黄酮类化合物,具有抗炎、抗癌功效,可降低血脂,改善肝脂肪化、减少炎性细胞浸润、抑制动脉壁内膜下泡沫细胞形成和中膜平滑肌增生[7]。杨飞飞[8]研究发现,通过缺血再灌注建立肾损伤小鼠模型,在缺血前后给予一定剂量刺芒柄花素,toll样受体4(toll-like receptors 4,TLR4)及高迁移率族蛋白B1(high mobility group protein B1,HMGB1)蛋白表达较模型组显著减少,表明刺芒柄花素预处理可减轻肾脏缺血再灌注损伤。但对于顺铂诱导的AKI,刺芒柄花素保护作用及相关机制尚未见报道。本研究拟明确药物刺芒柄花素对线粒体分裂的调节作用,为AKI的防治提供新的参考方法。
1 材料与方法
1.1 实验仪器及试剂
脱水机(型号:ASP300S,Leica)、切片机(型号:HistoCore BIOCUT,Leica)、离心机(型号:Multifuge X1/X1R Pro,赛默飞)、DNA扩增仪(型号:T100,BIORAD)实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪(型号:LightCycler 480,罗氏诊断)、激光共聚焦显微镜(型号:Echo REVOLUTION,ECHO)、紫外分光光度计(型号:U-3900/3900H,日立)、灰度分析软件(型号:alphaEaseFC,Alpha Innotech),全自动生化分析仪(型号:AU5800,贝克曼库尔特)。
刺芒柄花素购自上海雅吉生物科技有限公司、顺铂(Sigma-Aldrich)、2,2-联喹啉-4,4-二甲酸(bicinchoninic acid assay,BCA)蛋白定量试剂盒(武汉博士德生物工程限公司)、视神经萎缩症蛋白1(optic atrophy 1,OPA1)兔多克隆抗体(线粒体融合蛋白1(mitofusin 1,Mfn1)兔多克隆抗体、动力相关蛋白1(dynamin-related protein 1,Drp1)兔多克隆抗体、细胞色素C(cytochrome C,CytC)抗体、Caspase-9 抗体、β-actin 兔单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)均购自上海碧云天生物技术有限公司,p66 Shc抗体(优宁维)、活性氧检测试剂盒(碧云天)、Trizol细胞核糖核酸(ribonucleic acid,RNA)提取试剂盒、逆转录试剂盒Prime Script TM RT Master MiX及荧光定量试剂盒SYBR Premix Ex Taq TM(TaKaRa)均严格按照说明书进行操作。
1.2 实验动物
32只8周龄的SPF级雄性SD大鼠(体重180~220 g)由湖南斯莱克景达实验动物有限公司提供,分笼饲养于自贡市第一人民医院SPF级实验动物房,室温保持在(25±2) ℃,湿度保持在(55±5)%,动物自由进食,自由饮水,保持12 h/d的昼夜循环。实验动物使用获得自贡市第一人民医院实验动物管理委员会批准。
1.3 模型建立及标本留取
将32只8周龄SPF级雄性SD大鼠随机分为阴性组、顺铂组、刺芒柄花素+顺铂组和刺芒柄花素组,每组8只。喂养1周后,三组大鼠经常规消毒后一次性腹腔注射顺铂(20 mg/kg)建立AKI模型[9],顺铂组大鼠血尿素与血肌酐≥阴性组两倍则为AKI造模成功。阴性组、刺芒柄花素组采用同样方式注射同等剂量的0.9%生理盐水。24 h后刺芒柄花素+顺铂组和刺芒柄花素组大鼠行刺芒柄花素(15 mg/Kg)灌胃3 d,阴性组与顺铂组采取相同方式给予等量0.9%生理盐水生理盐水。
药物干预完成后,禁食禁饮6~8 h,予1%戊巴比妥腹腔麻醉,取各组大鼠腹主动脉血液,3 000 rpm离心10 min,收集血清,-80°冻存备用。无菌条件下处死大鼠,水平位切取2 mm左肾组织并固定在10%的磷酸盐缓冲福尔马林液中,用于苏木素-伊红染色(hematoxylin and eosin,HE)染色组织学检查;其余肾组织迅速冷冻在液氮中,保存备用。
1.4 实验方法
1.4.1 肾功能检测 各组大鼠的血清样本均采用全自动生化分析仪检测血清中血尿素及血肌酐的表达水平。
1.4.2 HE染色观察肾小管损伤 将固定在10%的磷酸盐缓冲福尔马林溶液的肾组织经脱水、包埋后切片后,进行HE染色,中性树脂封片,显微镜下观察组织形态学变化并进行半定量分析。组织病理学的改变由肾小管的损伤的百分比来评估,肾小管的损伤包括管状破坏、溶解和铸型等[9],组织损伤的评分标准:未见肾小管损伤为0分;受损伤肾小管占总体<25%为1分;受损伤肾小管占总体26%~50%为2分;受损伤肾小管占总体51%~75%为3分;受损伤肾小管占总体76%为4分。
1.4.3 RT-q PCR检测mRNA 分别取各组大鼠液氮保存肾脏组织30 mg,采用Trizol法提取组织中的总RNA,分光光度计测定RNA的浓度。视神经萎缩症蛋白1(optic atrophy 1,OPA1)、线粒体动力相关蛋白(dynamin-related protein 1,Drp1)、p66 Shc、Caspase-9、mfn1、CytC引物由武汉塞维尔生物科技有限公司合成。按逆转录试剂盒说明书合成cDNA,反应体系5 μL(5×Prime Script RT Master MiX 2 μL,RNase-free ddH2O 3 μL),轻柔混匀后进行加入DNA扩增仪中,反应条件为:37 ℃ 15 min反转录,85 ℃ 5 s反转录酶失活后,4 ℃保存。RT-q PCR检测mRNA 反应体系20 μL,SYBR Premix Ex TaqⅡ(2×)10 μL、PCR正反向引物(10 μM)各0.8 μL、 ROX Reference Dye(50×)0.4 μL、cDNA 2 μL、灭菌蒸馏水6 μL,进行PCR扩增,反应条件:预变性:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s循环40次,95 ℃ 5 s,60 ℃ 60 s 融解,50 ℃ 30 s降温。以β-actin为内参,得出ΔCt ,目标基因相对表达量以经过处理的样本相对于未经处理的样本的倍数表示,即检测基因相对表达量=2-ΔΔCt(ΔΔCt=ΔCt处理样品-ΔCt未处理样品)。见表1。

表1 各mRNA引物序列
1.4.4 Western blot检测肾组织中的蛋白 取各组大鼠液氮保存肾脏组织100 mg,4 ℃磷酸盐缓冲液(phosphate buffer solution,PBS)浸洗5 min,2 000 rpm离心10 min,去上清后加入200 μL RIPA 细胞裂解液与2 μL 蛋白酶抑制剂混匀,4 ℃ 2 000 rpm离心10 min,收集上清大鼠肾脏总蛋白悬液。采用BCA蛋白质定量试剂盒所取组织中各蛋白的表达浓度。定量结束后取蛋白溶液50 μL,行SDS-PAGE电泳(12%或15%),电泳仪分别按 80 V 20 min,120 V 60 min操作,至溴酚蓝刚达胶底部立刻关闭电泳仪。将PVDF膜切成与凝胶同样大小,置于转移缓冲液中平衡10 min。在甲醇中浸泡10 s,随后在超纯水振荡洗涤5 min。最后置于转移缓冲液中平衡15 min;转膜装置从下至上依次按阳极碳板、24层滤纸、PVDF膜、凝胶、24层滤纸、阴极碳板的顺序放好,滤纸、凝胶、PVDF膜精确对齐,每一步去除气泡,上压500 g重物,吸干碳板上多余的液体。接通电源,根据蛋白量大小,决定转膜需要的电压和时间。转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹。将有蛋白标准的条带染色,放入膜染色液中50 s后,在50%甲醇中多次脱色,至背景清晰,然后将PVDF膜用PBS反复洗膜3次,用含10%脱脂奶粉的PBST封闭液室温封闭1 h,弃封闭液,以5%脱脂奶粉的PBS配制的一抗(p66Shc 1∶5 000;Drp11∶2 000;OPA1 1∶2 000;Mfn11∶2 000;CytC 1∶200;Caspase9 1∶1 000),4 ℃孵育12 h。回收一抗,加入辣根标记二抗(1∶1000)室温慢摇下孵育1 h,弃二抗,PBST清洗条带15 min。以β-actin为内参,采取ECL发光试剂盒显影成像,然后使用Image J 软件分析各蛋白的相对表达水平。
1.4.5 线粒体ROS含量测定 依照试剂盒说明,取各组大鼠1 mm3左右的新鲜肾脏组织,采用机械法收集肾脏组织细胞悬液。500 rpm离心10 min,去上清液,PBS洗涤两次,重悬制备单细胞悬液,加入DCFH-DA(10 μM),37 ℃孵育30 min;探针标记结束后,1 000 rpm离心10 min,收集单细胞悬液PBS洗涤两次后重悬,用酶标仪在488 nm激发波长、525 nm发射波长处检测荧光水平。
1.5 统计学分析
2 结果
2.1 刺芒柄花素对各组大鼠肾功能的影响
与阴性组相比,顺铂组和顺铂+刺芒柄花素组大鼠的血尿素(t=11.937,P<0.001)与血肌酐(t=20.572,P<0.001)的水平上升,且顺铂组>2倍阴性组,表明AKI大鼠造模成功;而刺芒柄花素组大鼠则无明显变化(t=0.043,P=0.967)。与顺铂组相比,顺铂+刺芒柄花素组大鼠的血尿素(t=2.668,P=0.018)与血肌酐(t=11.403,P<0.001)的水平下降。见图1。

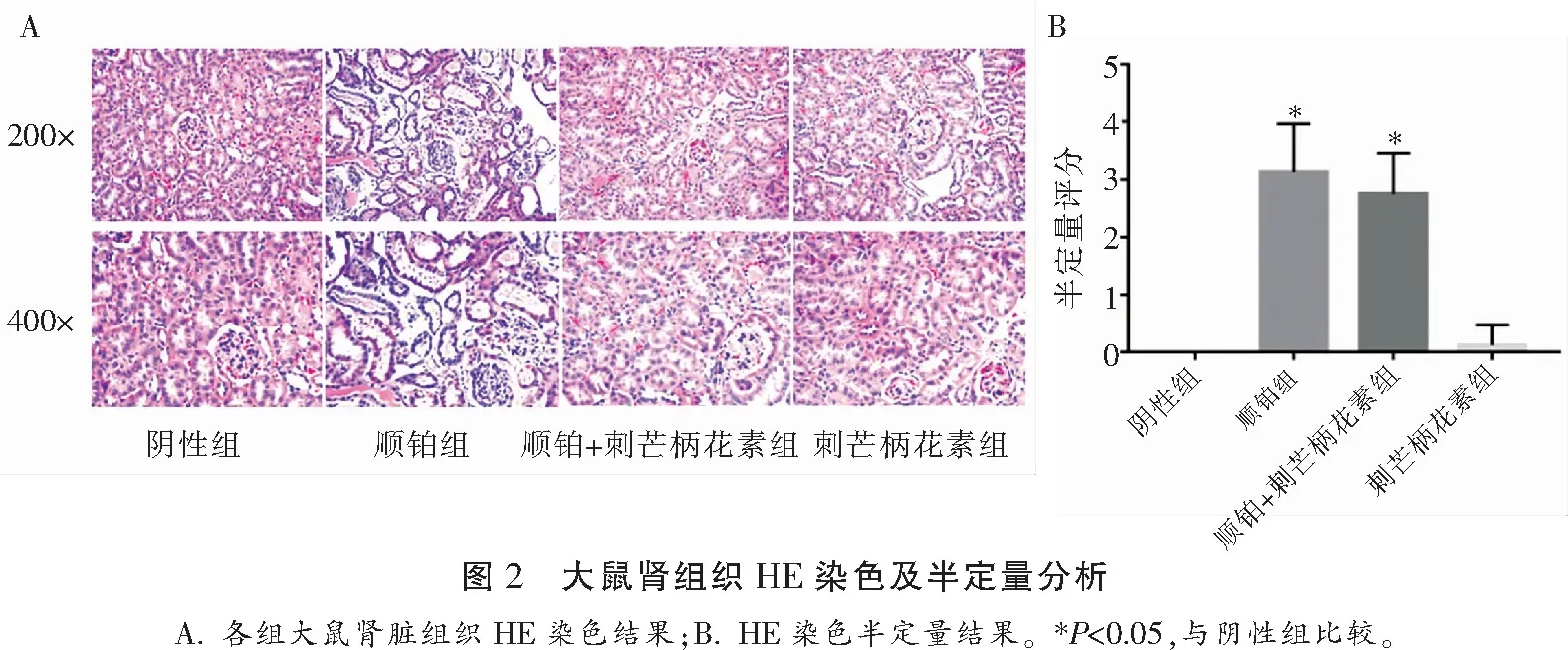
2.2 刺芒柄花素对顺铂所致的急性肾损伤大鼠肾组织形态的影响
与阴性组相比,顺铂组大鼠肾组织出现明显病理变化,肾小管结构紊乱,肾小管扩张,可见管型形成,部分肾小管上皮细胞脱落及裂解,刷状缘不完整;刺芒柄花素组大鼠肾组织形态未见明显病理变化。与顺铂组相比,顺铂+刺芒柄花素组大鼠肾组织损伤病变较轻,偶见管型,肾小管结构恢复较好,肾小管损伤程度评分有所降低,但差异无统计学意义(t=1.099,P=0.290)。见图2。
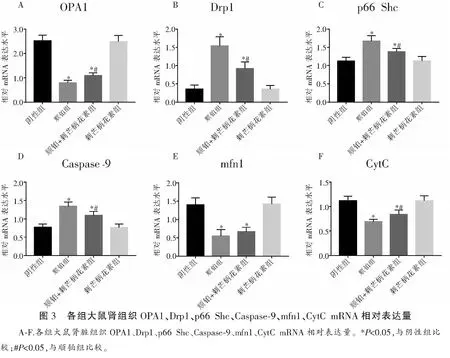
2.3 大鼠肾组织OPA1、Drp1、p66 、Caspase-9、mfn1、CytC mRNA表达量
与阴性组相比,顺铂组大鼠的OPA1、mfn1、CytC mRNA的相对表达量均降低(OPA1:t=19.193,P<0.001;mfn1:t=9.186,P<0.001;CytC:t=11.813,P<0.001),Drp1、p66 Shc、Caspase-9的相对表达量均升高(Drp1:t=12.220,P<0.001;p66 Shc:t=6.639,P<0.001;Caspase-9:t=10.748,P<0.001)。与顺铂组相比,顺铂+刺芒柄花素组大鼠OPA1及CytC mRNA相对表达量上升(OPA1:t=5.455,P<0.001;CytC:t=4.121,P=0.001),Drp1、p66 Shc、Caspase-9的相对表达量均降低(Drp1:t=5.693,P<0.001;p66 Shc:t=4.689,P<0.001;Caspase-9:t=4.344,P<0.001),而两组mfn1相对表达量比较差异无统计学意义(t=1.569,P=0.139)。见图3。
2.4 各组大鼠肾组织OPA1、drp1、p66 Shc、Caspase-9、mfn1、CytC蛋白的表达量
与阴性组相比,顺铂组大鼠的OPA1、mfn1、CytC 蛋白的相对表达量均降低(OPA1:t=14.527,P<0.001;mfn1:t=3.712,P=0.002;CytC:t=13.658,P<0.001),Drp1、p66 Shc、Caspase-9蛋白的相对表达量均升高(Drp1:t=4.989,P<0.001;p66 Shc:t=5.134,P<0.001;Caspase-9:t=14.632,P<0.001)。与顺铂组相比,顺铂+刺芒柄花素组大鼠OPA1、mfn1、CytC蛋白相对表达量上升(OPA1:t=3.436,P=0.004;mfn1:t=2.260,P=0.040;CytC:t=7.187,P<0.001),Drp1、p66 Shc、Caspase-9蛋白的相对表达量均降低(Drp1:t=3.656,P=0.003;p66 Shc:t=3.071,P=0.008;Caspase-9:t=3.947,P=0.001)。见图4。

2.5 刺芒柄花素对顺铂所致急性肾损伤大鼠ROS含量的影响
与阴性组,顺铂组大鼠肾组织细胞ROS的含量升高(t=17.750,P<0.001),刺芒柄花素组大鼠肾组织细胞ROS的含量无明显差异(t=6.402,P<0.001);与顺铂组相比,顺铂+刺芒柄花素组大鼠肾组织细胞ROS的含量下降(t=9.506,P<0.001)。见图5。

3 讨论
急性肾损伤使肾小管上皮细胞失去细胞骨架的完整性和细胞极性[10],在腹腔注射顺铂建立的急性肾损伤小鼠动物模型中可出现肾小管扩张、肾小管上皮细胞空泡变性、管型形成、基底膜裸露、刷状缘消失、上皮细胞脱落及裂解等病理学改变[9]。本研究结果显示,顺铂组大鼠的血尿素与血肌酐的水平高于阴性组,且顺铂组大鼠肾组织出现较明显的病理变化,肾小管结构紊乱,肾小管扩张,可见管型形成,部分肾小管上皮细胞脱落及裂解,刷状缘不完整,表明单次腹腔注射成功诱导大鼠AKI模型。
Drp1为线粒体分裂相关的蛋白,可与线粒体外膜上的受体线粒体分裂蛋白1结合介导线粒体分裂,绝大部分分布于胞浆[11-12]。而线粒体融合由OPA1和mfn1、mfn2介导,线粒体内容物的融合可有效应对细胞应激时能量需求的增加[12]。本研究中,顺铂组大鼠OPA1、mfn1表达均低于阴性组,而Drp1表达则上升;与顺铂组相比,顺铂+刺芒柄花素组大鼠OPA1、mfn1的表达量上升,Drp1的表达量则降低。该结果表明顺铂诱导的急性肾损伤的作用机制可能是通过促进线粒体的分裂,抑制线粒体的融合,刺芒柄花素的使用可有效抑制线粒体非正常分裂,促进线粒体融合,从而修复肾损伤。且与阴性组相比,顺铂组大鼠CytC表达下降,p66 Shc、Caspase-9表达均上升,顺铂组大鼠肾组织细胞ROS的含量升高;而与顺铂组相比,顺铂+刺芒柄花素组大鼠CytC的表达量上升,p66 Shc、Caspase-9的表达量和肾组织细胞ROS的含量均下降。与Brooks等[12-13]研究结果一致,线粒体的过度分裂可能是促进肾小管细胞促凋亡因素。而敲除mfn2基因的小鼠肾小管上皮细胞线粒体融合减少,更易于引发Bax的激活和CytC的释放,进而引起细胞凋亡易感性增加[14]。由此可见,抑制线粒体过度分裂以及促进线粒体融合是增加细胞应激抵抗力的有效措施。p66 Shc作为细胞氧化应激的主要蛋白酶之一,在肾组织中可通过介导高糖诱导的氧化应激延缓了疾病的进展,在正常情况下,p66Shc处于失活状态,不影响线粒体的功能,但在受到p53、H2O2、葡萄糖等信号的作用下,胞浆内的p66 Shc Ser36 发生磷酸化,然后被脯氨酰异构酶PIN1识别从而异构化,并在蛋白磷酸酶PP2A的作用下去磷酸化后进入线粒体,最终在线粒体氧化Cyt C产生活性氧(reactive oxygen species,ROS)。过量ROS可激活OMA1,促进L—OPA1被剪切为S—OPA1,导致线粒体结构网络碎片化、线粒体嵴重构和Cyt C释放,促使细胞凋亡[15-16]。线粒体内的Cyt C释放到胞浆中后,可与Caspase 9前体等形成凋亡复合体,使Caspase 9活化,激活Caspase 3,从而引发Caspase级联反应,最终导致细胞凋亡[17-18]。且与顺铂组相比,顺铂+刺芒柄花素组大鼠的血尿素与血肌酐的水平下降,肾组织损伤与顺铂组相比病变较轻,偶见管型,肾小管结构恢复较好,表明刺芒柄花素对顺铂诱导的急性肾损伤具有一定的保护作用,可减轻顺铂所导致的肾小管及细胞线粒体损伤。因此推测刺芒柄花素对顺铂所致的急性肾损伤大鼠的保护机制可能为抑制线粒体的非正常分裂促进损伤肾脏细胞线粒体的融合,同时阻碍p66Shc的活化,从而减少CytC的释放,避免其与Caspase 9前体结合活化激活Caspase 3,从而减少ROS的生成,抑制线粒体结构的破坏和细胞的凋亡,最终降低肾小管细胞受损的程度,保护肾损伤的组织。
综上所述,刺芒柄花素对顺铂所致的急性肾损伤大鼠具有一定的保护作用,其机制可能与调节线粒体分裂,抑制ROS的产生进而抑制细胞凋亡有关。

