肝纤维化病理过程中肝组织蛋白酪氨酸磷酸酶SHP1的动态表达
靳丽敏,郝礼森,刘玉龄,杨小师,展宗媛,陈盼盼,苗笑佳,何宇
(1.华北理工大学附属医院消化内科,河北 唐山 063000;2.邢台医学高等专科学校第二附属医院消化内科,河北 邢台 054000)
含SH2结构域的蛋白酪氨酸磷酸酶1(SH2 domain-containing protein tyrosine phosphatase 1,SHP1)是酪氨酸磷酸酶家族的重要成员,主要表达于造血细胞,可负性调控其下游的信号转导,是造血系统的抑癌因子[1-3]。研究[4-6]显示,SHP1不仅表达于造血细胞,也表达于一些非造血细胞如上皮细胞、脊髓神经元、肝细胞等,其表达缺失或低表达不仅参与了造血系统肿瘤及一些实体肿瘤的形成及发展,也在某些非肿瘤性疾病的发病机制中发挥重要作用。研究[6-7]发现,肝细胞SHP1在调节肝脏炎症反应中发挥重要作用,过表达可通过抑制转化生长因子β、白细胞介素6及肿瘤坏死因子α等炎症因子减轻小鼠脂肪性肝炎;另有研究[8]发现,在小鼠肝纤维化模型及慢性乙型病毒性肝炎患者的纤维化肝组织中SHP1蛋白均主要分布于纤维化区域,提示在肝纤维化病理过程中肝组织中SHP1的分布发生了变化,但有关肝纤维病理过程中肝组织的SHP1蛋白及mRNA的动态表达仍不清楚。本研究采用腹腔注射四氯化碳法建立大鼠肝纤维化模型,检测了大鼠肝纤维化过程中肝组织SHP1蛋白及 mRNA表达的动态变化。
1 材料与方法
1.1 实验动物及主要试剂
50只健康雄性 SD大鼠(清洁级,体重350~400 g)购于北京华阜康生物科技股份有限公司。小鼠抗3-磷酸甘油醛脱氢酶 (glyseraldehyde-3-phosphate dehydrogenase, GAPDH)单克隆抗体购自arigo公司(台湾);兔抗SHP1单克隆抗体购于BioWorld公司(美国)。本研究所涉及的动物实验操作经华北理工大学实验动物伦理委员会审批。
1.2 方法
1.2.1 大鼠肝纤维化模型的建立 随机将50只SD大鼠分为对照组(n=10)和模型组(n=40)。模型组大鼠腹腔注射50%的四氯化碳橄榄油混合液,1 mL/kg,2 次/周,共8周[9-10],并于造模2、4、6、8周分别取10只大鼠,无菌条件下麻醉后取适量肝组织用4%多聚甲醛固定,用于免疫组织化学、Masson三色及HE染色,另取适量大鼠肝组织保存于-80 ℃,Western blot及实时荧光定量PCR(real-time PCR)检测;对照组大鼠按模型组方法注射,肝组织标本按上述方法同8周模型组大鼠一同留取。
1.2.2 大鼠肝组织病理学及免疫组织化学染色 取出多聚甲醛固定的大鼠肝组织,用石蜡常规包埋后,做成5 μm的连续切片, Masson三色及HE染色检测大鼠肝组织病理学变化。应用SP法进行SHP1免疫组织化学染色,用PBS代替一抗进行阴性对照染色,棕褐色为SHP阳性表达,免疫组织化学染色图像应用Image Pro Plus 6.0软件进行分析,平均光密度值 (mean optical density,MOD) 被用于表示SHP1阳性表达水平。
1.2.3 Western blot分析 取适量于-80 ℃保存的大鼠肝组织提取蛋白,考马斯亮蓝比色法测定蛋白含量后应用Western blot技术分析大鼠肝组织的SHP1蛋白表达,一抗为兔抗SHP1单克隆抗体(1∶100稀释)、小鼠抗GAPDH 单克隆抗体(1∶5 000 稀释 ),二抗为山羊抗兔IgG及山羊抗小鼠IgG(均1∶5 000稀释 ),检测结果用Image J图像软件分析,SHP1蛋白与GAPDH蛋白的积分光密度值比值(相对积分光密度值)表示SHP1蛋白表达量。
1.2.4 Real-time PCR 用Trizoi试剂提取肝组织总RNA,逆转录合成cDNA,引物由invitrogen有限公司合成。内参基因GAPDH引物:上游5′-GGC AAG TTC AAC GGC ACA G-3′,下游5′-CGC CAG TAG ACT CCA CGA CAT-3′,扩增产物122 bp;SHP1引物:上游5′-ATC AAC CAG CGG CAG GAA AGT TTG-3′,下游5′-ATC AAT GAT GAT GAT GGT GCC CGT-3′, 扩增产物96 bp。在 ABI7500实时荧光定量 PCR仪上实时定量扩增。各组大鼠肝组织的SHP1 mRNA表达差异应用相对定量2-△△Ct法比较[11]。
1.3 统计学分析
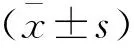
2 结果
2.1 各组大鼠肝组织病理组织学变化比较
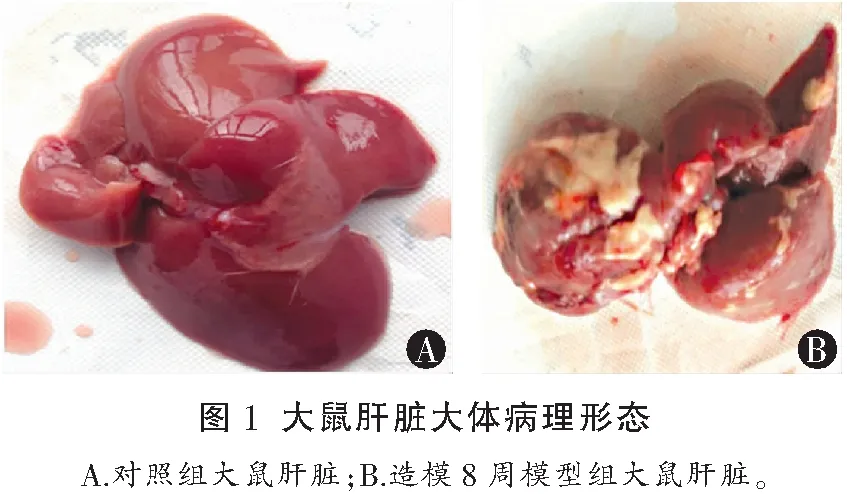
对照组大鼠肝脏质地柔软,表面光滑细腻;模型组大鼠随着造模时间的延长,其肝脏质地逐渐变硬,肝脏表面出现细颗粒状并逐渐出现坚硬小结节,结节周围被灰白色结缔组织间隔包绕。Masson三色及HE染色显示四氯化碳诱导的大鼠肝纤维化模型成功构建;在造模过程中,大鼠肝纤维化逐渐加重,正常肝细胞因出现变性坏死而逐渐减少。见图1及图2。
2.2 各组大鼠肝组织SHP1定位及分布比较
免疫组织化学染色显示,对照组大鼠肝组织表达少量SHP1,主要位于细胞浆;模型组大鼠肝组织,随着造模时间延长其SHP1表达逐渐增多,主要分布于纤维化区域、汇管区,但其亚细胞分布没有变化。模型组大鼠肝组织在2、4、6、8周的SHP1阳性表达MOD(0.11±0.01、0.14±0.01、0.16±0.01、0.19±0.01)均较对照组(0.08±0.01)升高(P<0.05),且随着造模时间延长逐渐增加(P< 0.05)。见图3。

2.3 各组大鼠肝组织SHP1蛋白表达比较
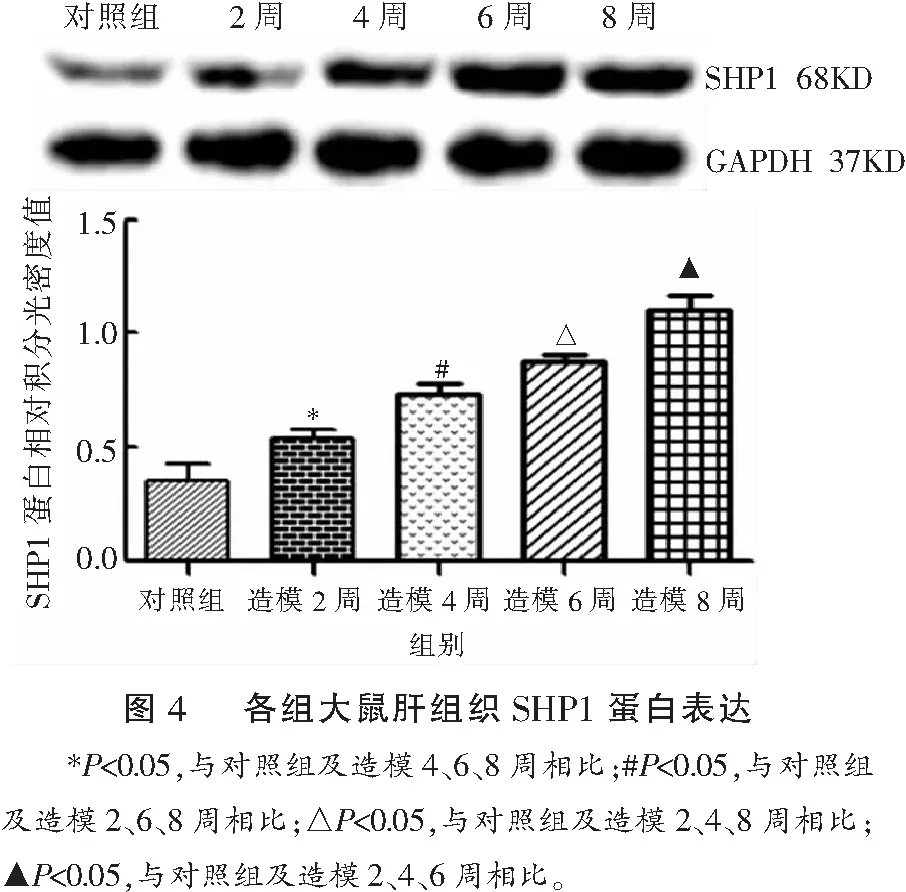
Western blot分析显示,模型组大鼠肝组织在2、4、6、8周的SHP1蛋白表达(0.53±0.04、0.73±0.04、0.87±0.03、1.10±0.07)均较对照组(0.35±0.07)升高(P<0.05),且随着肝纤维化的加重逐渐上调(P<0.05)。见图4。
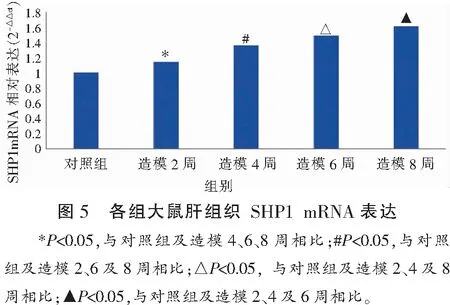
2.4 各组大鼠肝组织SHP1 mRNA表达比较
Real-time PCR检测显示,造模组大鼠造模不同时间(2、4、6、8周)肝组织SHP1 mRNA表达均较对照组升高(P<0.05),且随造模时间延长逐渐上调(P<0.05)。见图5。
3 讨论
肝纤维化是肝脏的损伤修复反应,长期进展可演变为肝硬化[12-13]。当肝脏受到损伤时,静止的肝星状细胞活化,产生大量细胞外间质,进而引起肝纤维化[14-16]。SHP1可负性调节其下游的信号通路,其表达缺失或低表达除在一些实体肿瘤及造血系统肿瘤的形成及发展中发挥重要作用外,也参与了某些非肿瘤性疾病的发病机制[4-6]。研究[8]发现,在四氯化碳诱导的小鼠肝纤维化及慢性乙型病毒性肝炎患者的纤维化肝组织中SHP1蛋白均主要分布于纤维化区域,提示SHP1在纤维化肝组织中的分布出现了改变。
本研究显示,大鼠纤维化肝组织SHP1蛋白主要分布于纤维化区域及汇管区,与上述研究结果一致。但进一步从mRNA及蛋白水平检测发现,大鼠纤维化肝组织的SHP1 mRNA及蛋白表达均随着肝纤维化加重逐渐升高(P<0.05),提示大鼠纤维化肝组织的SHP1不仅分布出现了改变,其表达在mRNA及蛋白水平上均出现与肝纤维化程度一致的升高。研究[12,17]发现,体外活化肝星状细胞的SHP1过表达可抑制其增殖,而在肝纤维化病理过程中在体 HSC的增殖随着肝纤维化的加重逐渐加快,以此推断肝纤维化过程中肝组织的SHP1表达应逐渐下降而不是逐渐升高。研究[6]证实,作为肝脏主要细胞的肝细胞存在SHP1表达,本研究也显示在大鼠肝纤维化病理过程中,肝细胞随着肝纤维化加重逐渐减少,与肝组织SHP1表达升高也相矛盾。
大鼠肝纤维化过程中肝组织SHP1逐渐升高,一方面可能与肝脏炎症反应有关,研究证实肝细胞的SHP1参与了肝脏的炎症反应调节[6],而肝纤维化过程中肝脏一直存在炎症反应,可能是肝纤维化过程中肝脏的炎症反应导致了其SHP1表达升高;另一方面也可能与表达SHP1的在体活化肝星状细胞增多有关,如果表达SHP1的在体活化肝星状细胞增多也可导致肝组织的SHP1表达增高。已有研究[18-19]发现,SHP1磷酸酶活性的发挥受其分子构象调控,在无配体结合时处于自我抑制状态,当酪氨酸磷酸化多肽与其结合后,其构象发生改变,抑制状态被解除才具有磷酸酶活性;并且有学者发现[8,20],SHP1的激动剂如索拉非尼及其衍生物SC-1和SC-43可通过激活SHP1的磷酸酶活性而抑制体外活化肝星状细胞的增殖。
综上,肝组织中SHP1表达虽然升高,但可能处于无活性状态或活性低而对在体肝星状细胞的增殖没有明显影响,具体原因及机制还需进一步研究。

