激光解吸介质阻挡放电电离质谱快速检测苹果表皮的农药残留
杨曼青,陆 桥,Zenobi Renato,杭 纬
(厦门大学化学化工学院,谱学分析与仪器教育部重点实验室,福建 厦门 361005)
随着农业的快速发展以及新型农药的不断涌现,农药在当前农业生产中得到愈加广泛的应用,其对农作物的保护、增产作用是毋庸置疑的,但由此带来的农药残留问题也越来越受到人们的广泛关注.长期食用农药残留超标的食物,会增加人体肝脏和肾脏的负担,造成慢性甚至急性中毒.研究表明长期接触并使用农药会增加致癌和致畸的风险[1-3].根据农药的生物活性和具体的分析要求,食品果蔬中农药的最大残留限量(maximum residue limit,MRL)从1 μg/kg量级到1 mg/kg量级不等.我国已经对果蔬中农药的MRL进行严格限制,以尽量减少农药带来的危害[4].
传统的农药检测方法主要是基于分离的气相色谱-质谱联用技术(gas chromatography-mass spectrometry, GC-MS)[5]和高效液相色谱-质谱联用技术(high performance liquid chromatography-mass spectrometry, HPLC-MS)[6],它们可以实现对农药残留以及食品添加剂等的精准定量检测.近年来随着高分辨MS以及串联MS的引入,未知待测物定性识别难的障碍也已经被克服[7],并且已经发展成为当前各国农药残留检测的主要手段.但是这类方法往往需要对样品进行溶解、萃取、浓缩,甚至提纯等繁琐的前处理步骤,检测耗时长、成本昂贵;而且基于色谱分离的检测技术会不可避免地产生基质效应,影响检测结果的可靠性[8].因此迫切需要开发无需或仅需少量样品前处理步骤、高通量、低成本的方法,用于原位快速检测复杂基质表面的农药残留.
20世纪70年代,激光的问世有力地推动了MS在表面分析科学的发展,激光解吸电离质谱(laser desorption ionization mass spectrometry, LDI-MS)凭借超快速、极微量、高通量、原位采样的优势已经被广泛应用于生命医学、材料分析、物质检测等领域[9-11].然而传统的LDI-MS技术对解吸分子的电离效率较低,进入MS的粒子绝大多数以中性分子形式存在,它们不但不能被检测器捕获,还容易沉积在MS腔体内造成仪器污染.为了解决上述问题,近年来在激光解吸采样之后引入后电离装置,用以提高电离效率的尝试备受研究者的青睐.Herdering等[12]采用213 nm Nd:YAG紫外激光器耦合大气压化学电离源和轨道离子阱MS,搭建了一台激光溅射大气压化学电离质谱(laser ablation atmospheric pressure chemical ionization mass spectrometry, LA-APCI-MS),用于药片中主要成分咖啡因和对乙酰氨基酚的检测.Zhou等[13]采用2 940 nm红外激光器耦合电喷雾电离(electrospray ionization,ESI)源以及飞行时间MS,用于新鲜肉类的种类鉴定,并通过主成分分析以及偏最小二乘判别分析证明该方法准确性高且适用性强.Zhang等[14]采用多波长可调激光器(355,532,1 064 nm)耦合实时直接分析(direct analysis in real-time,DART)电离源,构建了一台等离子体辅助多波长激光解吸电离质谱(plasma assisted multi-wavelength laser desorption ionization mass spectrometry,PAMLDI-MS),成功用于检测颜料混合物、标准药物、茶叶萃取物等小分子.
介质阻挡放电电离(dielectric barrier discharge ionization,DBDI)是一种通过在介质相隔的两电极间施加交变电流,放电产生低温等离子体使周围气化的分子电离的技术.它可以在不加热样品的条件下对中性分子实现高效软电离[15],而且装置体积小,可以与任何大气压MS直接连接,自2007年被清华大学张新荣课题组提出以来,被广泛应用于分析检测领域[16-17].基于此,本研究搭建了一台激光解吸介质阻挡放电电离质谱(laser desorption coupled dielectric barrier discharge ionization mass spectrometry,LD-DBDI-MS),它的主要优势在于:1)与传统的激光解吸后电离技术相比,该装置不需要溶剂以及额外气体辅助电离,降低了装置的复杂性;2)将介质阻挡放电毛细管与MS毛细管接口直接相连,显著提高了电离、传输效率以及检测信号的稳定性.本研究利用该装置对苹果表皮复杂基质中的农药残留进行原位定性和半定量检测,结果表明该方法稳定、灵敏,能够作为苹果表皮复杂基质中农药残留超标检测的工具.
1 仪器与方法
1.1 试 剂
三环唑(C9H7N3S,Mw=189.25,纯度98%)和抑霉唑(C14H14Cl2N2O,Mw=297.18,纯度98%)均购自北京伊诺凯试剂公司,乙醇(C2H6O,纯度99.99%)购自国药集团化学试剂有限公司.实验所用农药和乙醇均为分析纯,使用前没有进一步纯化.实验所用的蒸馏水均产自Milli-Q超纯水系统(Millipore,美国).
1.2 样品制备
农药标准品溶液的制备:分别称取10 mg三环唑和抑霉唑标准品,溶解于10 mL乙醇中,配制成1 000 mg/L的储备液于4 ℃下冷藏待用;用去离子水稀释储备液获得其他浓度的标准品溶液.移取2 μL特定浓度的农药标准品溶液,点样于洁净的载玻片上,室温下晾干,用双面胶将载玻片固定于样品靶上等待分析.除另有说明外,本研究的所有农药残留浓度均表示干燥前溶液中农药的质量浓度(mg/L或μg/L).
真实样品的制备:苹果(购自厦门大学附近超市)用去离子水清洗3次,自然晾干后用铅笔在苹果表皮上标记出2.5 cm×2.5 cm 的区域,采用10 μL的GC注射器向该区域均匀添加10 μL特定浓度的三环唑标准品溶液,自然风干,切下厚度约1 mm的果皮,用双面胶固定于样品靶上进行检测.
1.3 DBDI离子源
DBDI装置的工作原理在文献[18-19]中已有详细介绍.一根石英玻璃毛细管(内径0.7 mm,外径1.0 mm)被连接到MS(毛细管)入口,MS仪内恒定的低压保证了毛细管内的空气流量固定为1.37 L/min.石英毛细管中水平插入一根长23 mm的不锈钢毛细管(内径0.5 mm,外径0.6 mm)作为接地电极,一个长5 mm包裹在石英毛细管周围的铜环(内径1.0 mm)作为高压电极.样品以及空气在MS仪的负压作用下直接从不锈钢毛细管被吸入DBDI源.在两电极间施加约3 kV、40 kHz的正弦调制交流电,石英毛细管内由介质阻挡放电激发产生等离子体,这些等离子体用来电离通过毛细管的空气以及待测分子,无需额外气体辅助电离.石英玻璃毛细管外部采用聚氯乙烯/聚四氟乙烯外壳包裹,以确保操作人员的安全.
1.4 激光解吸系统
采用输出波长为532 nm的灯泵紧凑型电光调Q激光器penny-A-100(鞍山紫玉激光科技有限公司)作为解吸采样源.激光脉冲重复频率10 Hz,脉宽10 ns,能量0~35 mJ可调,激光水平方向射出,经反射镜反射光路改变90°,聚焦透镜到样品靶的距离为10 cm,使得解吸光斑恰好竖直落在样品表面.样品靶以15°倾角朝向DBDI毛细管入口放置.手动微调样品靶,使得激光采样点到DBDI毛细管入口的距离固定为2 mm,以保证最大数量的解吸分子被吸入DBDI毛细管.样品靶通过x-y-z三维移动平台精确控制(北京北光世纪仪器有限公司).
1.5 MS仪
本研究采用高分辨四级杆飞行时间MS(Impact Ⅱ,德国布鲁克公司),移去MS仪原本搭配的ESI源,将自制的DBDI源与MS入口相连接.MS毛细管电压为0 V,入口毛细管温度保持在180 ℃,管透镜补偿电压为200 V.数据采集质量窗口设置为m/z=50~1 300,质量分辨率在m/z=190.03处为28 000.本研究中所有MS数据均在正离子模式下采集,使用Quant Analysis version 4.3软件(德国布鲁克公司)对采集到的数据进行后处理.水果表皮复杂基质中待测农药分子通过串联MS进行定性识别.
2 结果与讨论
LD-DBDI-MS的实验装置如图1所示,激光经聚焦透镜聚焦后从正上方竖直溅射样品靶上的待测物表面.DBDI源与MS入口直接相连,空气作为载气,激光解吸的物质混入空气流以恒定的流速从不锈钢毛细管内电极直接进入DBDI源电离,电离后的分子被直接传送到MS仪进行质量分析.
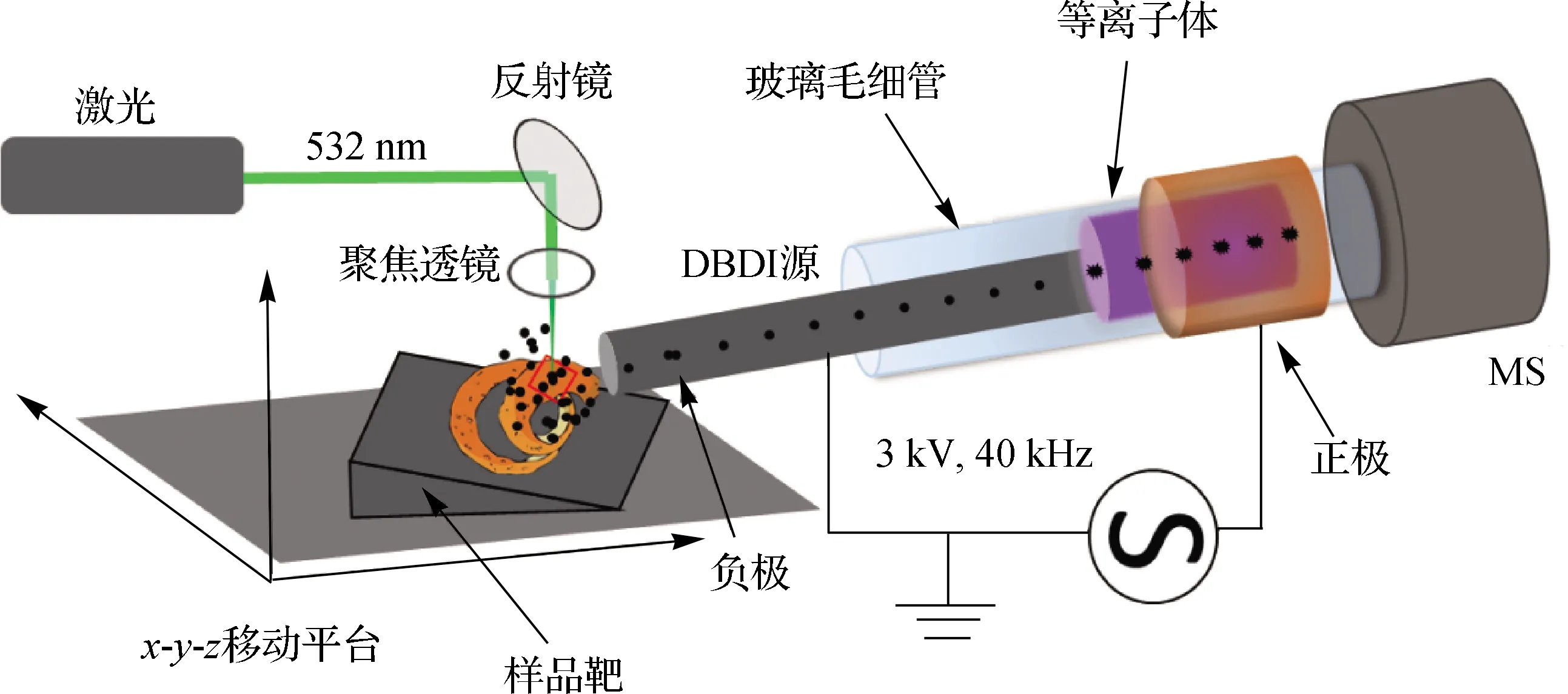
图1 LD-DBDI-MS的实验装置示意图
激光被誉为“一把锋利的刀”,无论待测物是液体还是固体,它都可以在短时间内将样品表面的物质解吸气化为羽状,但是气羽分子中被电离的粒子仅占千分之一左右甚至更低[20],因此为了高效利用“废弃”的中性粒子,本研究引入DBDI后电离装置.三环唑和抑霉唑是两种内吸型广谱杀菌剂,毒性中等,药效持久,本研究以二者为模型分子进行实验.在其他条件完全相同时分别采用LDI-MS和LD-DBDI-MS两种模式得到三环唑和抑霉唑标准品溶液(100 mg/L)的残渣MS谱图(图2),可以明显看出当只使用激光解吸电离时,三环唑质子化离子峰([M+H]+,m/z=190.04)和抑霉唑分子离子峰(M+,m/z=297.04)的信号均较弱,主要是因为激光更大程度上将待测分子解吸,而电离效率不足,使得进入MS的绝大多数粒子以中性形式存在,不能被检测器捕获.在激光解吸之后引入DBDI后电离装置,三环唑质子化离子峰信号强度提高了约500倍,抑霉唑分子离子峰信号强度提高了约100倍.由此可见,DBDI后电离装置可以高效电离激光解吸产生的中性粒子,使得MS信号显著提升,同时在LD-DBDI-MS谱图中并未发现明显的待测物碎片峰,这也印证了DBDI软电离的特性.DBDI对两种待测分子电离形式差异的主要原因是:电离所用载气为空气,空气中含有大量水蒸气,经等离子体电离后能够形成水分子簇阳离子;三环唑分子中唑环氮原子是强质子化位点,容易接收水分子簇阳离子中的质子,发生质子转移反应,使得电离效率极大增强,而抑霉唑分子的质子化位点相对较弱,更倾向于发生电荷转移反应,即等离子体使空气中的氮气分子电离产生N2+,抑霉唑分子中的电子再被N2+夺取,进而产生样品分子离子M+.
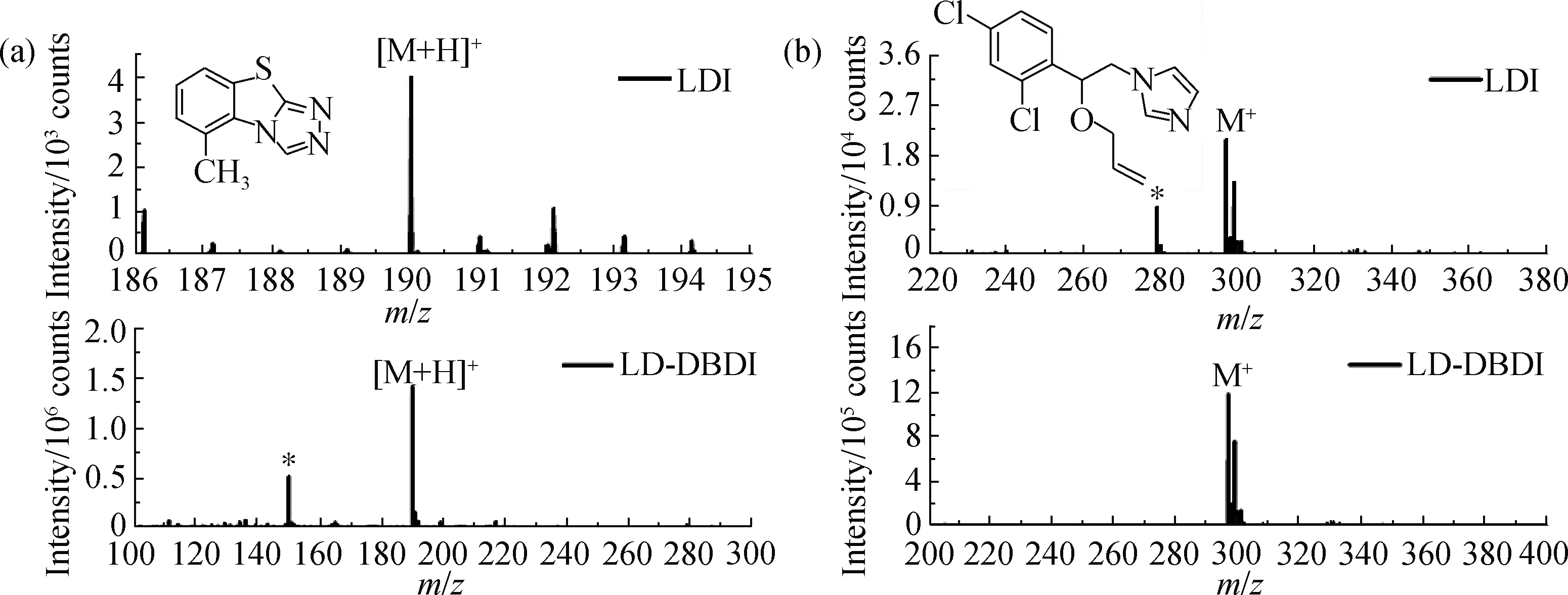
*为背景峰.
2.1 LD-DBDI-MS检测农药标准品
首先依据三环唑质子化离子峰信号强度优化实验参数.采用2 μL 100 mg/L的三环唑([M+H]+,m/z=190.04)标准品溶液的点样残渣,考察激光功率密度、激光溅射点与DBDI毛细管入口的距离、样品靶与水平方向的夹角对MS信号的影响.由图3(a)可知,三环唑质子化离子峰信号强度会随着激光功率密度的增大先增强后减弱,当功率密度达到668 MW/cm2时信号最强.这可能是因为:随着激光功率密度增大,单次解吸样品的量增多,获取的信号增强;当激光功率密度过大时,样品溅射羽的扩散也随之变强,导致最终进入DBDI毛细管的气态样品浓度降低,检测信号减弱.由羽状扩散动力学可知,激光采样点与DBDI毛细管入口的距离以及样品靶与水平方向的夹角均会显著影响采样效率,进而影响信号强度.如图3(b)所示,当激光采样点到DBDI毛细管入口的距离为2 mm 时,MS信号基本达到最强,继续缩小距离则MS信号没有明显增强,但是激光采样点距离DBDI毛细管入口过近时,存在灼蚀DBDI的风险,因此将最佳距离设定为2 mm.样品靶与水平方向的夹角直接影响溅射羽的扩散方向,由图3(c)可知,样品靶与水平方向夹角为15°时检测信号最强,推测是因为解吸羽的扩散方向正好与DBDI入口最佳耦合,此时最大数量的解吸分子进入DBDI毛细管.因此后续实验均在激光功率密度为668 MW/cm2,激光采样点与DBDI毛细管入口的距离为2 mm,样品靶与水平方向夹角为15°的条件下进行.

图3 激光功率密度(a)、激光采样点与DBDI毛细管入口距离(b)以及样品靶与水平方向夹角(c)的优化曲线
为了验证该装置的检测灵敏度以及信号稳定性,取2 μL质量浓度分别为5,10,25,50,100,250和500 μg/L的三环唑标准品溶液以及10,100,250,500和1 000 μg/L的抑霉唑标准品溶液,点样于载玻片上,晾干后进行检测,每个质量浓度进行多次重复实验取平均值,建立如图4(a)和(b)所示的三环唑的质子化离子峰和抑霉唑分子离子峰信号强度与其标准品溶液质量浓度之间的线性标准曲线,基于3倍信噪比(S/N=3)计算可得检测限分别低至2和7 μg/L.为了评估该方法的绝对检测质量,取2 μL掺杂中性红的三环唑标准溶液点样于载玻片上,晾干后形成红色样斑.采用形状测量激光显微系统(VK-X250K,Keyence,日本)表征样品斑点直径为2 mm.经过激光单次溅射后再次表征采样点,如图4(c)所示,中心100 μm的亮斑为激光溅射区域,外围直径为300 μm的稍亮区域为样品解吸区.基于检测限2 μg/L计算,添加2 μL三环唑标准品溶液,即4 pg, 样斑直径为2 mm,激光解吸直径为300 μm,因此该方法对三环唑标准品的绝对检测量低至90 fg,说明该方法具有高的检测灵敏度,可用于痕量样品的检测.接着用250 μg/L的三环唑标准品溶液依次制样30个,以检验该方法的信号稳定性.如图4(d)所示,横坐标代表采样个数,纵坐标为MS信号强度,水平线代表信号平均值,由此可见本方法信号稳定性在可控范围之内,相对标准偏差(RSD)为17.5%.
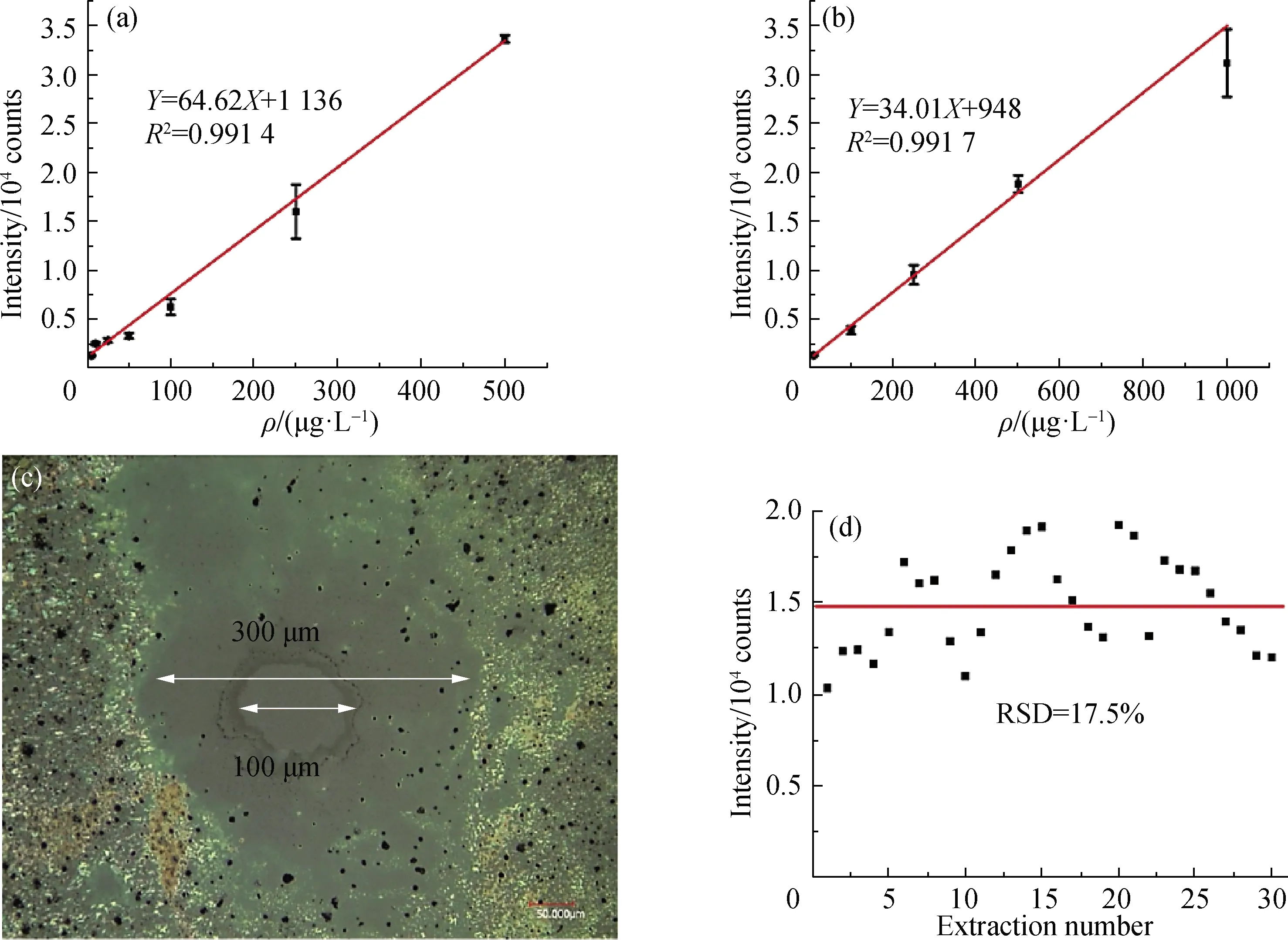
图4 三环唑(a)和抑霉唑(b)的线性标准曲线,激光采样光斑图(c),以及三环唑标准品溶液的重现性测试(d)
2.2 苹果表皮农药残留的原位检测
为了检验LD-DBDI-MS在实际样品中的定性和半定量分析检测能力,采用标准加入法,将已知量的三环唑和抑霉唑标准品溶液均匀添加到洁净的苹果表面,用以模拟真实苹果表面的农药残留.将分别添加了三环唑和抑霉唑的苹果表皮固定于样品靶上,采用激光直接解吸采样.由于实际样品所得的MS谱图存在一定的基质背景,为了准确辨别苹果表皮的三环唑残留分子信号,接下来采用串联MS进一步辨别复杂基质中的目标化合物.通过碰撞诱导解离(collision induced dissociation,CID)实验,碰撞能量设置为30 eV,氮气作为碰撞气体,质量窗口宽度为±1 u,对三环唑质子化离子峰(m/z=190.04)进行碎片化.如图5(a)所示,产生m/z=163,136,109和92的碎片峰,这与三环唑标准品以及文献[21]报道的三环唑碎片离子峰完全一致.本研究还对苹果表皮检测到的抑霉唑分子离子峰(m/z=297.04)进行CID实验,产生m/z=255,201和158的抑霉唑特征碎片峰及m/z=299的抑霉唑分子离子同位素峰(图5(b)),再次验证了该装置拥有特异性识别复杂基质表面目标化合物的功能.
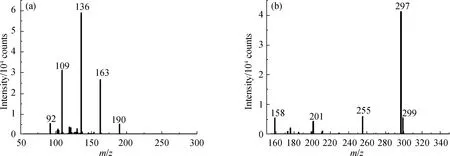
图5 LD-DBDI-MS/MS检测苹果表皮残留的三环唑(a)和抑霉唑(b)
为了进一步检验该方法在实际样品中的检测精度,用铅笔在未检测出外源物的苹果表面标记出2.5 cm×2.5 cm 的待测区域,采用10 μL的注射器向该区域均匀添加10 μL质量浓度分别为0.1,0.5,1,10,100和1 000 mg/L的三环唑标准品溶液,自然风干,标记处的苹果皮直到检测时才被切下置于样品靶上进行检测,以保证检测结果的最大真实性.将获得的三环唑质子化离子峰(m/z=190.04)的信号强度与对应的添加质量浓度建立线性曲线,每个质量浓度至少检测5次,取平均值.所得的苹果表皮的三环唑残留线性曲线如图6所示,检测限低至0.1 mg/L,并且真实样品在跨越4个数量级的质量浓度范围内(0.1~1 000 mg/L)具有良好的线性关系(R2=0.961 9).
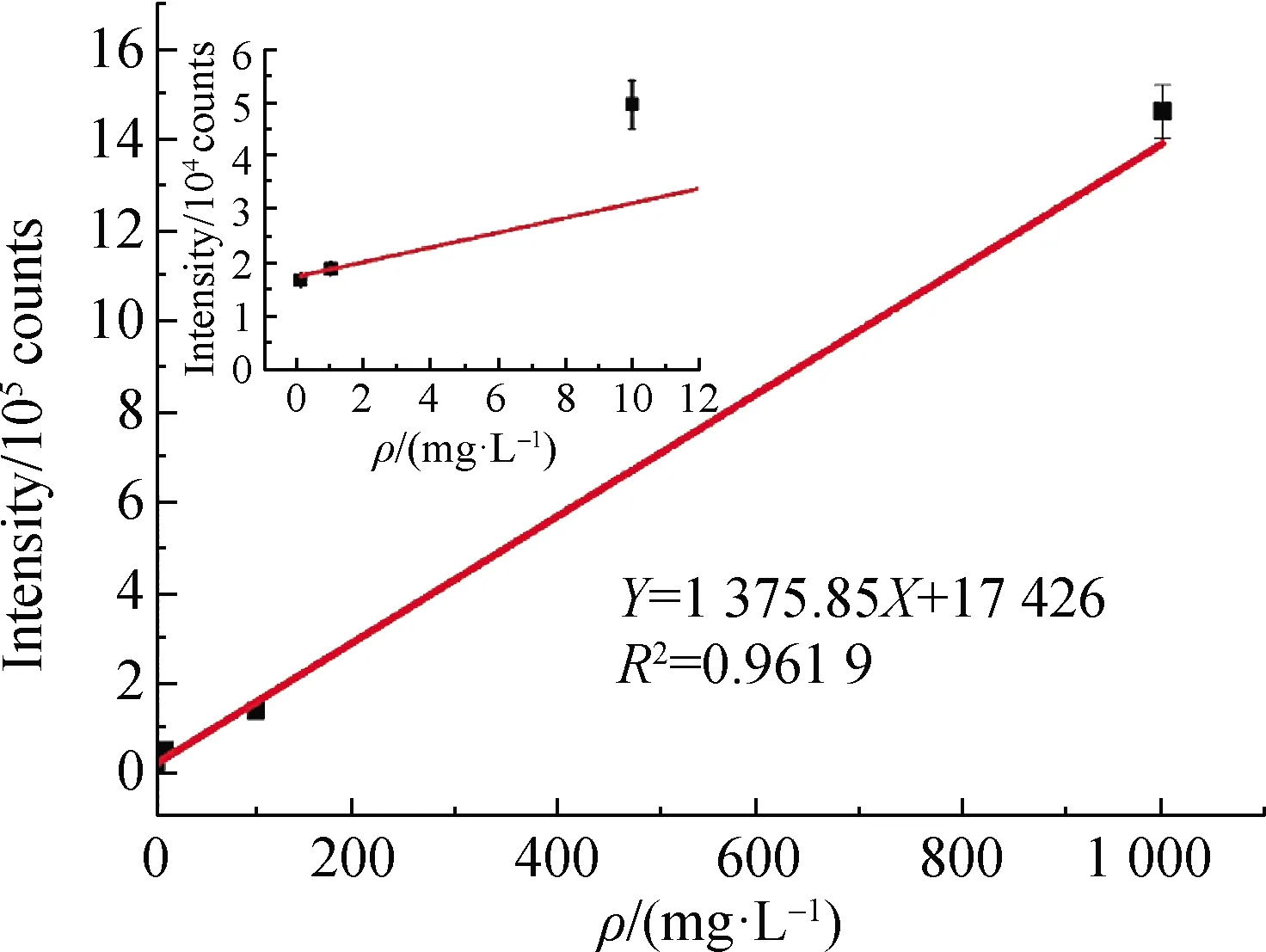
图6 LD-DBDI-MS法获得的苹果表皮残留的三环唑质子化离子峰信号强度与质量浓度的线性曲线(n=5)
苹果中农药残留的质量分数计算方法采用如下公式:
(1)
其中:w为苹果中农药残留的质量分数,mg/kg;m为能够检测到的三环唑质量,ng;r为苹果的半径,约为4 cm;S是待测苹果皮的面积,6.25 cm2;M表示苹果的总质量,250 g.
当添加10 μL 0.1 mg/L三环唑溶液(相当于向待测苹果表皮添加1 ng的三环唑)时,可以获得确定的检测信号,被认为是目前该方法在实际苹果表皮的最低检测质量.代入式(1)计算可得,三环唑残留相对于整个苹果质量的质量分数为130 μg/kg(这里将苹果视为圆形),远低于国家标准GB 2763—2019[4]规定的三环唑果蔬类MRL(2 mg/kg),证明该方法能够作为苹果表皮农药残留超标快速检测的工具.
3 结 论
本研究采用LD-DBDI-MS结合标准品加入法,建立了苹果表皮痕量农药残留的定性和半定量检测方法.该方法将激光原位、快速、高通量取样的优势与DBDI高效、软电离的特性相结合,实现了待测分子解吸与电离在时间和空间上的分离,便于对两个过程进行分别优化,并且基于主动毛细管进样的设计,不需要额外的气体辅助电离,同时使得电离和传输效率显著提高.该方法具有良好的稳定性(RSD=17.5%)以及高的灵敏度,对于三环唑标准品溶液的检测限可低至2 μg/L,实际样品苹果表皮三环唑的最低检测量低至1 ng,相当于130 μg/kg,远低于国家标准GB 2763—2019所规定的果蔬类三环唑MRL(2 mg/kg),而且在0.1~1 000 mg/L跨越4个数量级的质量浓度范围内具有良好的线性关系(R2=0.961 9).与传统的基于色谱分离的技术相比,该方法操作简单,无需样品前处理,1 min之内即可实现对复杂基质中残留农药分子的原位快速检测,有望成为水果等农药残留超标的快速检测工具.

