基于FDA不良事件数据库阿替普酶药物警戒信号的检测与分析
杨敏
遵义医科大学第三附属医院/遵义市第一人民医院药剂科,贵州遵义 563000
阿替普酶为重组组织型纤溶酶原激活剂[1],通过诱导纤溶酶原转化为纤溶酶导致纤维蛋白降解达到溶栓的目的[2]。1996年美国食品药品监督管理局(FDA)批准阿替普酶用于治疗急性缺血性脑卒中[3]。2021版《欧洲卒中组织急性缺血性卒中静脉溶栓指南》对于发病4.5 h内的急性缺血性卒中强推荐阿替普酶溶栓治疗[4]。但随着阿替普酶的广泛应用,药物不良反应也越来越多,包括:持续低血压、寒战、休克、高热、血管源性水肿、出血等[7]。因药品上市前的临床研究结果不能涵盖药品上市后可能存在的安全性问题,故药品上市后的研究为药品上市前的延续[6]。目前,阿替普酶药物不良事件(ADE)的分析仅局限于临床观察和系统性评价,其仅简单提及且未做深入分析[7-8]。数据挖掘可从大量、有噪声、不完全的数据中挖掘到蕴含在其中潜在有用的信息,该技术正逐步运用到药物警戒领域[9]。本研究通过数据挖掘方法使用比值比法(ROR)和比例报告比值法(PRR)对美国FDA不良事件报告系统(FAERS)中对阿替普酶相关可疑ADE信号进行分析挖掘,以期为临床医师安全合理用药提供参考。
1 资料与方法
1.1 数据来源 收集美国FAERS数据库中2004年1月1日—2021年6月30日的报告数据,包括:人口资料、ADE、报告来源、日期等内容,导入MySQL数据库软件。
1.2 数据处理 因同一患者的同一ADE可能存在多个报告,因此需删除重复报告[10]。删除重复报告后,采用“Alteplase”对应MySQL中的“drugname”字段进行检索,因药物FAERS中报告“Role code”项下存 在“Primary Suspect Drug”“Secondary Suspect Drug”“Concomitant”“Interacting”为结果的可靠性,本文只筛选出以阿替普酶为首要怀疑药物(Primary Suspect Drug)的报告。
1.3 信号检测方法 本研究使用比列失衡法中的ROR法(ROR荷兰药物警戒中心Lareb实验室开发)和PRR法(澳大利亚巴拉瑞特大学、日本东京大学等研究机构开发)[11],方法主要基于四格表。由于ROR法和PRR法均有很强的灵敏性[12],本研究为了避免出现假阳性信号,提高阈值,要求数据同时满足以下条件:目标药物的目标ADE报告数(即四格表中的a)>5;ROR 95%CI下限和PRR 95%CI下限均>1[13]。
1.4 信号分类数据筛选与计算 首先将选出的ADE合并相同ADE名称,删除非ADE,并按照MedDRA的系统器官分类进行统计整理,将挖掘的信号使用首选术语(PT)进行编码,筛选出有信号的PT[14-15]。
2 结果
2.1 阿替普酶相关ADE基本情况 去除有关食品、医疗器械以及药品名称不确定的事件,多份重复报告的保留其中一份,共得到以阿替普酶为首要怀疑药物的ADE报告共5 907份,其报告信息分布见表1。

表1 阿替普酶相关ADE基本情况
2.2 阿替普酶相关ADE信号检测结果及其强度 将ADEs所涉及的部位按器官系统分类,共挖掘出156个药物安全警戒信号,阿替普酶前50位安全警戒信号报告数及信号降序排列见表2。
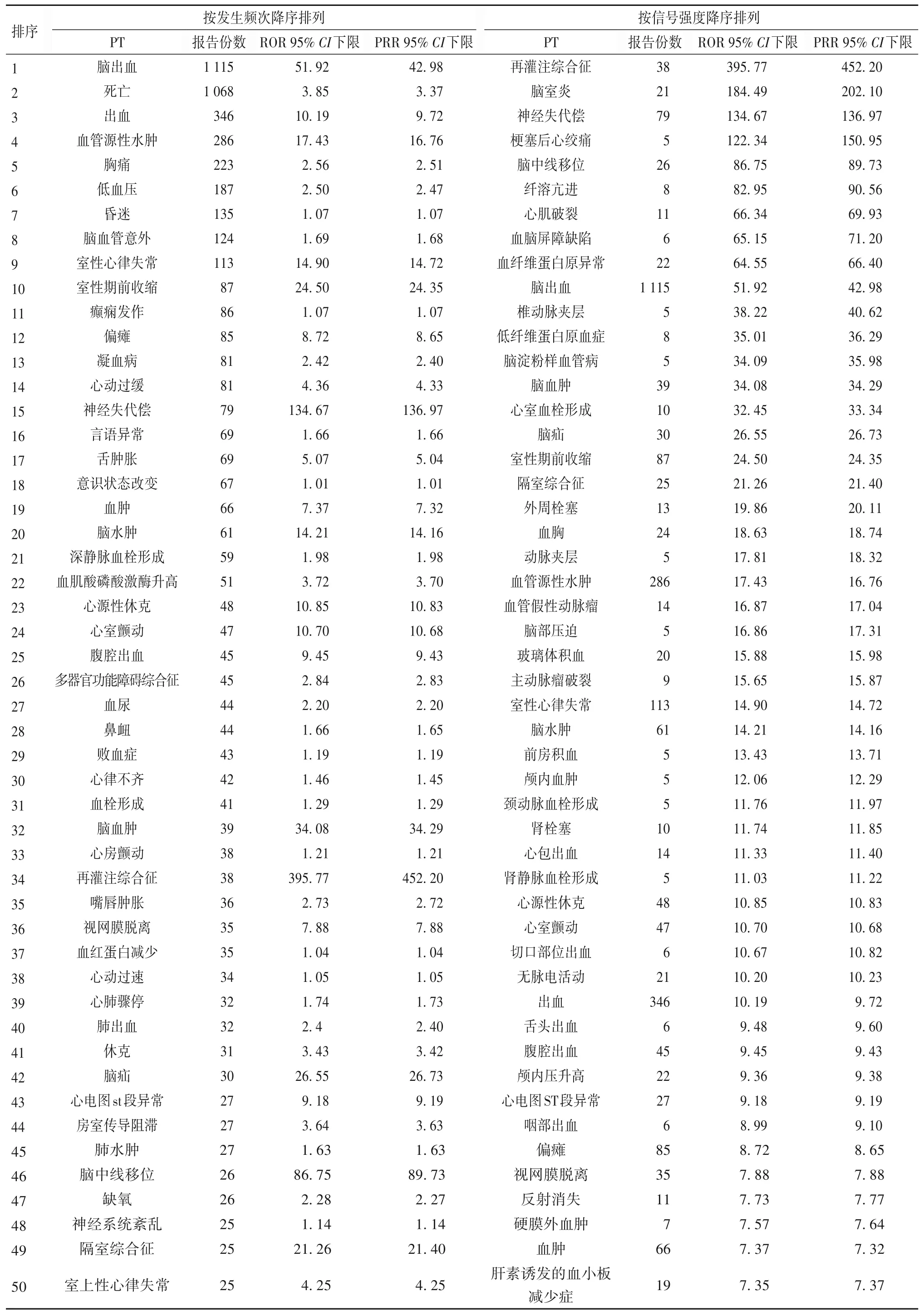
表2 阿替普酶前50位安全警戒信号报告数及信号降序排列
2.3 阿替普酶新的药物警戒信号 根据阿替普酶药品说明书、适应证,文献提示可能的新的安全警戒信号21个。见表3。

表3 阿替普酶新的药物警戒信号
3 讨论
药物警戒主要在于收集并分析药物上市后的大量数据,最后得出具有说服力的结论。药物警戒的主要目的是增强临床医务人员及患者对药品(风险)的警惕性,提高患者用药的安全性[16]。目前药物警戒研究的难点在于如何获取全面的真实世界的药物安全性数据,并对其进行深入挖掘。本研究基于FAERS数据库中数据,并使用数据挖掘的方法对其深入挖掘。
3.1 性别和年龄分布分析 阿替普酶的ADE报告中男性占33.79%,女性占24.48%,可能的原因主要为阿替普酶主要用于急性缺血性卒中、心肌梗死、肺栓塞的溶栓治疗,有文献报道急性缺血性卒中和肺栓塞男性发病率稍高于女性[17-18],导致男性阿替普酶用药人群较女性人群高,ADE发生率也较女性高。随着年龄的增长,脑卒中和心肌梗死、肺栓塞风险逐步上升[19-20]。老龄患者因基础疾病增加、抵抗力下降等各项原因,ADE的发生风险增加,这与本研究得到的结果一致。
3.2 患者转归情况分析 本研究显示,使用阿替普酶后患者转归主要为:其他(46.13%)、死亡(31.06%)、住院时间延长(14.76%)、危及生命(5.67%)。根据阿替普酶药品说明书,死亡和永久残疾的报告见于发生卒中(包括颅内出血)和其他严重出血事件的患者。阿替普酶溶栓后颅内出血发生率为4.7%~11.4%,其中颅内症状性出血(sICH)虽少见(发生风险为2%~7%),但这却是严重的并发症,其中脑实质血肿-2亚型患者具有接近50%的病死率[22]。有研究得出,患者高龄、高血压史、心衰病史、高血糖为阿替普酶发生出血不良反应的独立危险因素。对符合阿替普酶静脉溶栓的患者,若合并上述高危因素,在溶栓前应谨慎评估,患者出现严重头痛、高血压、恶心呕吐,或神经症状体征恶化,需高度怀疑症状性颅内出血,应立即停用溶栓药物并行脑CT检查,卧床休息,避免剧烈运动及情绪激动,控制血压及颅内压,严重者需外科评估是否手术,以降低病死率[23]。
3.3 说明书已收录的不良反应 ROR 95%CI下限和PRR 95%CI下限数值越大表示目标药物与目标不良反应之间的联系越强[13]。本文对ROR值和信号频次排名前50位的ADE报告进行分析,其中药品说明书中记载的不良反应基本包括在所列的信号之内并且信号数据强烈。如脑出血、出血、脑血管意外、心动过缓、心动过速等,这同时也证实了本研究的可信度。
3.4 新的疑似ADR信号 本研究发现了21个未在阿替普酶说明书中出现的药物警戒信号。其中发生舌头水肿、水肿口、嘴唇肿胀、喉气管水肿,可能原因为阿替普酶引起的过敏反应,有文献报道阿替普酶导致的过敏反应较常见类型为血管源性水肿,通常在给药后2 h之内出现[24],主要表现为皮肤、黏膜及黏膜下组织急性局限性水肿,累及部位包括口唇、舌头、咽喉或颜面部[25-26]。并有文献指出,同时服用阿替普酶和血管紧张素转换酶抑制剂类药物的患者发生舌血管源性水肿的概率增加13.6%[27]。其可能的原因为:患者服用阿替普酶后体内的纤溶酶原转化为纤溶酶,纤溶酶可裂解 C1、C3为 C1a、C3a,激活补体级联反应,并释放大量C4a、C5a和激肽C2等,导致肥大细胞脱颗粒,组胺释放,这些介质会引起毛细血管渗漏,引起血管扩张和增加血管通透性。患者同时服用ACEI类药物后,基础缓激肽的水平升高,抑制血管紧张素转换酶作用抑制缓激肽的降解,从而加重血管源性水肿,这提示临床医师若患者同时服用阿替普酶和血管紧张素转换酶抑制剂应重点关注该类药物不良反应。若患者出现上述症状可根据不良反应的严重程度,选择激素、抗组胺药物或肾上腺素等来进行处理[5]。
阿替普酶为重组组织型纤溶酶原激活剂,静脉给药后可以直接激活纤溶酶原使之转化为纤溶酶,降解纤维蛋白,达到溶解血栓的目的,但其常见不良反应为出血,若患者发生外周出血,发生皮下及深肌层血肿,最终可导致组织坏死和坏疽[28]。若出血发生在眼部,眼部出血后最终导致眼内压增高、黄斑病变、视网膜脱落,最终导致失明。
本研究也存在一定局限性:由于FAERS的局限性目前无法得到ADE的发生率;FAERS未对患者基础疾病进行单独统计分析,无法排除基础疾病对ADE风险的影响。但由于药品说明书收录的药物不良反应,在试验阶段会存在受试者选择有严格的条件、研究人数有限、研究时间等限制,不能完整地获得药品的安全性信息。然而FAERS数据库数据量大、覆盖人群广,上市后的药物警戒信号挖掘可以部分弥补上述不足。
可见,阿替普酶药品说明书中未收录的药品警戒信号累计器官和系统分布较广泛,建议临床用药时应注意监测患者的不良反应,及时采取干预措施。

