生物表面活性剂产生菌的诱变育种及特性研究
吴从文,刘晓丽,钟世坤,马艳清,裴 帅
(1.中国石油新疆油田分公司陆梁油田作业区,新疆 克拉玛依 834000;2.中国石油新疆油田分公司实验检测研究院,新疆 克拉玛依 834000;3.中国石油集团川庆钻探工程有限公司国际工程公司,四川 成都 610000)
生物表面活性剂是微生物或植物在一定条件下培养时,在代谢过程中分泌的一种具有一定表界面活性、集亲水基和疏水基结构于一分子内部的两亲化合物,如糖脂、多糖脂、脂肽或中性类脂衍生物等[1]。生物表面活性剂无毒,可以生物降解,对环境影响很小,热稳定性和化学稳定性较好,具有高效的表面活性,是合成表面活性剂的理想替代品,受到研究者的广泛关注[2]。生物表面活性剂能增大石油烃类物质在水相中的溶解度,降低表面张力,在石油采收和生物修复环境污染等方面具有巨大的应用潜力[3]。研究和开发生物表面活性剂的应用价值和潜力、优化发酵方法和降低发酵成本、筛选和培育生物表面活性剂高产菌株是当前主要的研究热点和发展方向[4]。
生物表面活性剂的合成方法主要有微生物发酵法、酶合成法、天然生物提取法等[5-6]。其中通过微生物发酵法可以在不同的条件下得到不同类型的生物表面活性剂,在技术和经济上非常适合批量生产[7]。微生物在发酵过程中,使用的菌种一般生长较慢,并且容易出现菌种退化的现象,因此需要通过自然或诱变选育来保持菌种的优良性能,防止菌种退化,同时进一步提高菌种的正突变率[8]。常见的诱变方法有紫外诱变、微波诱变、化学诱变等,由于微生物突变生理生化反应复杂,单一诱变往往难以筛选到优良菌株,因此,多采用复合诱变使菌株发生较大的突变,进而筛选出优良菌株以提高生物表面活性剂的产量[9]。Zouari等[10]从石油污染土壤中筛选出假单胞菌(Pseudomonassp.),该菌株所产生物表面活性剂在高盐度(10%)、高pH值(6~12)、高温(80 ℃)时依然能够保持较高的活性,同时可以降解柴油。张卉等[11]以NTG为诱变剂对出发菌株PseudomonasaeruginosaJZ-5进行诱变处理,以发酵液排油圈直径和生物表面活性剂产量为指标进行复筛,选育出高产且遗传稳定的突变菌株NTG-6,其排油圈直径为6.7 cm,生物表面活性剂产量达到40.83 g·L-1,较出发菌株产量提高了50.84%。门欣等[12]筛选到一株生物表面活性剂产生菌PseudomonasaeruginosaBQ11,在15 W紫外灯下38 cm处诱变60 s后,获得一株正突变率达28%的生物表面活性剂高产菌株UBQ11-4,糖脂产量从5.3 g·L-1提高到6.8 g·L-1,并且突变菌株UBQ11-4所产生物表面活性剂的特性(乳化性能和临界胶束浓度)优于出发菌株。陈利娟等[13]对出发菌株进行常压室温等离子体诱变(ARTP),选育出一株高产突变菌株PseudomonasaeruginosaSC-11,其鼠李糖脂产量比出发菌株提高了74.1%。沈薇等[14]采用紫外诱变和紫外+氯化锂复合诱变对PseudomonasaeruginosaBS-03菌株进行诱变,筛选出一株生物表面活性剂高产菌株LY4,可将鼠李糖脂产量由4.1 g·L-1提高到6.8 g·L-1。
作者以新疆油田油井采出液中分离得到的铜绿假单胞菌(Pseudomonasaeruginosa)FC-69为出发菌株,采用紫外线和亚硝基胍复合诱变的方法对菌株FC-69进行种子和摇瓶发酵培养;以发酵液的排油圈直径和生物表面活性剂产量为考核指标,进一步筛选生物表面活性剂高产菌株,并对其特性进行研究,为丰富生物表面活性剂高产菌种资源和提高生物表面活性剂产量提供数据支持。
1 实验
1.1 菌种与仪器
铜绿假单胞菌(Pseudomonasaeruginosa)FC-69,分离自新疆油田油井采出液中,保存于克拉玛依市新奥达石油技术服务有限公司。
紫外灯(30W/5A),中国四通特种电光源;JA2103N型电子天平,上海民桥精密科学仪器有限公司;LDZM-80KCS-Ⅲ型立式压力蒸汽灭菌锅,上海申安医疗器械厂;DHP-500型电热恒温培养箱,北京永光明医疗仪器有限公司;HC-1014型高速离心机,安徽中科中佳科学仪器有限公司;A101型全自动表面张力仪,美国科诺工业有限公司;BCD-205HK型电冰箱,广东海信容声冰箱有限公司;PHS-3C型pH计,上海雷磁仪器厂;SW-CS-2F型净化工作台,苏州安泰空气技术有限公司。
1.2 培养基
平板(斜面)培养基(g·L-1):葡萄糖3.0,蛋白胨8.0,酵母膏3.0,磷酸二氢钾2.7,氯化钠5.0,琼脂20.0。
种子培养基(g·L-1):牛肉膏2.0,氯化钙0.05,磷酸氢二钾2.0,葡萄糖10.0,硫酸镁0.5,磷酸二氢钾2.0。
发酵培养基(g·L-1):葡萄糖20.0,硝酸铵3.0,磷酸氢二钾1.5,硫酸镁0.1,硫酸铁0.01。
1.3 菌悬液的制备
刮取活化的FC-69菌株,于30 ℃、200 r·min-1摇瓶培养12 h后收集菌液,4 000 r·min-1离心10 min,收集菌体,加入无菌生理盐水,置于漩涡振荡器上振荡20 s使菌体混合均匀,用双层无菌脱脂棉纱布过滤,即得菌悬液,用生理盐水稀释使菌浓为106个·mL-1左右,备用。
1.4 高产菌株的诱变选育
1.4.1 紫外诱变时间的选择[15]
吸取5 mL菌悬液于无菌玻璃平皿,置于30 W紫外灯下15 cm处照射(紫外灯提前预热30 min);每隔一定时间(15 s、30 s、45 s、60 s、75 s、90 s、115 s)吸取照射过的菌悬液,稀释后涂布于平板培养基上,以未经紫外灯照射的菌悬液作为对照,用黑纸包裹后置于30 ℃培养箱中培养48 h;观察平板上的菌落数,按式(1)计算致死率,确定合适的紫外诱变时间。

(1)
取菌悬液,按上述方法紫外诱变合适时间,分别挑取形态、大小、色泽优良的菌落经种子和摇瓶发酵培养后测定排油圈直径;挑选排油圈直径>3 cm的菌落进行液态发酵后再次测定排油圈直径,平行测定3次,取平均值[16]。根据排油圈直径增幅计算正突变率:

(2)
1.4.2 亚硝基胍浓度的选择[17]
将菌悬液按1.4.1方法紫外诱变合适时间,稀释后涂布于含不同浓度(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)亚硝基胍的平板培养基上,以未涂布亚硝基胍的培养基作为对照,置于30 ℃培养箱中培养48 h;观察平板上的菌落数,计算致死率,确定合适的亚硝基胍浓度。
取菌悬液,按上述方法紫外诱变合适时间后涂布在含合适浓度亚硝基胍的平板培养基上,分别挑取形态、大小、色泽优良的菌落经种子和摇瓶发酵培养后测定排油圈直径。
1.4.3 高产菌株的筛选及遗传稳定性实验
取菌悬液,在确定的最佳条件下进行紫外线和亚硝基胍复合诱变,筛选生物表面活性剂高产菌株。将最终筛选的高产菌株进行传代实验,检测生物表面活性剂产量,分析其高产性能的遗传稳定性。
1.5 高产菌株的特性研究
将筛选的高产菌株经一级种子培养成熟后接种至发酵培养基,于30 ℃、200 r·min-1培养4 d,每12 h取样测定菌体密度(OD值)、表面张力、乳化值和生物表面活性剂产量。
采用浊度法测定菌体密度[16];采用表面张力仪测定发酵液的表面张力,平行测定3次,取平均值[18];采用超声体积比法测定乳化值[19];生物表面活性剂产量测定方法:将发酵液pH值调至8.0,6 000 r·min-1离心20 min,上清液用超滤膜过滤,滤液于40 ℃下用旋转蒸发器浓缩至原体积的20%,再将浓缩液pH值调至2.0,于4 ℃下静置12 h,于4 ℃、10 000 r·min-1离心20 min,收集沉淀物(生物表面活性剂粗提物)[11],称重。
2 结果与讨论
2.1 紫外诱变时间的确定
FC-69菌株在紫外诱变不同时间后,稀释涂布于平板培养基上,计算致死率,结果见表1。
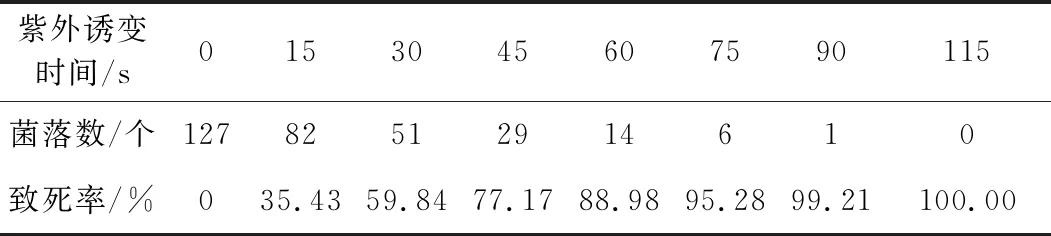
表1 FC-69菌株在紫外诱变不同时间后的致死率
由表1可知,随着紫外诱变时间的延长,菌落数逐渐减少,FC-69菌株的致死率逐渐升高;0~75 s内致死率快速升高,75 s之后致死率升幅趋缓。紫外诱变60 s时,致死率为88.98%;紫外诱变90 s时,仅长出1个菌落,致死率达到99.21%;紫外诱变115 s时,菌株已无法生长。通过前期实验验证,致死率一般在80%左右时正突变率较高,因此,选择紫外诱变时间为60 s。
2.2 紫外诱变排油圈直径测定结果
FC-69菌株紫外诱变60 s后,通过培养共筛选出52个形态、大小、色泽优良的菌落,经过种子和摇瓶发酵培养后测定排油圈直径,结果见表2。
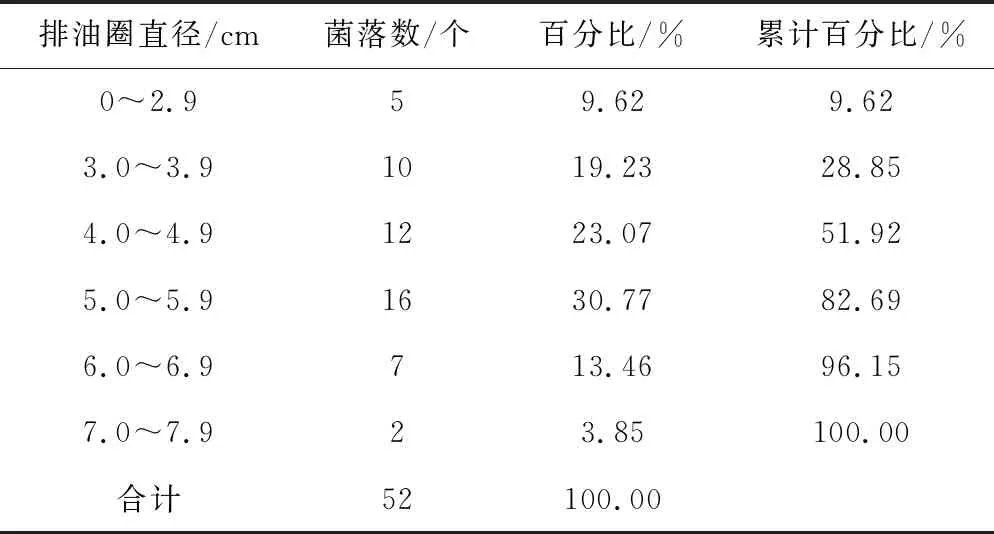
表2 FC-69菌株紫外诱变后的排油圈直径测定结果
由表2可知,FC-69菌株经紫外诱变后,排油圈直径基本呈正态分布。排油圈直径在5.0~5.9 cm的菌落最多,有16个,其次是在4.0~4.9 cm的,有12个;排油圈直径大于3.0 cm的菌落有47个,占菌落总数的90.38%;排油圈直径大于7.0 cm的菌落有2个,占菌落总数的3.85%;排油圈直径大于出发菌株FC-69的有9个,占菌落总数的17.31%,其中最大的达到7.2 cm,较出发菌株提高了16.13%。
2.3 亚硝基胍浓度的确定
FC-69菌株紫外诱变60 s后,稀释涂布于含有不同浓度亚硝基胍的平板培养基上,计算致死率,结果见表3。

表3 FC-69菌株在复合诱变后的致死率
由表3可知,随着亚硝基胍浓度的增加,菌落数逐渐减少,FC-69菌株的致死率逐渐升高;当亚硝基胍浓度为0.5%时,仅长出1个菌落;当亚硝基胍浓度为0.6%时,菌株已不能生长,这也是菌株对亚硝基胍的耐受临界浓度。因此,选择0.4%的亚硝基胍对FC-69菌株进行复合诱变。
2.4 复合诱变排油圈直径测定结果
FC-69菌株紫外诱变60 s后,稀释涂布于含有0.4%亚硝基胍的平板培养基上,通过培养共筛选出55个形态、大小、色泽优良的菌落,经过种子和摇瓶发酵培养后测定排油圈直径,结果见表4。

表4 FC-69菌株复合诱变后的排油圈直径测定结果
由表4可知,FC-69菌株经复合诱变后,排油圈直径在5.0~5.9 cm的菌落最多,有14个;排油圈直径大于7.0 cm的菌落有3个,占菌落总数的5.45%;排油圈直径大于出发菌株FC-69的有10个,占菌落总数的18.18%,其中最大的达到7.35 cm,较出发菌株提高了18.55%。
2.5 高产菌株的遗传稳定性
在紫外诱变时间为60 s、亚硝基胍浓度为0.4%的条件下对FC-69菌株进行复合诱变,挑选6个排油圈直径较大的菌落进行重复验证实验,经过种子和摇瓶发酵培养后测定排油圈直径和生物表面活性剂产量,结果见表5。
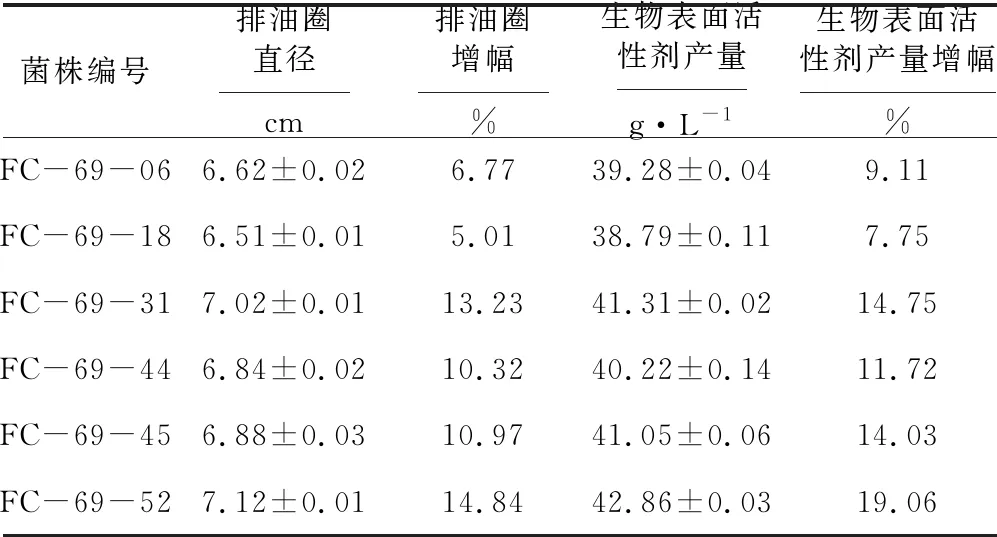
表5 高产菌株的筛选
由表5可知,FC-69-52菌株的排油圈直径达到7.12 cm,生物表面活性剂产量达到42.86 g·L-1,分别较出发菌株FC-69提高了14.84%和19.06%。
对高产菌株FC-69-52进行遗传稳定性实验,结果显示:该菌株在传代1~5代后的生物表面活性剂产量分别为:42.31 g·L-1、41.92 g·L-1、42.56 g·L-1、42.19 g·L-1、42.03 g·L-1,变化不大,说明复合诱变选育的高产菌株遗传稳定性较好。
2.6 高产菌株的特性(图1)
由图1可知,随着发酵时间的延长,发酵液表面张力呈先降低后升高的变化趋势,菌体密度、乳化值、生物表面活性剂产量则呈先升高后降低的变化趋势。发酵0~48 h,较强的疏水性能增加了高产菌株FC-69-52与环境有机物的接触机会,菌体密度显著上升,发酵液表面张力大幅下降,并产生大量的生物表面活性剂;发酵48 h,发酵液表面张力降至最低(27.05 mN·m-1),生物表面活性剂产量达到最高(42.21 g·L-1),乳化值也达到最高(65.68%);发酵60 h后,高产菌株FC-69-52生长进入衰亡期,菌体密度开始缓慢下降,发酵液表面张力维持在30.00 mN·m-1左右,乳化值和生物表面活性剂产量缓慢下降,但整体稳定性良好,说明菌株FC-69-52所产生物表面活性剂对油水界面的亲和力更强,可使乳化相在96 h内保持稳定。

图1 高产菌株FC-69-52的特性
3 结论
以铜绿假单胞菌(Pseudomonasaeruginosa)FC-69为出发菌株,经过紫外线和亚硝基胍复合诱变,筛选得到了一株生物表面活性剂高产菌株FC-69-52,其排油圈直径达到7.12 cm、生物表面活性剂产量达到42.86 g·L-1,分别较出发菌株提高了14.84%和19.06%。该高产菌株发酵48 h,生物表面活性剂产量达到42.21 g·L-1,乳化值达到65.68%,发酵液表面张力降至27.05 mN·m-1,对油水界面的亲和力更强,可使乳化相在96 h内保持稳定,可作为优良高产菌株保存使用。该研究为微生物发酵法产生物表面活性剂的工业化提供了优质菌种资源和发酵工艺指导。

