达沙替尼固体分散体的制备、表征及溶出特性
刘 祺,冯菊红*,张朵朵,陈雅婷,汪 涛,盛余豪,胡学雷
(1.武汉工程大学化工与制药学院,湖北 武汉 430074;2.绿色化工过程教育部重点实验室,湖北 武汉 430074)
达沙替尼(Dasatinib)是美国百时美施贵宝公司研制的一款酪氨酸激酶抑制剂(TKI)[1],商品名为施达赛(SPRYCEL),剂型为片剂,于2006年通过了美国FDA的优先审批,在中国等国陆续上市。在国内由正大天晴公司仿制,商品名为依尼舒[2]。达沙替尼用于治疗慢性髓细胞白血病(CML),体外试验表明,与第一代TKI伊马替尼相比,达沙替尼的作用效果约是其300倍,更重要的是达沙替尼可以与更多突变激酶点结合,因此对于伊马替尼耐药的患者,通常选择达沙替尼进行治疗[3]。
与其它替尼类药物一样,达沙替尼的水溶性较差,原料药在中性环境中的累积溶出度很低[4-5],因此改善达沙替尼的溶解性对于提高人体对其的吸收效率具有重要意义。常见的改善溶解性的方法有微晶化、固体分散技术、包合技术和成盐[6-9]等,其中固体分散技术操作简单、对设备要求不高且效果较好。因此,作者采用溶剂法制备达沙替尼固体分散体(SD),通过考察载体种类、药载比(达沙替尼与载体的质量比)、反应温度和反应时间对累积体外溶出度的影响优化制备工艺,并通过傅立叶变换红外光谱仪(FTIR)、X-射线衍射仪(XRD)、扫描电镜(SEM)对达沙替尼固体分散体进行表征。
1 实验
1.1 试剂与仪器
达沙替尼,乐研试剂(上海)有限公司;羟丙基-β-环糊精(HP-β-CD)、羟丙基-γ-环糊精(HP-γ-CD),武汉格奥化学有限公司;无水甲醇、无水乙醇、丙酮、二氯甲烷、乙酸、乙酸乙酯、异丙醇,国药集团化学试剂有限公司。
RCZ-6B1型溶出仪,上海黄海药检仪器公司;UV2600i型紫外分光光度计,日本岛津公司;Nicolet Nexus 470型傅立叶变换红外光谱仪,美国Nicolet公司;Ultima Ⅳ型X-射线衍射仪,日本理学株式会社;TESCAN MIRA4型扫描电镜,泰思肯贸易(上海)有限公司。
1.2 达沙替尼固体分散体及物理混合物的制备
固体分散体的制备[10]:称取适量达沙替尼与载体(HP-β-CD、HP-γ-CD);将载体溶于20 mL无水甲醇中,按一定药载比加入达沙替尼,加热至设定温度后持续搅拌一段时间;反应结束后除去甲醇并真空干燥2 h,研磨,过80目筛,即得达沙替尼固体分散体。根据载体的不同,分别标记为SD-1(HP-β-CD为载体)、SD-2(HP-γ-CD为载体)。
物理混合物(PM)的制备:称取适量达沙替尼,按一定药载比与载体(HP-β-CD、HP-γ-CD)于研钵中研磨均匀,过80目筛,即得达沙替尼物理混合物。根据载体的不同,分别标记为PM-1(HP-β-CD为载体)、PM-2(HP-γ-CD为载体)。
1.3 体外溶出实验
按照《中华人民共和国药典》2020版第四部通则(0931)溶出度与释放度测定方法(桨法)进行体外溶出实验。称取10 mg达沙替尼,研磨均匀后过80目筛,加入到装有900 mL溶出介质的溶出杯中,于(37.0±0.5) ℃、75 r·min-1下进行体外溶出实验;分别于5 min、10 min、20 min、30 min、45 min、60 min时用注射器抽取3 mL溶出液,并同时补充同温同体积新鲜溶出介质;迅速使用0.45 μm水系抽滤头过滤,测定滤液在322 nm处吸光度,依据线性回归方程计算累积体外溶出度。
2 结果与讨论
2.1 溶剂的选择
按照《中华人民共和国药典》2020版第四部凡例溶解度测定方法,称取100 mg达沙替尼若干份,研磨均匀后过80目筛,分别加入适量溶剂(水、无水甲醇、无水乙醇、乙酸乙酯、二氯甲烷、异丙醇、乙酸、丙酮),于(25±2) ℃下每5 min 振摇溶液30 s,观察其在30 min内的溶解情况。结果发现,达沙替尼不溶于水、无水乙醇、乙酸乙酯,微溶于乙酸、无水甲醇、丙酮、异丙醇、二氯甲烷。综合考虑,选择无水甲醇作为溶剂制备达沙替尼固体分散体。
2.2 检测波长的选择
分别以HP-β-CD和HP-γ-CD为载体,将达沙替尼与载体溶于pH值6.8的磷酸缓冲溶液中,于200~500 nm波长范围内进行紫外光谱扫描。结果显示,达沙替尼在多处有强吸收峰,而位于322 nm处的吸收峰不受2种载体吸收峰的干扰。因此,选择322 nm作为检测波长。
2.3 线性回归方程
称取达沙替尼24 mg,溶于适量无水甲醇中,移至100 mL容量瓶中定容,得到240 μg·mL-1的达沙替尼标准溶液。精确移取0.025 mL、0.150 mL、0.275 mL、0.400 mL、0.525 mL达沙替尼标准溶液分别置于10 mL容量瓶中,用pH值6.8的磷酸缓冲溶液定容,得到浓度分别为0.60 μg·mL-1、3.60 μg·mL-1、6.60 μg·mL-1、9.60 μg·mL-1、12.60 μg·mL-1的达沙替尼溶液,测定溶液在322 nm处的吸光度。以达沙替尼溶液浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得到线性回归方程:A=0.0704c+0.0103,R2=0.9992。表明,达沙替尼在0.60~12.60 μg·mL-1浓度范围内与吸光度呈线性相关。
2.4 方法学验证
精密度测试:配制10.00 μg·mL-1达沙替尼溶液,测定322 nm处吸光度。连续测定6次,吸光度几乎无变化,RSD值为0.19%。表明仪器精密度良好,对测定结果的影响可忽略。
重复性测试:取适量达沙替尼标准溶液,用溶出介质定容,得到6.60 μg·mL-1达沙替尼溶液,取样3份,测定322 nm处吸光度,RSD值为0.53%。表明该方法重复性较好,对测定结果的影响可忽略。
回收率测试:取适量达沙替尼与载体配制成浓度分别为3.60 μg·mL-1、6.60 μg·mL-1、9.60 μg·mL-1的溶液,测定322 nm处吸光度(n=3),计算回收率分别为98.80%、99.65%、99.45%,RSD值分别为0.43%、0.25%、0.12%。表明该方法准确度较好,载体对测定结果的影响可忽略。
2.5 溶出介质的选择
达沙替尼的吸收部位在肠道,为了模拟肠道环境,在3个溶出杯中分别加入900 mL溶出介质(pH值6.8的磷酸缓冲溶液、pH值7.0的二次蒸馏水、pH值7.4的磷酸缓冲溶液);称取3份达沙替尼,每份10 mg,研磨均匀后过80目筛,分别加入到上述3个溶出杯中,按1.3方法进行体外溶出实验,比较累积体外溶出度。结果发现,在3种溶出介质中,达沙替尼的累积体外溶出度几乎没有差异。综合考虑,选择pH值6.8的磷酸缓冲溶液作为溶出介质。
2.6 达沙替尼固体分散体的制备工艺优化
2.6.1 载体种类对累积体外溶出度的影响
药载比为1∶7的达沙替尼固体分散体SD-1、SD-2及达沙替尼物理混合物PM-1、PM-2的累积体外溶出度如图1所示。

图1 载体种类对累积体外溶出度的影响
由图1可知,达沙替尼原料药在溶出介质中的累积体外溶出度仅为11.66%,溶出效果很差;与载体研磨混合后,累积体外溶出度略有提高,PM-1和PM-2分别达到18.92%和16.84%;达沙替尼与不同载体制成固体分散体后,累积体外溶出度显著提高,SD-1和SD-2分别达到59.77%和52.61%。表明,以亲水性的环糊精为载体可以有效提高达沙替尼的累积体外溶出度,且HP-β-CD比HP-γ-CD更有利于提高药物的溶解性,因此,选择HP-β-CD作为载体。
2.6.2 药载比对累积体外溶出度的影响
分别按药载比1∶1、1∶3、1∶5、1∶7、1∶9、1∶11、1∶13称取达沙替尼和HP-β-CD并制备固体分散体,考察药载比对累积体外溶出度的影响,结果如图2所示。

图2 药载比对累积体外溶出度的影响
由图2可知,随着药载比的减小,即载体用量的增加,达沙替尼固体分散体的累积体外溶出度先逐渐升高后略有下降,在药载比为1∶9时达到最高。因此,选择药载比为1∶9。
2.6.3 反应温度对累积体外溶出度的影响
按药载比1∶9称取达沙替尼和HP-β-CD,分别于40 ℃、50 ℃、60 ℃下搅拌30 min制备固体分散体,考察反应温度对累积体外溶出度的影响,结果如图3所示。
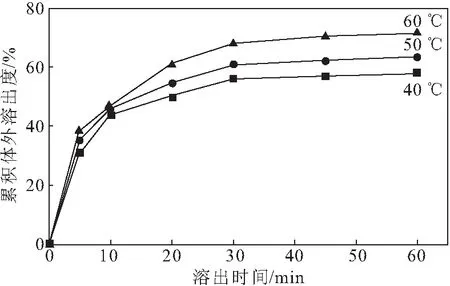
图3 反应温度对累积体外溶出度的影响
由图3可知,随着反应温度的升高,达沙替尼固体分散体的累积体外溶出度逐渐升高。由于无水甲醇的沸点为64 ℃,当反应温度高于60 ℃后会导致溶剂沸腾,因此,选择反应温度为60 ℃。
2.6.4 反应时间对累积体外溶出度的影响
按药载比1∶9称取达沙替尼和HP-β-CD,在60 ℃分别搅拌15 min、30 min、45 min制备固体分散体,考察反应时间对累积体外溶出度的影响,结果如图4所示。
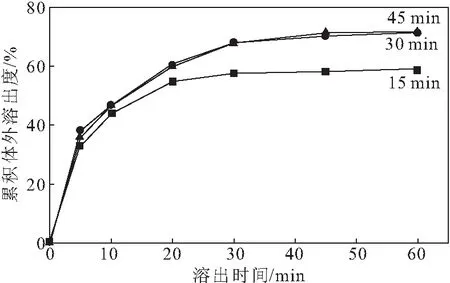
图4 反应时间对累积体外溶出度的影响
由图4可知,当反应时间为15 min时,达沙替尼固体分散体的累积体外溶出度较低;延长反应时间至30 min时,累积体外溶出度升高;继续延长反应时间,累积体外溶出度几乎没有变化。可能是由于,反应时间短于30 min时,达沙替尼或载体未完全溶解。因此,选择反应时间为30 min。
综上,达沙替尼固体分散体的最佳制备工艺为:达沙替尼与载体HP-β-CD的质量比1∶9、反应温度60 ℃、反应时间30 min,在此条件下制备的达沙替尼固体分散体SD-1在溶出介质(pH值6.8的磷酸缓冲溶液)中,60 min时累积体外溶出度可达到71.55%,远高于原料药(11.66%)及达沙替尼与HP-β-CD的物理混合物PM-1(18.92%),表明固体分散体显著改善了达沙替尼的累积体外溶出度。
2.7 达沙替尼固体分散体的表征
2.7.1 FTIR分析(图5)
由图5可知,达沙替尼原料药在1 700~1 000 cm-1范围内有较明显的吸收峰;与HP-β-CD混合制成物理混合物PM-1后,其吸收峰强度明显减弱,整体与HP-β-CD的峰型相似,表现为达沙替尼与HP-β-CD吸收峰的叠加;与HP-β-CD制成固体分散体SD-1后,达沙替尼本身的特征峰已经消失,整体峰形与HP-β-CD的几乎一致,表明制成固体分散体后达沙替尼与HP-β-CD存在新的相互作用力。

图5 达沙替尼原料药、HP-β-CD、PM-1及SD-1的FTIR图谱
2.7.2 XRD分析(图6)
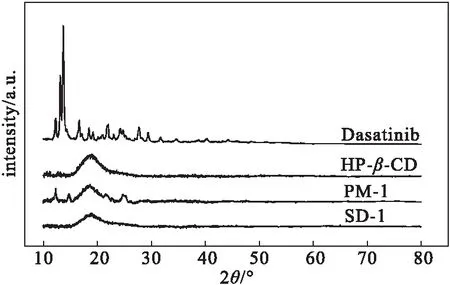
图6 达沙替尼原料药、HP-β-CD、PM-1及SD-1的XRD图谱
由图6可知,达沙替尼原料药在10°~30°范围内存在尖锐的衍射峰;与HP-β-CD混合制成物理混合物PM-1后,尖锐的衍射峰基本消失,峰形与HP-β-CD的相似,仅在12.28°、14.81°、21.52°、22.84°、24.78°处存在微弱的达沙替尼特征峰;与HP-β-CD制成固体分散体SD-1后,这些微弱的达沙替尼特征峰基本完全消失,整体峰形与HP-β-CD的几乎一致,说明制成固体分散体后,达沙替尼以无定形态完全分散于载体中。
2.7.3 SEM分析(图7)
由图7可知,达沙替尼原料药呈片状或柱状的晶体结构;而载体HP-β-CD呈表面有着凹陷或空缺的球状;制成物理混合物PM-1后,达沙替尼附着在HP-β-CD的表面凹陷处且分布不均匀;制成固体分散体SD-1后,失去了达沙替尼和HP-β-CD的原有结构,二者以无定形的方式均匀分散。

图7 达沙替尼原料药(a)、HP-β-CD(b)、PM-1(c)及SD-1(d)的SEM照片
3 结论
采用溶剂法制备了达沙替尼固体分散体。确定最佳制备工艺为:达沙替尼与载体HP-β-CD的质量比1∶9、反应温度60 ℃、反应时间30 min,在此条件下制备的达沙替尼固体分散体的溶出效果最佳,60 min时累积体外溶出度可达到71.55%,远高于达沙替尼原料药(11.66%)及达沙替尼与HP-β-CD的物理混合物(18.92%)。FTIR、XRD和SEM分析表明,达沙替尼原料药在固体分散体中失去了其原有的晶体结构,转变为无定形态高度分散于载体中,且达沙替尼原料药和载体之间不是简单的物理混合而是形成了新的相互作用力。

