急性加重期慢性阻塞性肺疾病患者血清CXCL10和CXCL11水平变化及临床意义
苏睿,张丽艳,高志利,王颖,吴文秀
慢性阻塞性肺疾病是导致全球人类死亡的第三大原因,急性加重期慢性阻塞性肺疾病(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)频繁发作可加快疾病进展,导致病情严重恶化,增加住院治疗次数甚至死亡风险[1]。AECOPD以肺部组织炎性细胞浸润、肺结构改变和重塑为特征,趋化因子通过与受体相互作用激活下游信号通路,趋化单核细胞、中性粒细胞迁移至感染肺组织,并释放炎性细胞因子,诱导或加重慢性阻塞性肺疾病炎性反应[2]。CXC趋化因子配体10(CXC chemokine ligand-10,CXCL10)是导致气道炎性疾病的重要趋化因子,可介导炎性细胞募集,在 COPD 发病过程中起关键作用[3]。CXCL11与CXCL10同属于CXC类趋化因子,在调节适应性免疫方面有独特的功能,与肺组织炎性反应亦存在密切关系[4]。目前CXCL10、CXCL11在AECOPD中的报道尚不多见,其临床意义尚不清楚,鉴于此,本研究拟检测AECOPD患者血清CXCL10、CXCL11水平,分析其与病情及临床结局的关系,报道如下。
1 资料与方法
1.1 临床资料 选择2019年1月—2020年12月沈阳市第五人民医院呼吸内科收治AECOPD患者104例为病例组,其中男56例,女48例,年龄(64.90±7.82)岁;基础疾病:糖尿病60例,高血压66例,高脂血症61例;白细胞计数(12.17±2.14)×109/L,血小板计数(227.77±19.68)×109/L,C反应蛋白(12.92±2.14)mg/L。根据病情严重程度评价标准[5]将患者分为Ⅰ级亚组38例,Ⅱ级亚组42例,Ⅲ级亚组24例;再根据临床结局将AECOPD患者分为病情恶化亚组26例和病情缓解亚组78例。另选择于医院门诊体检志愿者53例为对照组,均排除COPD、支气管扩张、哮喘、肺癌等呼吸系统疾病,其中男30例,女23例,年龄(64.48±8.15)岁;基础疾病:糖尿病10例,高血压8例,高脂血症8例;WBC(8.56±2.16)×109/L,PLT(235.16±25.46)×109/L,CRP(6.26±1.37)mg/L。2组性别、年龄、PLT比较差异无统计学意义(P>0.05),病例组糖尿病、高血压比例、WBC、CRP水平高于对照组(P<0.05)。病情恶化亚组COPD病程、合并休克、机械通气、近1年AECOPD发作次数、mMRC分级3~4级、AECOPD病情严重程度Ⅲ级比例、WBC、CRP水平高于病情缓解亚组(P<0.05),见表1。本研究经医院伦理委员会批准(2018012),受试者及家属均知情同意并签署知情同意书。
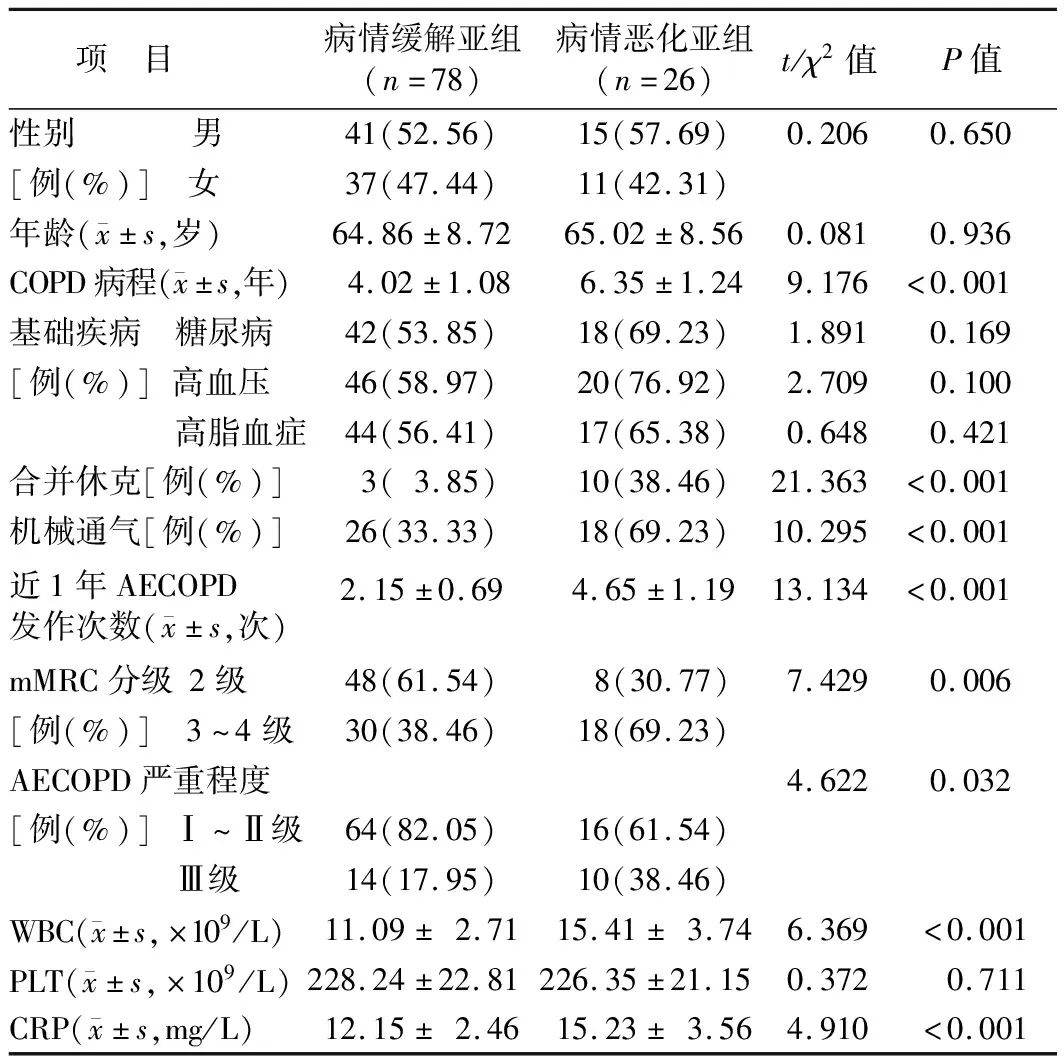
表1 2亚组AECOPD患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①符合“慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)”中AECOPD相关诊断标准[5];②入院时意识清醒,认知功能正常;③配合本研究。(2)排除标准:①肺结核、哮喘、肺癌、肺源性心脏病、肺动脉高压等其他肺部疾病;②合并自身免疫性疾病,心脑血管疾病、其他部位急慢性感染或恶性肿瘤;③临床资料缺失或中途转院无法追踪临床结局。
1.3 观测指标与方法
1.3.1 血清CXCL10、CXCL11水平检测:对照组体检当日、AECOPD患者治疗前采集静脉血5 ml,2 ml离心留取血清-70℃保存待检。应用Vario-skan LUX 多功能酶标仪(美国赛默飞公司)运用比色夹心酶联免疫吸附试验检测血清CXCL10、CXCL11水平。
1.3.2 CRP、WBC、PLT水平检测:上述血液2 ml应用Varioskan LUX 多功能酶标仪运用比色夹心酶联免疫吸附试验检测CRP水平,试剂盒购自美国R&D公司;以ADVIA 2120全自动血细胞分析仪(德国西门子公司)检测WBC、PLT。
1.3.3 肺功能检测:AECOPD患者治疗前采用FGC-A肺功能测试仪(安徽电子科学研究所)检测第1秒用力呼气容积(FEV1),FEV1与用力肺活量(FVC)比值(FEV1/FVC)、FEV1占预计值百分数(FEV1%)。
1.3.4 临床结局:以呼吸困难评分(modified Medical Research Council Dyspnea Scale,mMRC)、动脉血气恢复到发作前水平为病情缓解。以mMRC、动脉血气分析较入院时加重为病情恶化[6]。mMRC:0级,高强度运动出现呼吸困难;1级,平地快步走或爬坡出现呼吸困难;2级,平地行走速度慢或需停下休息;3级,平地走100 m或数分钟需停下来喘气;4级,轻体力活动(如穿衣)即可出现呼吸困难。本研究AECOPD患者无0、1级病例。
2 结 果
2.1 不同AECOPD分级患者血清CXCL10、CXCL11水平比较 血清CXCL10、CXCL11水平比较,Ⅲ级亚组>Ⅱ级亚组>Ⅰ级亚组(P<0.01),见表2。
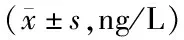
表2 不同AECOPD分级患者血清CXCL10、CXCL11水平比较
2.2 不同临床结局AECOPD患者与对照组血清CXCL10、CXCL11水平比较 血清 CXCL10、CXCL11水平比较,病情恶化亚组>病情缓解亚组>对照组(P<0.05),见表3。
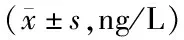
表3 AECOPD 2亚组和对照组血清CXCL10、CXCL11水平比较
2.3 AECOPD不同结局患者肺功能指标比较 病情恶化亚组 FEV1、FEV1/FVC、FEV1%低于病情缓解亚组(P<0.01),见表4。
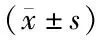
表4 AECOPD不同结局患者肺功能指标比较
2.4 Logistic回归分析影响AECOPD患者临床结局的因素 以AECOPD患者临床结局(0=病情缓解,1=病情恶化)为因变量,COPD病程、近1年AECOPD发作次数、合并休克、机械通气、mMRC分级、AECOPD病情严重程度、FEV1、FEV1/FVC、FEV1%、WBC、CRP、CXCL10、CXCL11为自变量,Logistic回归分析结果显示,近1年AECOPD发作次数高、合并休克及高水平血清CXCL10、CXCL11是AECOPD患者病情恶化的危险因素(P<0.05),见表5。
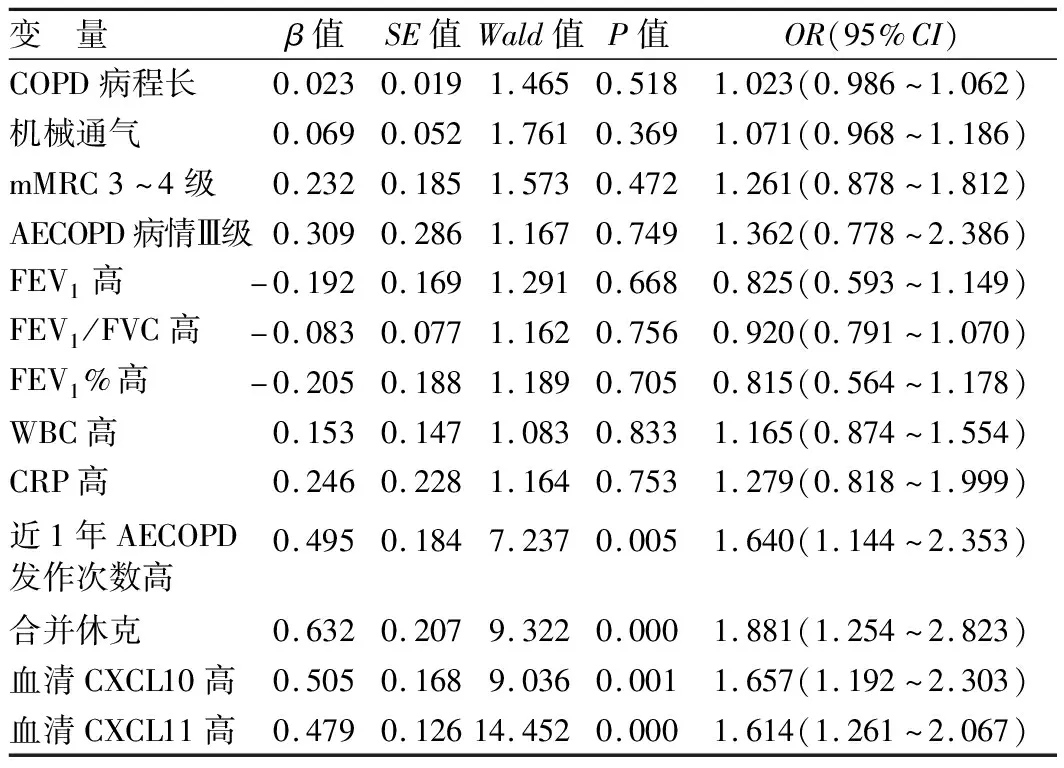
表5 影响AECOPD患者临床结局的多因素Logistic回归分析
2.5 血清CXCL10、CXCL11预测AECOPD患者临床结局的价值 血清CXCL10、CXCL11预测AECOPD患者病情恶化的曲线下面积为0.715、0.680,二者联合为0.938,经Delong test 检验二者联合检测高于单独检测(Z=4.047、4.544,P<0.05),见表6、图1。
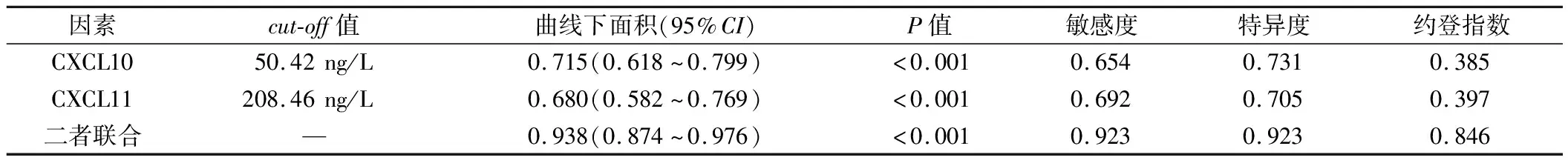
表6 血清CXCL10、CXCL11预测AECOPD患者临床结局的效能
图1 血清CXCL10、CXCL11预测AECOPD患者临床结局的ROC图
3 讨 论
AECOPD多因病毒或细菌感染介导的呼吸道症状急性恶化引起,AECOPD频繁发作可导致肺功能急剧下降,增加死亡风险,虽然慢性阻塞性肺疾病药物治疗取得了一定进展,降低了AECOPD急性发作频率,但是患者预后并没有改善[7]。AECOPD发病机制尚不完全明确,目前研究认为与先天免疫细胞激活介导的慢性炎性反应有关,在各种类型有害颗粒刺激下巨噬细胞、中性粒细胞和嗜酸性粒细胞激活,促使CD4+、CD8+T 细胞和 B 细胞活化并在气道和肺泡中积聚,导致呼吸道和肺组织炎性损伤,支气管周围纤维化和支气管重塑[8]。趋化因子属于细胞因子大家族中的小分子,通过与细胞表面 G 蛋白偶联受体相互作用介导各种细胞过程,具有趋化靶细胞定向迁移,调节白细胞脱颗粒、造血和血管生成等多种作用。香烟烟雾和其他刺激物会激活肺泡巨噬细胞和气道上皮细胞释放趋化因子,趋化因子促使中性粒细胞、嗜酸性粒细胞等迁移至肺组织,参与慢性阻塞性肺疾病稳定状态和急性发作状态[9-12]。
CXCL10属于CXC类非ELR亚族趋化因子,又称为干扰素诱导蛋白,定位人类染色体4q21,主要由γ干扰素诱导中性粒细胞、单核细胞、巨噬细胞、淋巴细胞、内皮细胞和上皮细胞产生,也可在脂多糖和炎性细胞因子诱导下表达上调,主要定向驱使细胞移动,参与感染、自身免疫和肿瘤等多种疾病过程[13-15]。CXCL10主要通过与其特异性受体CXC亚族趋化因子受体3(CXC-chemokine receptor 3,CXCR3)结合发挥趋化作用,CXCR3在活化辅助性T淋巴细胞1、自然杀伤细胞及气道和肺泡上皮细胞上高度表达,CXCL10与CXCR3结合后通过引起钙离子内流,激活磷脂酰肌醇3激酶/p38丝裂原活化蛋白激酶信号通路,参与调控细胞分化、凋亡和炎性反应等生理和病理过程[16]。CXCL10已被证实与脊髓缺血再灌注后异常性疼痛感、幼年特发性关节炎、结直肠癌等存在密切关系[17-18]。本研究结果表明,血清CXCL10水平升高可能加重AECOPD病情进展及不良临床转归发生。分析原因为:AECOPD气道反应刺激下白介素-27表达上调,白介素-27诱导肿瘤坏死因子-α表达,并与肿瘤坏死因子-α协同促使p38丝裂原活化蛋白激酶和Akt磷酸化,上调肺成纤维细胞中CXCL10表达[19]。白介素-27还可通过激活磷脂酰肌醇3-OH激酶Akt信号通路诱导支气管上皮细胞CXCL10表达,CXCL10过表达驱使中性粒细胞、嗜酸性粒细胞迁移和浸润气道上皮细胞、肺泡上皮细胞,加重和扩大炎性反应,导致AECOPD发作和疾病进展。而抑制CXCL10可减轻香烟烟雾提取物诱导的肺组织细胞坏死,减少炎性细胞因子释放,预防慢性阻塞性肺疾病发生[20-21]。
CXCL11与CXCL10同属于干扰素-γ诱导的趋化细胞因子,均定位人类染色体4q21,主要由CD4+T细胞产生干扰素-γ、Toll 样受体配体和肿瘤坏死因子-α 诱导上皮细胞、间质细胞和免疫细胞等产生,参与T细胞活化、迁移和浸润。CXCL11与CXCL10共有受体CXCR3,CXCR3 具有3个剪接变体,分别是CXCR3A、CXCR3B和CXCR3 alt,CXCL10可与CXCR3A和CXCR3B结合,CXCL11不仅与CXCR3A、CXCR3B结合,还可与CXCR3 alt结合,因此CXCL11与CXCR3的亲和力较CXCL10强[22]。现有研究显示,CXCL11在实体瘤中高度表达并控制肿瘤生长、转移和淋巴细胞浸润,血清CXCL11水平升高与慢性丙型肝炎感染患者肝硬化的发生、自身免疫相关肺部炎性反应有关[23-25]。本研究发现,血清CXCL11水平升高与AECOPD病情分级加重和临床转归不良有关。Hao等[26]同样发现,慢性阻塞性肺疾病患者血清CXCL11水平升高,且与气体潴留、支气管壁厚度和肺气肿的程度密切相关。分析CXCL11参与AECOPD可能的机制为:慢性气道炎性反应和急性病原菌感染双重刺激下,IFN-γ诱导CXCL11大量合成,CXCL11与CXCR3结合募集大量CD4+辅助性T淋巴细胞1、CD8+T 淋巴细胞、自然杀伤细胞、单核/巨噬细胞至炎性反应部位,诱导气道炎性反应[25],导致AECOPD发作,持续高水平CXCL11导致气道和肺组织炎性反应扩大,病情进一步恶化,最终引发不良临床结局。
ROC分析结果显示,血清CXCL10、CXCL11均可预测AECOPD患者临床结局,联合2个指标后预测效能提高,回归分析结果显示,近1年AECOPD发作次数高、合并休克与AECOPD临床结局也存在显著相关性,临床应结合AECOPD发作次数,是否合并休克及血清CXCL10、CXCL11水平评估患者临床结局,对于高危患者应给予加强监护,强化治疗,以改善患者预后。
综上,AECOPD患者血清CXCL10、CXCL11水平升高,且血清CXCL10、CXCL11水平随着病情加重而增高。血清CXCL10、CXCL11高水平是AECOPD病情恶化的危险因素,可作为临床结局评估的参考指标。
利益冲突:所有作者声明无利益冲突
作者贡献声明
苏睿:设计研究方案,实施研究过程,论文撰写;张丽艳:实施研究过程,资料搜集整理,论文修改;高志利:进行统计学分析;王颖:课题设计,论文撰写;吴文秀:提出研究思路,分析试验数据,论文审核

