基于活血作用的三七粉质量标志物研究*
李 新,徐 旭,许 浚,郭海彪,李晓霞,林 娟,张铁军**,刘 旻**
(1.天津药物研究院/天津市中药质量标志物重点实验室 天津 300301;2.天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室 天津 300301;3.广州白云山和记黄埔中药有限公司 广州 510515;4.华北理工大学研究生院 唐山 063200)
中药质量是决定其临床安全有效的基础,由于中药具有化学成分复杂、作用机制不清楚等特点,与现代药品质量控制体系的有机结合还存在一定困难,现有中药质量控制模式仍存在诸多问题,难以客观评价和有效控制中药质量。为解决上述问题,2016 年刘昌孝院士提出了中药质量标志物(quality marker,QMarker)这一核心质量概念。该概念关联安全性和有效性,着眼于全过程的物质基础特有、差异、动态变化和质量的传递性、溯源性,并且具有整体、多元质控的特点,对建立中药全过程质量控制及质量溯源体系,规范中药质量研究和标准建立具有很好的引领作用[1-2]。中药的整体质量与化药不同,不是单一成分效果的简单相加;而是由多层次成分、多环节靶点、多维度作用的非线性/线性的协同。因此,首先要对影响中药质量的药效成分群与生物活性的相互作用进行分析,针对中药功效的多靶点进行物质基础研究,明确药效物质群,然后以药效物质群为基础向上下游延伸,更好地建立中药整体质量评价体系[3]。
中药三七是五加科植物三七Panaxnotoginseng(Burk.) F.H.Chen 的干燥根和根茎,产于云南、广西等地区。三七粉是三七洗净,干燥,碾成的细粉,性温,味甘、微苦,归肝、胃经,功效为散瘀止血、消肿定痛,主要用于治疗外伤出血、胸腹刺痛、跌扑肿痛等[4-5]。其主要特点为即有活血作用又有止血作用。《医学衷中参西录》载:“三七,善化瘀血……化瘀血而不伤新血,允为理血妙品。”三七粉活血作用广泛用于治疗各种瘀血证,如冠心病心绞痛、慢性胃炎胃脘痛、崩漏、血痹等病证[6]。从三七粉中分离得到的化学成分主要有皂苷类、黄酮类、糖类、多醇类、聚炔醇类、挥发油类、氨基酸类及有机酸类等,其中皂苷类为三七粉的主要化学成分。以三七总皂苷(Panax Notoginseng Saponins, PNS)为原料药的中药制剂,如血塞通注射液、三七总皂苷胶囊等,已经成为目前中药制剂中年销售额最大的品种之一[7]。
2020 版药典记载三七含量测定以人参皂苷Rg1、人参皂苷Rb1和三七皂苷R1为指标[8]。研究发现三七粉中除人参皂苷Rg1[9]、人参皂苷Rb1[10]和三七皂苷R1[11]具有活血作用外,也有其他成分具有活血作用,如人参皂苷Rg3可延长活化部分凝血活酶时间(Activated Partial Thromboplastin Time, APTT),抑制二磷酸腺苷(Adenosine Diphosphate, ADP)诱导的血小板聚集[12];槲皮素可延长全血凝血时间,具有抗凝作用,对已成型血栓可降低其质量,促进血栓溶解[13]。目前,针对三七粉活血作用的物质基础研究还比较分散,有必要进一步开展系统地研究工作,明确其活血作用的质量标志物。本研究在前期网络药理和入血成分研究基础上,对三七粉中十多种成分的活血作用进行考察,探索三七粉基于活血作用的质量标志物。
1 实验材料
三七总皂苷(PNS):天津药物研究院制备,主要成分为人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1,纯度>70%。三七粉主要成分:人参皂苷Rh1(批号:R26N9F75983)、人参皂苷Re(批号:B04D9S76499)、槲皮素(批号:C09S8Y43412)、人参皂苷F2(批号:Z10A9X58128)、人参皂苷Rg1(批号:G16S10Y97436)、人参皂苷Rg3(批号:Z14J10X90607)、人参皂苷Rd(批号:Z09A9X67397)、人参皂苷Rb2(批号:P15O10F9498 3)、人参皂苷Rb1(批号:P19S10U98130)、人参皂苷Rb3(批 号:P05M10F87444)、人 参 皂 苷Rk1(批 号:B27J8S39859)、三七皂苷R1(批号:G22D9Y77958)、人参皂苷Rg2(批号:M07N10S102243)(批号:R05N10F10 2244)等实验样品,均购自上海源叶生物科技有限公司。
试剂盒:凝血酶时间(Thrombin Time, TT)试剂盒(批号:031906A)、活化部分凝血活酶时间(APTT)试剂盒(批号:021908A)、凝血酶原时间(Prothrombin Time, PT)试剂盒(批号:011901B)、纤维蛋白原(Fibrinogen,FIB)试剂盒(批号:041908B),美德太平洋(天津)生物科技股份有限公司产品。
试剂:二磷酸腺苷(ADP)(批号:SLCB5611)、去氧肾 上腺 素(phenylephrine,PE)(批 号:MTBXK-CP),sigma公司产品。
仪器:凝血因子分析仪(LG-Paker 1),北京普利生仪器有限公司;血小板聚集仪(型号:540VS),美国Chrono-log 公司;JZ301 型微张力换能器,北京新航兴业科贸有限公司;MP-150 多导生理信号记录仪、DA100C 通用放大器,Biopac 公司;HSS-1B 型离体器官恒温装置,成都仪器厂;低温高速离心机,Thermo公司。
动物:家兔,品系为日本大耳白兔,普通级,日龄100-150 日,体质量2.0-2.5 kg,购自北京隆安实验动物养殖中心,生产许可证号:SYXK(京)2019-0009。
2 实验方法
2.1 对凝血指标的影响
凝血机制包括凝血和抗凝两个方面,两者间的动态平衡是正常机体维持体内血液流动状态和防止血液丢失的关键。抗凝机制减弱引起血栓形成是心脑血管发病的重要原因之一。凝血四项包括凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB),是监控凝血系统的重要指标。
实验取健康日本大耳白家兔6只,雄性,适应性喂养7 天后,禁食过夜,颈总动脉取血,3.8%枸橼酸钠抗凝,全血与抗凝剂之比为9:1,3000 rmp 4℃离心10 min制备血浆。将兔血浆分为2 大组,第一大组分为空白对照组、水溶剂对照组和6个剂量的PNS组(蒸馏水溶解,终浓度为0.1、1、10、100、1000、5000 mg·L-1),共8个小组。第二大组分空白对照组、5%DMSO 溶剂对照组和13 个三七化学成分组,即人参皂苷Re 组、人参皂苷Rh1组、槲皮素组、人参皂苷Rg1组、人参皂苷F2组、人参皂苷Rg3组、人参皂苷Rb2组、人参皂苷Rd 组、人参皂苷Rb1组、人参皂苷Rk1组、人参皂苷Rb3组、三七皂苷R1组、人参皂苷Rg2组,每个化学成分组分别再设5个剂量组(每个化学成分样品以5%DMSO溶解,终浓度分别为0.05,0.5,5,50,100μM),共67小组。
在兔血浆中分别加入实验样品,溶剂对照组分别加入等体积蒸馏水或5%DMSO,空白对照组不做任何添加,37℃孵育15 min;采用凝固法,分别测定凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB)。
TT主要反映纤维蛋白原转为纤维蛋白的时间,测定方法:取待测血浆200μL,37℃预温3 min,加入TT试剂200μL,记录凝固时间,即凝血酶时间(TT)。APTT 主要反映内源性凝血系统状况,测定方法:取待测血浆100μL,加入APTT 试剂100μL,37℃孵育5 min,再加入已预温至37℃的氯化钙(CaCl2)溶液100μL,记录凝固时间,即活化部分凝血活酶时间(APTT)。PT 主要反映外源性凝血系统状况,测定方法:取待测血浆100μL,37℃预温3 min,加入已预温至37℃的PT 试剂200μL,记录凝固时间,即凝血酶原时间(TT)。纤维蛋白原(FIB)主要反映纤维蛋白原的含量,测定方法:取不同稀释度定标血浆各200μL,37℃预温3 min,分别加入凝血酶溶液100μL,记录凝固时间,制成标准曲线;待测血浆检测操作同上,FIB 含量根据凝固时间由仪器在标准曲线上自动读出。
2.2 对血小板聚集率的影响
血小板聚集是活化的血小板相互作用聚集成团的特性。当血流产生异常的剪切力时可以诱导血小板活化聚集,进而促发血栓发生发展[14];在创伤发生时,血小板迅速粘附于血管破损处,并聚集成团形成止血栓子,发挥有益的止血作用;在高血压、脂质过氧化物损伤血管内皮时,血小板聚集参与形成动脉粥样硬化,因此,抗血小板治疗成为脑血管病的常规治疗[15]。
实验取健康日本大耳白家兔6只,雄性,适应性喂养7 天后,禁食过夜,颈总动脉取血,3.8%枸橼酸钠抗凝,全血与抗凝剂之比为9:1,1000 rmp 4℃离心10min制备富含血小板血浆(PRP),3000rmp 4℃离心10min制备贫血小板血浆(PPP),以PPP 调PRP,使其血小板计数保持在1.8~2.2×106个/ml。分别取250 μL PRP加入不同比色杯中,分别加入PNS(终浓度为0.1、1、10、100、1000 mg·L-1)和人参皂苷Re、人参皂苷Rh1、槲皮素、人参皂苷Rg1、人参皂苷F2、人参皂苷Rg3、人参皂苷Rb2、人参皂苷Rd、人参皂苷Rb1、人参皂苷Rk1、人参皂苷Rb3、三七皂苷R1、人参皂苷Rg2实验样品,每种实 验样 品设5 个浓 度,分别 为0.05,0.5,5,50,100μM;2 个溶剂对照组分别加入等体积蒸馏水、5%DMSO。
按比浊法测定血小板聚集性,依次取上述比色杯,置于血小板聚集仪待测区37℃温孵10 min。然后置于检测区进行检测:以PPP调100%,PRP调零,在连续自动搅拌下加入诱导剂ADP,终浓度约为6μM,根据血小板聚集后对透光率的变化,仪器自动记录血小板聚集率。
2.3 对血管平滑肌的影响
冠心病或缺血性脑病的一个重要发病原因和危险因素是冠状动脉狭窄或脑血管狭窄。心脑血管狭窄可使经过心脑血管的血流减少,进而造成心肌细胞或脑细胞缺血死亡。常见的导致血管狭窄的病变包括血管壁有动脉硬化的斑块或者血管壁增厚,又或者是血管壁里有夹层,导致血管壁总体变厚,而引起心脑血管变窄。扩张血管是改善心脑供血的主要治疗手段之一。
实验取健康日本大耳白家兔6只,雄性,适应性喂养7 天后,禁食过夜,戊巴比妥钠麻醉,颈总动脉放血后,迅速开胸取胸主动脉,置于预冷生理盐水中剥离血管表面筋膜,用小眼科剪将主动脉剪成若干螺旋条,置于组织灌流系统37oC 恒温水浴槽中,被37oC Krebs-Henseleit 营养液完全浸没,营养液成分包括NaCl 119 mM,KCl 4.7 nM,MgCl21.2 mM,NaH2CO312.0 mM,葡萄糖11 mM,CaCl22.5mM;并给予95%O2及5%CO2饱和混合气体;动脉条下端固定,上端链接张力换能器,由计算机采集张力变化曲线。
营养液中加入去氧肾上腺素,终浓度为0.5 mg·L-1,使动脉条收缩并保持收缩稳定状态后,分别加入人参皂苷Rh1、人参皂苷Re、槲皮素、人参皂苷Rg1、人参皂苷F2、人参皂苷Rg3、人参皂苷Rb1、人参皂苷Rd、人参皂苷Rb3、三七皂苷R1、人参皂苷Rk1、人参皂苷Rg2实验样品,每种样品先以DMSO 储备液溶解,再以蒸馏水稀释,配成3剂量的药液,在营养液中的终浓度分别为1,5,25 μM;溶剂对照组为终浓度0.2%的DMSO;待曲线稳定后,测量加药前后曲线变化值,即张力变化值。正值代表血管收缩,而负值代表血管舒张。
2.4 统计学处理
所有数据均使用GraphPad Prism 5 软件进行统计处理,用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way analysis of variance, one-way ANOVA)Tukey法,P<0.05认为差异有统计学意义。
3 实验结果
3.1 对凝血因子的影响
3.1.1 对TT的影响
水溶剂组与空白对照组比较,对TT的作用无显著差异(P>0.05)。5%DMSO 溶剂组与空白对照组比较,可显著延长TT(P<0.01),结果见图1(A)和(B)。以蒸馏水溶解的PNS 组与水溶剂组比较,在5×103mg·L-1浓度时可显著延长TT(P<0.01),结果见图1(A);以5%DMSO 溶解的单体成分实验药物组与5%DMSO 溶剂对照组进行比较,人参皂苷Rb2在50、100 μM,人参皂苷F2在50 μM,人参皂苷Rb3在100 μM,三七皂苷R1在5.0 μM,人参皂苷Rk1在50、100 μM,人参皂苷Rg2在50、100 μM 时可显著延长TT(P<0.05,),结果见图1(B)。

图1 PNS及各单体成分对TT 的影响。(A)PNS对TT的影响;(B)人参皂苷Rh1、人参皂苷Re、槲皮素等单体对TT的影响。
3.1.2 对APTT的影响
水溶剂组与空白对照组比较,对APTT 的作用无显著差异(P>0.05)。5%DMSO 溶剂组与空白对照组比较,可显著延长APTT(P<0.01),结果见图2(A)和(B)。以蒸馏水溶解的PNS 组与水溶剂组比较,在1×103-5×103mg·L-1浓度时可显著延长APTT(P<0.05),结果见图2(A);以5%DMSO 溶解的单体成分实验药物组与5%DMSO 溶剂对照组进行比较,槲皮素在0.05、0.5 μM,人参皂苷F2在50、100 μM,人参皂苷Rd在100 μM,人参皂苷Rb2在50 μM,人参皂苷Rb1在0.05 μM,人参皂苷Rg2在5.0 μM 时可显著延长APTT(P<0.05),结果见图2(B)。

图2 PNS及各单体成分对APTT的影响。(A)PNS对APTT的影响;(B)人参皂苷Rh1、人参皂苷Re、槲皮素等单体对APTT的影响。
3.1.3 对PT的影响
水溶剂组与空白对照组比较,对PT的作用无显著差异(P>0.05)。5%DMSO 溶剂组与空白对照组比较,对PT 的作用亦无显著差异(P>0.05),结果见图3(A)和(B)。以蒸馏水溶解的三七总皂苷组与水溶剂组比较,在5×103mg·L-1浓度时可显著延长PT 凝固时间(P<0.01),结果见图3(A)。以5%DMSO 溶解的单体成分实验药物组与5%DMSO 溶剂对照组比较,人参皂苷Re 在50μM,槲皮素在5.0μM,人参皂苷F2在0.05、0.5μM,人参皂苷Rb3在5.0μM 时可显著延长PT(P<0.05),结果见图3(B)。
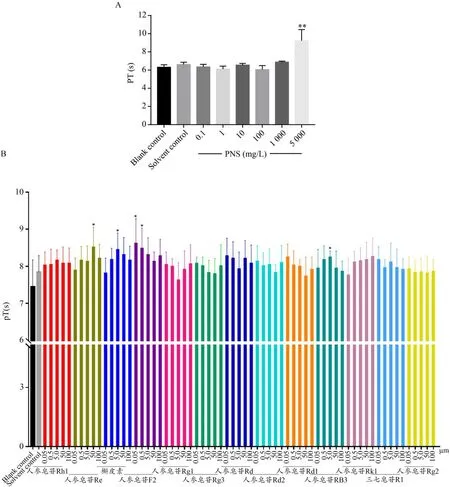
图3 PNS及各单体成分对PT的影响.(A)PNS对PT的影响;(B)人参皂苷Rh1、人参皂苷Re、槲皮素等单体对PT的影响。
3.1.4 对FIB的影响
水溶剂组与空白对照组比较,可显著增加FIB 的含量(P<0.05)。5%DMSO 溶剂组与空白对照组比较,可显著降低体系中FIB 的含量(P<0.01),结果见图4(A)和(B)。以蒸馏水溶解的三七总皂苷组与水溶剂组比较,可不同程度的降低FIB 含量,呈现剂量依赖性,1×103和5×103mg·L-1两个剂量效果显著(P<0.05和P<0.01),结果见图4(A)。以5%DMSO 溶解的单体成分实验药物组与5% DMSO 溶剂对照组比较,槲皮素在0.05 μM,人参皂苷Rg1在0.05 μM,人参皂苷F2在50 μM,人参皂苷Rg3在0.5 μM,人参皂苷Rb1在0.05 μM,人参皂苷Rb2在100 μM,人参皂苷Rb3在50、100 μM,人参皂苷Rg2在100 μM,三七皂苷R1在0.5、5.0 μM 时可显著降低血浆FIB 含量(P<0.05),结果见图4(B)。

图4 PNS和各单体成分对FIB的影响。(A)PNS对FIB的影响;(B)人参皂苷Rh1、人参皂苷Re、槲皮素等单体对FIB的影响。
3.2 对血小板聚集率的影响
观察不同配药溶剂对血小板聚集率的影响,发现水溶剂对照组血小板聚集率(%)为40.08±7.53,5%DMSO 溶剂对照组血小板聚集率(%)为35.00±10.16,两者无显著差异(P>0.05),结果见图5(A)和(B)。以蒸馏水溶解的三七总皂苷组与水溶剂组比较,1×103mg·L-1剂量时显著降低ADP诱导的血小板聚集率(P<0.01),结果见图5(A)。以5%DMSO 溶解的单体成分实验药物组与5% DMSO 溶剂组比较,人参皂苷Rh1在50、100 μM,人参皂苷F2在0.05 μM,人参皂苷Rg1在0.05-50 μM,人参皂苷Rg3在0.05、100 μM,人参皂苷Rd 在50 μM,人参皂苷Rb2在5.0-100 μM,人参皂苷Rb1在50、100 μM,人参皂苷Rg2在50 μM,三七皂苷R1在5.0-100 μM时血小板聚集率显著降低(p<0.05),结果见图5(B)、(C)。

图5 三七总皂苷和各单体成分对ADP诱导家兔血小板聚集的影响。(A)PNS对ADP诱导家兔血小板聚集的影响;(B)和(C)人参皂苷Rh1、人参皂苷Re、槲皮素等单体对ADP诱导家兔血小板聚集的影响。
3.3 对血管平滑肌的影响
与DMSO 溶剂对照组比较,人参皂苷Rh1在5、25μM 时可显著舒张动脉血管条(P<0.05,P<0.01);人参皂苷Rg3在25μM 时可显著舒张动脉血管条(P<0.05);人参皂苷Rd 在1、5、25 μM 时可显著舒张动脉血管条(P<0.05)。人参皂苷Rk1在1、5、25 μM 时可显著舒张动脉血管条(P<0.05,P<0.01);三七皂苷R1在1、25μM 时可显著舒张动脉血管条(P<0.05);人参皂苷Rg2在25 μM 时,可显著舒张动脉血管条(P<0.05),结果见图6。
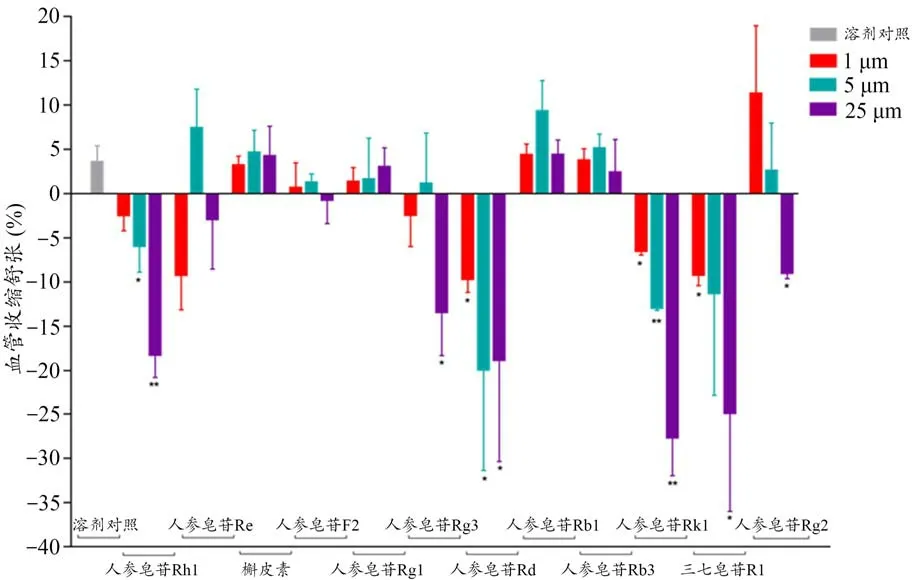
图6 各单体成分对PE诱导离体家兔主动脉环收缩的影响
4 讨论
三七粉活血作用广泛应用于各种血栓性疾病的治疗中。李晨曦等观察活血祛瘀汤(以当归、三七超微粉等为主要成分)与低分子肝素钙联合使用观察对骨盆骨折术后凝血指标的影响,选择气滞血瘀证型的骨盆骨折病例60例,依据随机的原则将病例分为治疗组和对照组各30例,在围术期内所有患者均给予相同的下肢深静脉血栓(DVT)基础预防干预,治疗组在术后加服活血祛瘀汤,分别记录术前、术后1 天、术后1周和2周的凝血指标变化。结果发现活血祛瘀汤与低分子肝素钙联合使用干预骨盆骨折术后患者的凝血状态,能够延长(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT),降低纤维蛋白原(FIB)含量,改善骨盆骨折术后早期凝血功能,联用使用比单独使用低分子肝素抗凝效果更好[16]。
三七粉化学成分类型多样,主要有皂苷类、黄酮类、多糖类、氨基酸类等[17]。皂苷类化合物是三七粉主要的化学成分和有效成分[4]。刘雷等研究发现主要有效成分为三七总皂苷的注射用血栓通能够对凝血酶、二磷酸腺苷(ADP)以及胶原诱导的血小板聚集具有明显的抑制作用,其作用机制可能与抑制血小板机械力离子通道Piezo1蛋白的活化并抑制Ca2+内流相关[14,17]。
三七粉中皂苷类成分可分为原人参二醇型皂苷(protopanaxadiol) 、 原 人 参 三 醇 型 皂 苷(protopanaxatriol)、侧链变化型皂苷及其他类型皂苷。王靖等将123 例患者随机分为脑蛋白水解物组、三七通舒胶囊(主要成分人参三醇皂苷)组、联合用药组,每组41 例,分别给予相应药物,疗程2 周。三七通舒胶囊组双侧脑血流速度中左侧椎动脉(LVA)、左侧椎动脉(RVA)、椎-基底动脉度(BA)升高(P<0.05),血液流变学指标中全血黏度(WBV)、血浆黏度(PV)水平降低(P<0.05),内皮素-1(ET-1)水平降低(P<0.05),降钙素基因相关肽(CGRP)升高(P<0.05),说明三七通舒胶囊能扩张血管,通畅血流,改善血管内皮功能和血液流变学[18]。
除有效部位外,三七粉中的单体成分也有很多研究。陈重华等研究发现三七皂苷R1能显著促进或改善小鼠耳廓的微循环,亦可延长血浆复钙时间[11]。方芳等研究发现三七皂苷R1可抑制AngⅡ诱导的血管平滑肌细胞增殖、迁移,可能是三七皂苷R1预防和治疗动脉粥样硬化及血管再狭窄等血管增生性疾病的作用机制之一[19]。尚不确定三七皂苷R1是否具有直接扩血管作用。蔡婷等研究发现低浓度(40 μmol·L-1)三七皂苷R1可促进血小板衍生生长因子BB(PDGF-BB)诱导血管平滑肌细胞(VSMC)增殖,高浓度(80 μmol·L-1和160 μmol·L-1)三七皂苷R1能抑制VSMC 增殖并诱导VSMC 发生凋亡。未见三七皂苷R1直接抑制血小板聚集的报道。本研究采用体外组织灌流方法发现三七皂苷R1能够直接舒张动脉条,采用体外ADP诱导血小板聚集的方法发现三七皂苷R1具有抗血小板聚集的作用。
研究发现人参皂苷Rd 也能显著促进或改善小鼠耳廓的微循环,延长血浆复钙时间[11],未见人参皂苷Rd 抗血小板聚集的报道。Zhang Baobao 等研究发现口服人参皂苷Rd 能过逆转尼古丁引起的血清一氧化氮(NO)减少和血管紧张素II(AngII)生成增强,HE 染色显示主动脉内皮细胞受到保护[21]。人参皂苷Rd 是否具有直接扩血管作用尚需进一步验证。本研究采用体外组织灌流方法发现人参皂苷Rd 具有直接扩血管的作用,体外血小板聚集实验发现三七皂苷Rd 具有抗血小板聚集的作用。人参皂苷Rb2的研究多集中在抗炎和抗氧化方面。Cho Woo Hyun 等研究发现人参皂苷Rb2能够抑制大鼠呼吸机诱导肺损伤(VILI)产生的炎症和氧化应激反应[22]。未见人参皂苷Rb2抗凝和抗血小板聚集的报道。本研究发现人参皂苷Rb2能够延长TT、APTT,减少FIB含量,抑制血小板聚集。张然等研究发现人参皂苷Rbl可通过保护肝窦内皮细胞,逆转组织因子(TF)、组织型纤维蛋白酶原活化剂抑制物(PAI-1)的高表达及肝窦微环境的高凝及低纤溶状态,有效预防肝窦静脉阻塞综合症(HSOS)的发生[10]。表现出一定的纤溶作用,未见抗凝和抗血小板作用的报道。本研究发现人参皂苷Rb1能够延长APTT,减少FIB含量,抑制血小板聚集。
C.T.Li 等研究发现人参皂苷Rg2均能显著延长活化部分凝血活酶、凝血酶原和凝血酶时间[9]。未见人参皂苷Rg2扩血管作用的报道。本研究通过体外离体实验发现Rg2能够直接舒张家兔动脉血管条。石耀辉研究发现人参皂苷Rb3能明显降低心肌缺血再灌注损伤大鼠血浆前列环素(PGI2)含量,升高血浆PGI2含量及前列环素(PGI2)/血栓素(TXA2)比值(P<0.05 或P<0.01)[23],具有抗血栓作用,但对凝血四项指标的作用尚不明确。本研究发现人参皂苷Rb3可延长TT、PT,减少FIB 含量。周静等研究发现人参皂苷F2可抑制3T3-L1前脂肪细胞增殖分化,可能通过在分化前期调控C/EBPβ 表达并抑制PPARγ、C/EBPα 表达水平而减少脂质积累[24]。刘迪等研究发现人参皂苷F2预处理后能够减少H2O2诱导凋亡细胞的LDH 释放率、升高凋亡细胞的线粒体膜电位、保护线粒体膜免受损伤[25]。未见人参皂苷F2活血作用的报道,本研究发现人参皂苷F2可延长TT、APTT、PT,抗血小板聚集、扩张血管。
本课题通过对三七粉中单体成分的研究新发现:人参皂苷Rb3可延长TT、PT,减少FIB 含量;人参皂苷Rd 可延长APTT,抑制血小板聚集;人参皂苷Rb1能够延长APTT,减少FIB 含量,抑制血小板聚集;人参皂苷Rb2能够延长TT、APTT,减少FIB 含量,抑制血小板聚集;人参皂苷F2能够延长TT、APTT、PT,抗血小板聚集、舒张动脉条;三七皂苷R1能够抗血小板聚集、舒张动脉条;人参皂苷Rg2、人参皂苷Rd 能够舒张动脉条。本研究结果有助于更加系统地了解三七粉活血作用的物质基础。
综上所述,三七粉活血作用表现在抗凝、抗血小板聚集、扩血管等方面,人参皂苷F2、人参皂苷Rg2、人参皂苷Rg3、三七皂苷R1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rb3、人参皂苷Rd、人参皂苷Rg1、槲皮素等可能为三七活血作用的物质基础,可作为潜在的质量标志物。

