藏红花素对急性心肌梗死大鼠心肌组织损伤和细胞凋亡的影响及机制
胡亚丽,庞茜茜,杨杰,刘云宁,刘克勤
(河北北方学院附属第一医院药学部,河北张家口075000)
急性心肌梗死(acute myocardial infarction,AMI)是因冠状动脉阻塞,引起心脏供血不足导致心肌缺血坏死的常见心血管疾病,严重威胁着患者生命健康安全。近年数据显示,AMI 发病逐渐年轻化,及时治疗是挽救生命最重要的手段[1‑2]。研究显示AMI 基本病因为心脏供血不足,缺血心肌持续工作而引起的供氧和需氧失衡,引发体内持续氧化应激过程[3]。中医学认为[4],AMI属于“胸痹”“厥心痛”和“真心痛”等范畴,主要病机为本虚而标实。大量研究显示[5‑6],中药藏红花有效成分藏红花素(crocin)对心血管系统疾病显示出良好疗效,同时兼具抗炎和抗氧化的作用,能够通过抑制机体氧化应激而对AMI 损伤起到一定保护作用,但其减轻心肌梗死和细胞凋亡的机制尚未完全明确。MicroRNA 是广泛参与细胞凋亡、炎症反应和免疫应答的小分子RNA,已有一系列miRNA 分子被证实参与机体心血管发育过程,对心血管慢性炎症疾病发挥调控作用[7‑8]。miR‑146作为第一个被发现的具有免疫调节作用的miRNA,在多项体内外实验中被证实具有減轻炎症和氧化应激的功能[9]。因此,本文通过研究藏红花素对miR‑146a‑5p 表达的影响,以进一步明确miR‑146a‑5p 对AMI 损伤的保护作用,为临床治疗AMI提供理论基础。
1 材料与方法
1.1 动物、试剂与仪器
本研究经动物实验伦理委员会审核通过。
实验动物:SD 大鼠40 只,雌雄各半,体质量(220±20)g,SPF级,购自河北省实验动物中心,生产许可证号:SCXK(冀)2018‑004。
主要试剂:乳酸脱氢酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)和半胱氨酸天冬氡酸蛋白酶3(cysteine aspastic protease 3,Caspase‑3)检测试剂盒均购于南京赛泓瑞生物科技有限公司,批号分别为20201206、20201124、20200312;总RNA 提取试剂盒及反转录试剂盒购自上海瓦兰生物科技有限公司,批号分别为20200308、20200315;miR‑146a‑5p 和引物由上海生工生物工程有限公司合成;miR‑146a‑5p inhibitor 均由上海吉玛基因公司合成;SsoFastTMEva‑Green Su‑permix 试剂盒购自Bio‑Rad 公司,1864034;GAPDH鼠单克隆抗体购自Abcam 公司,批号:ab181602;Cleaved Caspase‑3 和Caspase‑3 单克隆抗体购于上海联迈生物工程有限公司,批号分别为ab52072、ab13847;辣根过氧化 酶(horseradish peroxidase,HRP)标记兔抗鼠二抗,购自北京中杉金桥生物技术公司,批号:ZB2305;藏红花素由上海玉博生物科技有限公司提供;盐酸右美托咪定(Dexmedeto‑midine,Dex)注射液购自宜昌人福药业有限责任公司,批号:20200618;三苯基氯化四氮唑(2,3,5‑Tri‑phenyltetrazolium Chloride,TTC)染色液购自无锡云萃生物科技有限公司,批号:20200524;TUNEL染色服务由晶莱生物提供,批号:20201104;H9c2大鼠心肌细胞购自深圳市豪地华拓生物科技有限公司;DMEM 培养基、胎牛血清(fetal bovine serum,FBS)购自上海吉至生化科技有限公司,批号分别为20210308、20201216。
主要仪器和设备:ALC‑V8D型动物呼吸机购自上海alcbio 公司;福田心电图机、Bio‑Rad 多功能酶标检测仪(型号iMark680)、OLYMPUS 光学显微镜(型号BX60)、Philips iU22 高频线阵探头超声诊断仪(型号L12‑5)、CO2培养箱均购自Thermo Fisher Scientific公司;实时荧光定量PCR(real‑time fluores‑cence quantification PCR,qRT‑PCR)仪购自Bio‑Rad公司;FACS Calibur 流式细胞仪购自美国Becton‑DickinSon公司。
1.2 动物分组及造模
将40 只大鼠随机分为假手术(Sham)组、AMI组、AMI+crocin 和Dex组,每组各10只。饲养在25 ℃,50%湿度、12 h光/暗交替的环境中自由饮食,7 d适应环境。
通过结扎左冠状动脉前降支(left anterior descendingcoronaryartery, LAD)制备AMI 大鼠模型[10]。AMI 组、AMI+crocin 组和Dex 组大鼠通过腹腔注射10%(φ)水合氯醛(300 mg/kg)麻醉,麻醉成功后仰卧固定至手术板上,75%(φ)乙醇消毒颈部皮肤,切开气管进行气管插管,连接呼吸机。术区使用碘酒消毒,以左胸第三肋间为手术切口,打开胸腔。使用无齿镊轻提心包膜并剪开,距离冠脉2~3 mm处使用缝合针结扎左冠脉前降支,关胸,待大鼠苏醒恢复自主呼吸后撤下呼吸机并缝合气管切口。
麻醉复苏2 h后,AMI+crocin组和Dex组大鼠分别灌胃crocin(40 mg/kg)[11]和Dex(20 μg/kg)[12],AMI组和Sham 组大鼠腹腔注射等体积生理盐水,连续注射5 d。
1.3 标本采集
末次干预后,0.4%戊巴比妥钠深度麻醉后开胸取心脏,横断切片,进行TTC 染色,采用Image‑pro Plus 软件计算心肌梗死面积,剩余心肌组织一部分采用4%(φ)多聚甲醛固定24 h,之后进行脱水、浸蜡、包埋、切片等步骤;另一部分加入细胞裂解液,将标本充分研成匀浆,3 000 r/min 离心10 min,收集上清液,得到心肌组织匀浆,冷冻待用。
1.4 细胞培养及处理
将大鼠H9c2 心肌细胞培养于含100 mL/L FBS的高糖DMEM 培养基,设置培养箱为37 ℃,5%(φ)CO2。将细胞随机分为对照组(control)、缺氧组(hypoxia)、hypoxia+crocin组、hypoxia+crocin+inhib‑itor 组、Dex 组、inhibitor 组(inhibitor 是一段能与成熟mir‑146a‑5p 互补结合并抑制mir‑146a 活性的寡聚核苷酸)和inhibitor‑NC 组,除control组、inhib‑itor 组 和inhibitor‑NC 组 外,其 他 细 胞 均加入高氮气饱和的缺氧液培养4 h[13],分别向hypoxia+crocin组、hypoxia+crocin+inhibitor 组和Dex 组细胞加入10 μmol/L crocin、10 μmol/L crocin+inhibitor 和10 nmol/L Dex 进行孵育,control 组和hypoxia 组加入等量PBS缓冲液,培养24 h。
按照Lipofectamin2000 转染试剂说明书分别制备miR‑146a‑5p 空白质粒和miR‑146a‑5p 的miRNA/Lipofectamin 阳性复合物,分别对inhibitor‑NC 组和inhibitor组细胞进行转染,转染48 h后向inhibitor‑NC组和inhibitor组细胞中加入10 nmol/L inhibitor,培养24 h[14]。将各组细胞一部分离心(1 000 r/min,5 min)获取心肌细胞,另一部分制作细胞爬片,40 g/L多聚甲醛固定。
1.5 观测指标
1.5.1 高频线阵探头经胸超声心动图评价左心室功能建立AMI 模型4 周后进行心脏超声检查,M‑型扫描连续3 个心动周期,获得胸骨旁长轴切面的M型记录,计算心脏左室射血分数(left ventricular ejection fraction,LVEF)和左室缩短分数(left ventricular fractional shortening,LVFS)。
1.5.2 TUNEL染色检测大鼠心肌细胞凋亡取大鼠心肌组织切片及细胞爬片,按照TUNEL染色一般操作步骤操作,光镜下计数总细胞数和阳性细胞数即凋亡细胞数,采用TUNEL末端标记法计算细胞凋亡率。
1.5.3 酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测大鼠心肌组织及心肌细胞氧化应激水平取大鼠心肌组织匀浆及心肌细胞上清液,采用ELISA 法测定心肌组织LDH、CK 和Caspase‑3活性及心肌细胞上清液CK、LDH 活性,所有操作严格按试剂盒说明书进行。
1.5.4 qRT‑PCR 检测大鼠体内及体外miR‑146a‑5p表达取大鼠心肌组织匀浆和心肌细胞,加入Trizol提取总RNA,逆转录为cDNA,以cDNA 为模板,按PCR 扩增试剂盒说明进行PCR 扩增。PCR 反应体系:引物序列为5′‑ACUUUAAGGCUGAGAAGUU‑CUCA 和3′‑UUGGGUACCUUAAGUCAAGAGU,反应总体积20 μL,95 ℃预变性10 min,95 ℃变性15 s、60 ℃退火1 min,共40 个循环。使用SsoFastTMEva‑Green Supermix 试剂盒检测各组miR‑146a‑5p表达,以葡萄糖3‑磷酸甘油醛脱氢酶(glyceralde‑hyde phosphate dehydrogenase, GAPDH)为内参,重复实验3次,取平均值,结果采用2 法进行计算。
1.5.5 Western blot 检测大鼠心肌细胞Cleaved cas‑pase‑3 及caspase‑3 表达取心肌细胞上清液,加入RIPA 裂解液提取总蛋白,用Beyotime 细胞质蛋白提取试剂盒提取细胞质蛋白,Beyotime 核蛋白提取试剂盒获得核蛋白,将蛋白质进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS‑PAGE)分离,分离后蛋白电子转移到聚偏二氟乙烯(PVDF)膜(Millipore)上。将膜与封闭缓冲液孵育,洗涤,加入一抗Cleaved caspase‑3(1∶2 000)和caspase‑3(1∶2 000),4 ℃孵育过夜。洗膜,使用HRP 偶联的二抗(1∶5 000)孵育膜,室温孵育2 h,洗膜,电化学发光显像,以GAPDH 作为内参,采用凝胶图像分析系统对比条带强弱。
1.5.6 流式细胞术检测心肌细胞凋亡将对照管上样,调整FACS Calibur 流式细胞仪测定参数FAS 和SSC,在散色光点图中显示出清晰的细胞群体图。根据FAS/SSC 特点设定电压和放大器数值,以门中细胞进行设门,已门中细胞进行后续荧光信号检测,将散点图中细胞集中在左下象限,采用CellQest软件分析,数据以List Mode形式储存。
1.6 统计学分析
采用SPSS 21.0 软件对所得数据进行分析,满足正态分布的计量资料均以x±s表示,采用单因素方差分析比较多组间差异性,SNK-q比较多组两两间差异,P<0.05为差异有统计学意义。
2 结果
2.1 藏红花素对AMI大鼠心肌梗死大小的影响
TTC 染色结果显示,急性心梗死区呈黄色,具备活力的心肌组织被染成红色。与Sham 组对比,AMI 组大鼠心肌梗死面积明显增大,其心肌梗死面积明显大于AMI+crocin组和Dex组。见图1。
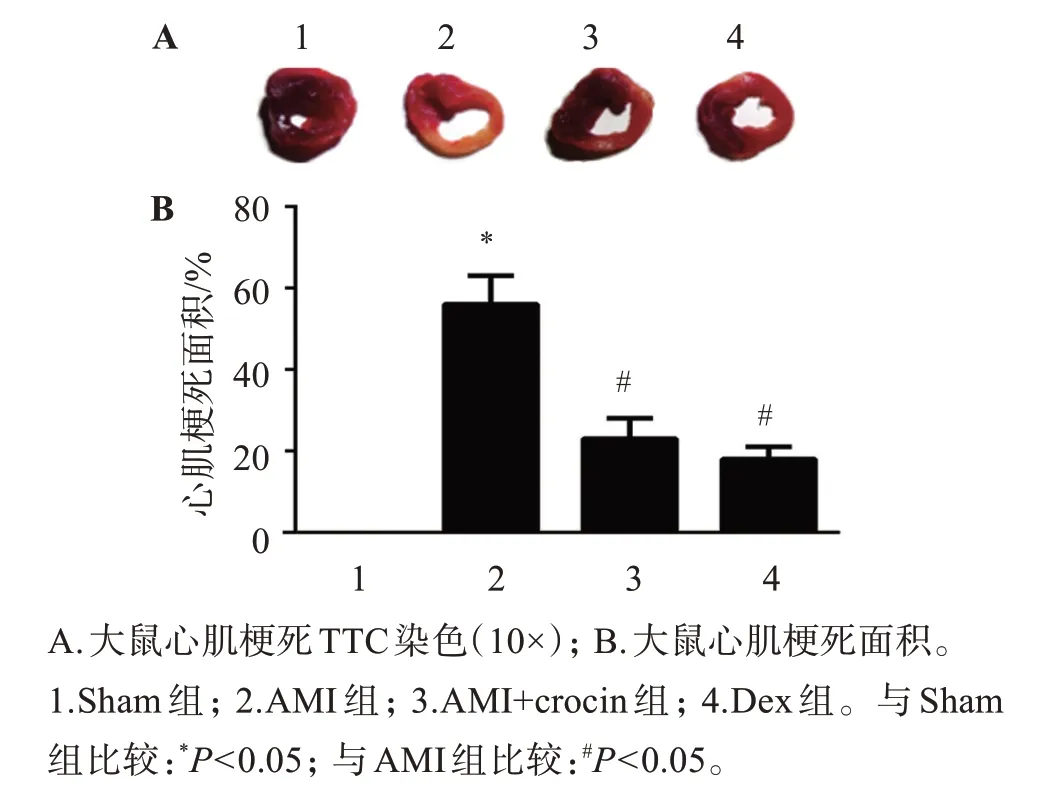
图1 藏红花素对AMI大鼠心肌梗死面积的影响(TTC染色)Figure 1 Effect of crocin on the area of myocardial infarction
2.2 藏红花素对AMI大鼠心脏功能障碍的影响
超声心动图显示,Sham组大鼠心肌梗死区左室心肌薄厚度正常,收缩舒张运动正常;AMI 组大鼠心室壁变薄,部分向外扩张,呈室壁瘤样病变,心室舒缩行为异常;AMI+crocin 组和Dex 组大鼠心肌组织较薄,心肌舒缩无严重异常行为。与Sham 组相比,AMI 组大鼠LVEF 和LVFS 明显下降(P<0.05)。与AMI 组相比,AMI+crocin 组和Dex 组大鼠心脏LVEF及LVFS均明显上升(P<0.05)。见图2。
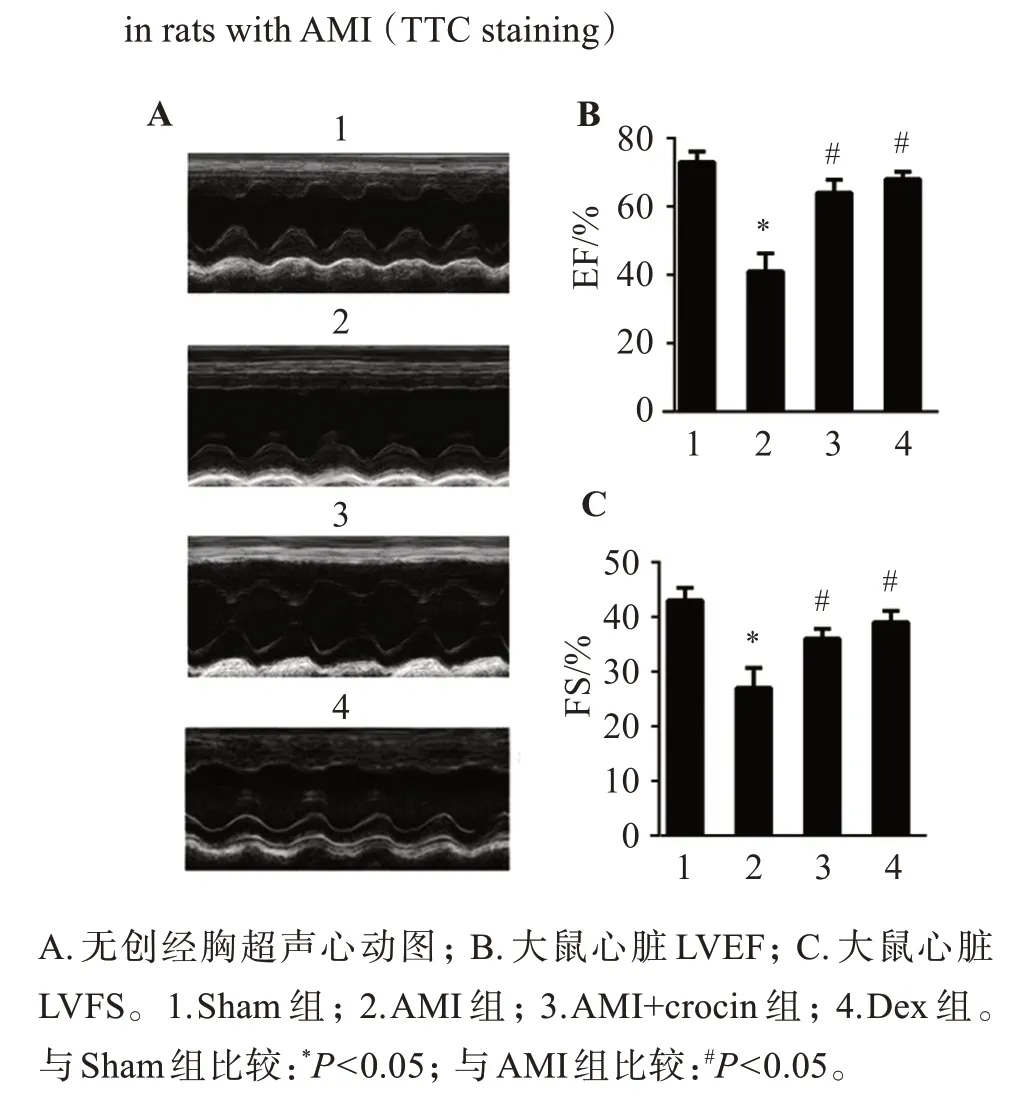
图2 藏红花素对AMI大鼠心脏功能障碍的影响Figure 2 Effect of crocin on cardiac dysfunction in AMI rats
2.3 藏红花素对AMI大鼠心肌组织凋亡的影响
Sham 组大鼠心肌组织细胞凋亡率约(3.18±0.27)%,与Sham 组相比,AMI 组大鼠心肌组织细胞凋亡率约(37.25±5.02)%,明显升高(P<0.05);与AMI 组相比,AMI+crocin 组大鼠心肌组织细胞凋亡率约为(20.64±1.88)%,Dex 组大鼠心肌组织细胞凋亡率约(19.27±1.93)%,均明显降低(P<0.05);AMI+crocin 组和Dex 组大鼠心肌组织细胞凋亡率无明显差异(P>0.05)。与Sham 组相比,AMI 组大鼠CK、LDH 和Caspase‑3 水平明显升高(P<0.05);与AMI组相比,AMI+crocin 组和DEX 组大鼠CK、LDH 和Caspase‑3 水平明显下降(P<0.05);与AMI+crocin组大鼠相比,DEX 组大鼠上述指标无明显差异(P>0.05)。见图3。
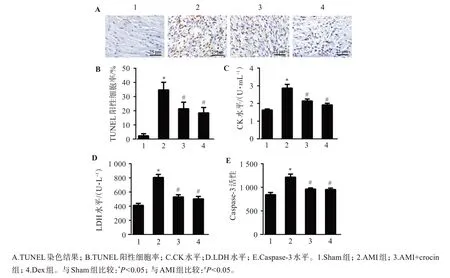
图3 藏红花素对AMI大鼠心肌凋亡的影响(TUNEL染色,200×)Figure 3 Effect of crocin on myocardial apoptosis in AMI rats
2.4 藏红花素对miR‑146a‑5p表达的影响
与Sham 组相比,AMI 组大鼠相对miR‑146a‑5p表达明显降低(P<0.05);与AMI组相比,AMI+crocin组和Dex组大鼠miR‑146a‑5p相对表达水平明显上升(P<0.05)。与control 组相比,hypoxia 组和inhibitor组细胞相对miR‑146a‑5p 表达明显降低(P<0.05);与hypoxia 组相比,hypoxia+crocin 组和Dex 组细胞miR‑146a‑5p 相对表达水平明显上升(P<0.05)。见图4。

图4 藏红花素对miR‑146a‑5p表达的影响Figure 4 Effect of crocin on miR‑146a‑5p expression
2.5 藏红花素通过上调miR‑146a‑5p 对心肌细胞凋亡和损伤标志物的影响
与control组相比,hypoxia组细胞凋亡率、Cleaved caspase‑3表达、LDH和CK水平明显上升(P<0.05);与hypoxia 组相比,hypoxia+crocin 组和Dex 组细胞凋亡率、Cleaved caspase‑3 表达、LDH 和CK 水平明显下降(P<0.05);与hypoxia+crocin 组细胞相比,hypoxia+crocin+inhibitor 组细胞凋亡率、Cleaved caspase‑3表达、LDH和CK水平明显上升(P<0.05)。见图5。

图5 藏红花素通过上调miR‑140‑3p对心肌细胞凋亡和损伤标志物的影响Figure 5 Effects of crocin on myocardial cell apoptosis and injury markers by up‑regulating miR‑140‑3p
3 讨论
氧化应激和炎性反应在AMI 发生发展中起到重要作用。既往研究表明[15],miR‑146a‑5p 在动物心肌组织中具备调控炎症和氧化应激水平的作用,因此本研究通过研究藏红花素对miR‑146a‑5p 的调控作用,进一步明确藏红花素减轻心肌梗死和细胞凋亡的作用机制。
本研究结果显示,AMI 组大鼠心肌梗死面积明显增大,LVEF 和LVFS 明显下降,心肌细胞凋亡率增加;经crocin 干预后,各指标均明显改善,说明藏红花素可以提高心肌功能,改善冠脉微循环,修复AMI 引起的心肌损伤。LVEF 及LVFS 是评价心脏功能的常用超声指标,其水平升高表明藏红花素可以提高心脏泵血能力,改善AMI 大鼠心功能,抑制心肌细胞凋亡。分析原因,可能是crocin 抑制了心肌组织细胞的异常凋亡,心肌细胞数量维持在正常水平,冠脉微循环得以改善,心脏供血能力提高,有利于减少梗死部位面积。AMI+crocin 组和Dex 组大鼠上述结果无明显差异可以进一步表明藏红花素具备改善心功能的作用。
本研究结果显示,模型大鼠和细胞中CK、LDH和Caspase‑3 水平明显高于正常大鼠,经crocin 干预后,其CK、LDH 和Caspase‑3 水平明显下降。CK 广泛分布于心肌细胞质和线粒体中,与细胞能量转运和肌肉收缩有关,其活性测定已被应用于心肌疾病的诊断中[16]。LDH 是糖无氧酵解及糖异生的重要酶系之一,AMI发生时,血清LDH活性明显升高,是用以反映心肌疾病的重要指标[17]。使用藏红花素干预后,CK和LDH水平下降,说明心肌线粒体功能得以恢复,线粒体是细胞有氧呼吸的最重要场所,也是心肌细胞最重要的细胞器,但线粒体受氧自由基影响明显,当心肌细胞缺血时,其结构与功能受损是导致心肌细胞凋亡及AMI损伤加重的直接原因,藏红花素干预使线粒体功能正常运转,提高氧利用能力,避免乳酸堆积对受损心肌细胞的进一步损害。Caspase‑3 在细胞凋亡过程中具有不可替代的地位,正常情况下,Caspase‑3以procaspase的形式存在体内,当受到刺激后,Caspase‑3被多种因素活化,活化后的Caspase‑3 快速参与细胞凋亡过程。Western blot 检测结果显示,hypoxia 组Cleaved caspase‑3 表达明显上升,hypoxia+crocin 组和Dex 组Cleaved caspase‑3表达明显下降,hypoxia+crocin+inhibitor组细胞Cleaved caspase‑3 表达较hypoxia+crocin 组明显上升。说明藏红花素能够抑制Caspase‑3 活化过程,使其不能介导心肌细胞凋亡,维持心肌正常细胞数量,从而改善因缺血缺氧而导致的心肌细胞功能受损和异常凋亡。
既往研究证明[18‑19],miR‑146a‑5p 参与介导机体多种炎症和氧化应激反应,推测藏红花素可能通过影响miR‑146a‑5p 水平,直接或间接减轻心肌梗死和心肌细胞凋亡。本研究结果显示,AMI 组大鼠和hypoxia 组细胞相对miR‑146a‑5p 表达明显降低,与AMI 组相比,AMI+crocin 组和Dex 组大鼠miR‑146a‑5p相对表达水平明显上升;与hypoxia组相比,hypoxia+crocin组和Dex组细胞miR‑146a‑5p相对表达水平明显上升。研究结果直接说明藏红花素对miR‑146a‑5p 表达具有调控作用,miR‑146a‑5p 过表达会使得血清及细胞中CK 和LDH 活性升高,细胞线粒体受损,造成心肌细胞进一步缺氧。同时其介导caspase‑3 活化以促进心肌细胞凋亡。藏红花素下调miR‑146a‑5p 表达,减轻机体氧化应激水平,减少心肌细胞凋亡,恢复冠状动脉微循环,改善心肌细胞缺氧缺血环境,减轻AMI损伤。
综上所述,藏红花素对AMI所致的心肌损伤具有改善作用,其机制可能是通过上调miR‑146a‑5p水平以减少心肌细胞凋亡,从而有助于受损心肌细胞维持较高供血及供氧水平,以减轻AMI症状。

