高压氧对热射病大鼠内皮功能的保护机制研究
项 威,段李明,及志勇
(吉林大学第一医院 二部急救医学科,吉林 长春130031)
热射病(HS)为致命性中暑,是一种危及生命的疾病,死亡率可达10%-50%[1]。目前,该病仍缺乏特定及有效的治疗方法。近几年我科收治了多名热射病患者,不仅病情危重,危及生命,而且治疗时间长,花费高,给患者及家属带来诸多负担。相关研究表明[2],一氧化氮(NO)和内皮素-1(ET-1)参与血管内皮系统的功能,并维持其稳态。NO能够抑制缩血管物质的活性,从而抑制血管收缩,ET-1的升高及NO的下降均提示血管内皮的损伤。高压氧抑制炎症介质释放,从而抑制炎症介质所介导的血管内皮损伤,降低ET-1水平,升高NO含量。本研究探讨热射病大鼠在高压氧治疗前后血液中NO和ET-1含量的变化情况,探讨高压氧对热射病大鼠内皮细胞的保护作用。
1 材料与方法
1.1 实验动物
30只健康雄性SD大鼠,10-12周龄,体重约180-200 g,实验大鼠均来自吉林大学动物实验中心。个体间体温基本一致,两次肛温波动<3℃,所有大鼠在适宜的温度、湿度下饲养1周后,接受power lab系统无创血压测试,并进行肛温、体重测量以确定生理状态的稳定。
1.2 实验分组
所有大鼠随机均分为3组,每组10只,即NC组、HBO组和HS组,分笼饲养。①NC组:不做任何处理。②HBO组:在大鼠热射病模型建立后进行高压氧治疗。③HS组:仅进行热射病处理,不进行高压氧治疗。在同一时间抽血测定,将三组结果进行对比。
1.3 建模及处理方法
所有大鼠置于温度(26±0.5)℃、相对湿度(40±5)%的仿真热气候动物舱中培养,每日照明时间为7:00-19:00,每隔8 h进行体重、肛温测量。HS大鼠模型的建立:将大鼠置于温度(37.5±0.5)℃、相对湿度(60+5)%的仿真热气候动物舱中加热,肛温达到42.5℃认为建模成功[3],结束应激,检测体重,记录相关数据。
1.4 高压氧治疗方法
高压氧组大鼠制成HS模型后,立即放入鼠笼,将鼠笼放入HBO舱后关闭舱门,先用纯氧以0.05 MPa(表压)的压力洗舱3次。然后用时15 min将舱内治疗压力迅速升至0.15 MPa,且舱内氧浓度大于99.5%,维持恒定的舱内压力共40 min。最后等速减压,时间不少于15 min,舱内压力为0 MPa(表压)后打开舱门取出大鼠。大鼠在热暴露下的反应符合相应组别的行为特征。
1.5 血液生化指标检测方法
严格按照实验设计采集血液标本:将大鼠麻醉后,取左侧颈外静脉血2-3 ml,4℃冰箱内保存,3 000 r/min,离心10 min取血清,ELISA法检测大鼠血清NO及ET-1含量,并记录数据。
1.6 统计学分析

2 结果
2.1 各组大鼠中血清NO含量比较
热射病模型制备后,大鼠血清NO水平显著降低,HS组和HBO组NO含量明显低于NC组,差异有统计学意义(P<0.0001);高压氧治疗后HBO组血清NO水平升高,与HS组比较,差异有统计学意义(P<0.0001);但是未能恢复到正常水平,与NC组差异有统计学意义(P<0.0001)。见图1。
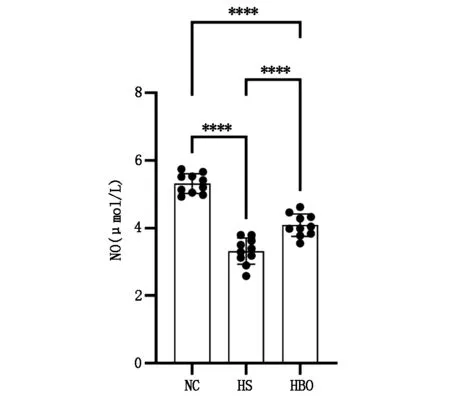
图1 各组大鼠血清中NO浓度测定结果
2.2 各组大鼠中血清ET-1含量比较
同时测定大鼠血清ET-1水平,HS组明显升高,且显著高于NC组,差异有统计学意义(P<0.0001);在进行高压氧治疗后,HBO组血清ET-1水平有所下降,与HS组比较差异有统计学意义(P<0.0001);但同样未能恢复至正常水平,与NC组对比差异同样有统计学意义(P<0.0001)。见图2。
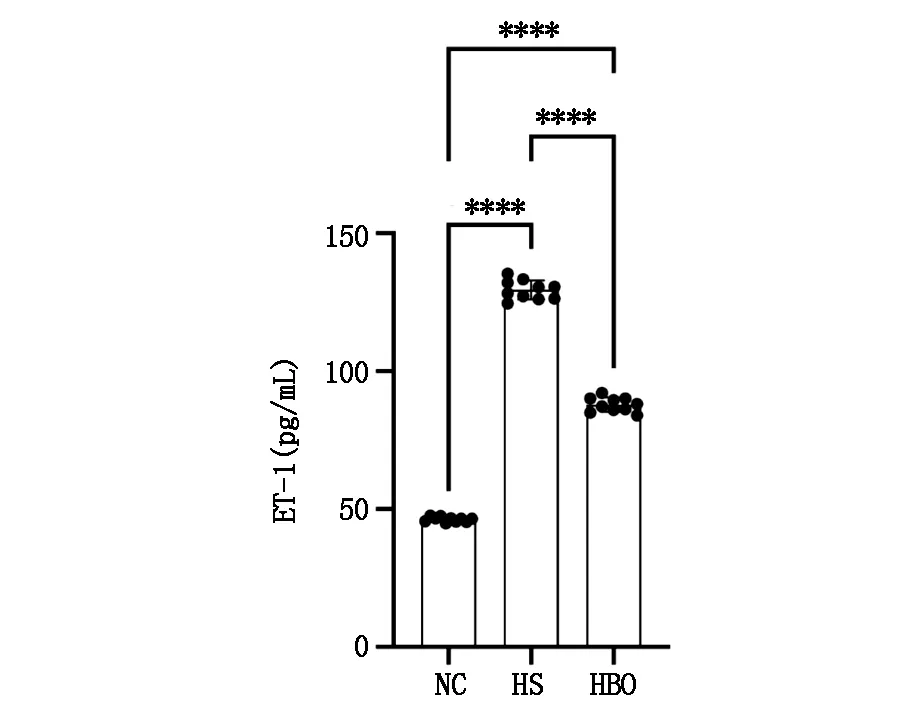
图2 各组大鼠血清中ET-1浓度测定结果
3 讨论
热射病是一种全身性疾病,是由高温引发的一系列全身反应,具有复杂的病理生理过程,主要包括全身炎症反应、内皮细胞损伤与凝血功能紊乱,三者相互影响,最终可导致多器官功能衰竭[4]。
内皮细胞通过合成和分泌多种细胞因子维持血管稳态和功能[5]。高热可导致内皮细胞分泌活性物质异常,进一步使血管内皮细胞受损或程序性死亡,从而破坏血管内皮的完整性,血管内皮结构被破坏后,血管的通透性增加,舒缩张力改变,刺激中性粒细胞等分泌炎性因子导致炎症反应增加、细胞黏附性增强、凝血功能异常、微循环障碍和器官缺血性功能障碍等,因此,血管内皮功能障碍是热射病的重要病理生理过程[6]。内皮细胞分泌的NO和ET-1通常作为评价血管内皮功能的指标。NO是重要的内皮源性释放因子,具有抑制炎症反应、氧化应激、细胞凋亡的作用,从而保护内皮细胞,抑制血小板和白细胞活化,抑制凝血从而改善凝血异常[7-8]。ET-1是内皮细胞分泌的一种调节蛋白,主要分布于心血管系统中,发挥刺激血管收缩,促进平滑肌细胞和心肌细胞生长的功能,对于维持血压和血流分布的稳定性具有重要意义[9]。测定大鼠血中NO、ET-1含量可反映内皮功能及损伤程度。高压氧能够改善内皮细胞功能,清除炎性介质,调节细胞因子,清除核酸酶、蛋白质水解酶、肌红蛋白及乳酸等生物性毒素及代谢废物,从而纠正细胞缺氧、乳酸性酸中毒及水电解质紊乱,调节内皮免疫微环境,重建细胞再生修复的微环境,改善内皮功能,维持内皮细胞的完整性,最终改善器官功能,纠正凝血功能异常,阻断疾病向DIC及MODS 的发展。
本研究结果表明,热射病组血中NO水平降低和ET-1水平升高,说明大鼠内皮细胞功能受到损害,上述指标的异常程度也充分反映了热射病导致的血管内皮细胞功能受损程度。高压氧治疗后血中NO水平回升和ET-1水平的回降,说明高压氧对热射病所致血管内皮损伤具有修复作用。高压氧可迅速增加氧供应,改善细胞的有氧代谢,从而促进线粒体氧化磷酸化,增强ATP合成,修复内皮细胞的损伤,增加NO的合成和释放,并且减少ET-1释放,使血管内皮功能得到恢复。已有研究显示[10],ET-1水平与NO分泌失衡密切相关。这种反应可能与高压氧改善缺氧对NOS mRNA表达的抑制,增强ET-1mRNA的表达有关[11]。
综上所述,通过检测血清NO、ET-1水平可证实,高压氧对热射病导致的血管内皮损伤具有保护作用,为临床治疗提供了有力证据,但本研究中由于热射病模型制备后,大鼠存活时间短,未能将连续多次高压氧治疗进行比较,对于最终治疗效果有待进一步研究。

