生防菌A4的鉴定及其对樱桃番茄采后主要病害的抑制作用
赵焕兰,曹嘉灿,管媛媛,张苑珩,刘雯鑫,苗 敏
(合肥工业大学食品与生物工程学院,安徽 合肥 230009)
樱桃番茄(LycopersiconescuLentumvar.cerasiforme)属于呼吸跃变型果实,采后因生理失调极易遭受病原微生物的侵染而发生病害。由灰霉菌(Botrytis cinerea)引起的灰霉病和扩展青霉菌(Penicilliumexpansum)引起的青霉果腐病是樱桃番茄采后最主要的病害[1-2]。发病后的樱桃番茄失去食用价值且影响健康樱桃番茄的贮藏,造成巨大的经济损失,因此探求防治樱桃番茄采后病害的有效方法具有重要意义。目前对于樱桃番茄采后病害的防治以喷施化学药物为主,但长期施用化学农药容易使真菌产生抗药性,还会破坏生态环境和影响农产品质量安全,因此亟需探究绿色安全、生态友好的有效生物防治措施来提高樱桃番茄采后病害的防治效果。
生防菌是一类抑制病原菌活性、控制病害发生和发展的益生菌,主要通过以下机制发挥作用:与病原菌竞争营养物质及生存空间拮抗其生长,分泌抗菌活性物质,吸附在病原菌表面使其断裂或死亡,诱导寄主抗性增强等[3]。国内外众多研究表明:生防菌能抑制病原真菌活性,从而减轻果蔬采后病害[4-7]。这些研究主要集中在筛选能够抑制真菌生长且活性稳定的芽孢杆菌方面,目前筛选鉴定的生防芽孢杆菌包括枯草芽孢杆菌(Bacillussubtilis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)和苏云金芽孢杆菌(Bacillusthuringiensis)。而贝莱斯芽孢杆菌(Bacillus velezensis)作为最新发现的潜力生防菌,对该菌种的鉴定和生防效果的研究较少,是近年来生物防治研究的聚焦点[8]。
菌种种属的鉴定常通过形态学特征、分子序列特性以及菌株的生理生化特征联合分析确定。细菌形态学鉴定简单快速,但准确性不强,因此需要结合分子生物学方法即16SrDNA、gyrB等细菌的保守序列进一步确定菌属类别,再结合目的菌属的生理生化特征进行联合验证。本研究结合形态学、分子生物学以及生理生化特征分析对菌株A4进行鉴定,结果显示菌株A4为贝莱斯芽孢杆菌(Bacillusvelezensis)。进一步以樱桃番茄采后重要的致病菌灰霉菌(Botrytis cinerea)和扩展青霉菌(Penicilliumexpansum)为指示菌,探究菌株A4对两种病原菌丝生长的抑制能力以及这两种病原菌引起的樱桃番茄采后病害的防治效果及可能的抑菌机理。本研究为生防菌贝莱斯芽孢杆菌的鉴定提供了参考方法,也为樱桃番茄采后病害的生物防治提供了新的思路。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
樱桃番茄购买于水果超市,取健康且大小均一的果实经2%NaClO浸泡2 min,自来水清洗2 min,放置于通风处晾干备用[9]。
生防菌A4由实验室前期从猕猴桃果实上分离并保存;灰霉菌(Botrytiscinerea)由合肥工业大学张丹凤副教授提供;扩展青霉菌(Penicilliumexpansum)由以色列农业部农业研究组Samir Droby教授提供,后保存于本实验室。
蛋白胨、酵母粉、琼脂、牛肉膏,BioFroxx公司;羧甲基纤维素钠、(NH4)2SO4、MgSO4,国药集团化学试剂有限公司;溴甲酚紫、酚红指示剂,生工生物工程(上海)股份有限公司;芽孢染色试剂盒,北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司。
1.1.2 仪器与设备
ZHJH-C1118B超净工作台,上海智城分析仪器制造有限公司;超低温冰箱,德国Thermo Scientific;MLS-3750高压蒸汽灭菌锅,日本三洋公司;SK-R1807-E标准型三维摇床,合肥启诚生物科技有限公司;S-4800型扫描电镜,日立公司;凝胶成像分析系统,美国伯乐BIO-RAD公司;MJX-100B-Z霉菌培养箱,上海百典仪器有限公司。
1.2 方法
1.2.1 培养基的配制
LB液体培养基:10 g胰蛋白胨、5 g酵母提取物、10 g NaCl、ddH2O定容至1 L,于121℃下灭菌20 min。
LB固体培养基:10 g胰蛋白胨、5 g酵母提取物、10 g NaCl、15 g琼脂粉,ddH2O定容至1 L,于121℃灭菌20 min。
PDA培养基:200 g去皮土豆、20 g葡萄糖、20 g琼脂,ddH2O定容至1 L,于115℃灭菌30 min。
1.2.2 生防菌A4的鉴定
1.2.2.1 形态学鉴定
菌落形态观察:活化保藏菌种接种于LB固体培养基,28℃恒温倒置培养48 h,观察菌落特征。
扫描电镜观察:参照马超[10]的方法操作,稍加调整。样品冷冻干燥12 h,然后使用扫描电镜观察。
革兰氏染色:参照冀婉玥等[11]的方法操作。
芽孢染色:使用芽孢染色试剂盒对菌株A4进行芽孢染色,显微镜观察。
1.2.2.2 分子生物学鉴定
使用DNA提取试剂盒提取生防菌A4基因组DNA,参照李贺海等[12]的方法使用16SrDNA和gyrB基因特异性引物进行PCR扩增。目的基因经电泳检测合格进行序列测定,测序结果于NCBI中BLAST比对并下载相似度较高的序列。用ClustalW对亲缘关系较近序列进行比对,以邻接法(Neighbor-joining,NJ)使用MEGA7软件构建系统发育进化树,Bootstrap检验重复次数为1 000次。
1.2.2.3 生理生化鉴定
参考《常见细菌系统鉴定手册》[13]和《伯杰细菌鉴定手册》[14],以及代玉立[15]和张宝[16]的方法进行生理生化鉴定。
1.2.3 生防菌A4对樱桃番茄灰霉病及青霉果腐病的抑制效果
1.2.3.1 生防菌A4对灰霉和扩展青霉菌丝生长的影响
操作过程及抑制率计算参照詹艺舒等[17]的方法。
1.2.3.2 生防菌A4对灰霉及扩展青霉在樱桃番茄体内致病能力的影响
无菌打孔器在预处理番茄果实的赤道部位制造接种点(长3 mm,深约3 mm),定量接种1μL的A4菌悬液,浓度分别为0、0.6×109、0.8×109、1.0×109CFU/mL,并接种1μL浓度为5×106CFU/mL的扩展青霉或灰霉孢子悬浮液,分别记为CK、T1、T2、T3。待菌液吸收后分组放入无菌塑料盒中,于25℃、相对湿度80%~90%条件下贮藏,每24 h观察并统计计算果实发病率。每次试验处理200个果实,试验重复3次。
1.2.3.3 生防菌A4抑制灰霉和扩展青霉侵染樱桃番茄的扫描电镜观察
取经0和1.0×109CFU/mL A4处理24 h的接种处组织小块(1 cm×1 cm),按照“1.2.2.1”中的方法准备电镜样品。
1.2.4 数据处理
采用SPSSStatistics23.0软件进行数据的统计分析,差异显著性采用邓肯氏多重比较法,采用Origin9.0软件绘制数据图表。
2 结果与分析
2.1 生防菌A4的鉴定
2.1.1 形态特征
在LB固体培养基中该菌株形成一个白色不透明、表面粗糙隆起、边缘不规则、具有一定厚度的单菌落(图1A)。扫描电镜下呈杆状,平均大小为2.2μm×0.6μm(图1B),革兰氏染色呈紫色,表明该菌株为革兰氏阳性细菌(图1C),且芽孢染色结果显示该菌株可产生芽孢,说明具有产芽孢的能力(图1D)。根据形态特征,参考马超[10]对芽孢杆菌形态特征的描述,初步判断该菌株为芽孢杆菌属细菌。
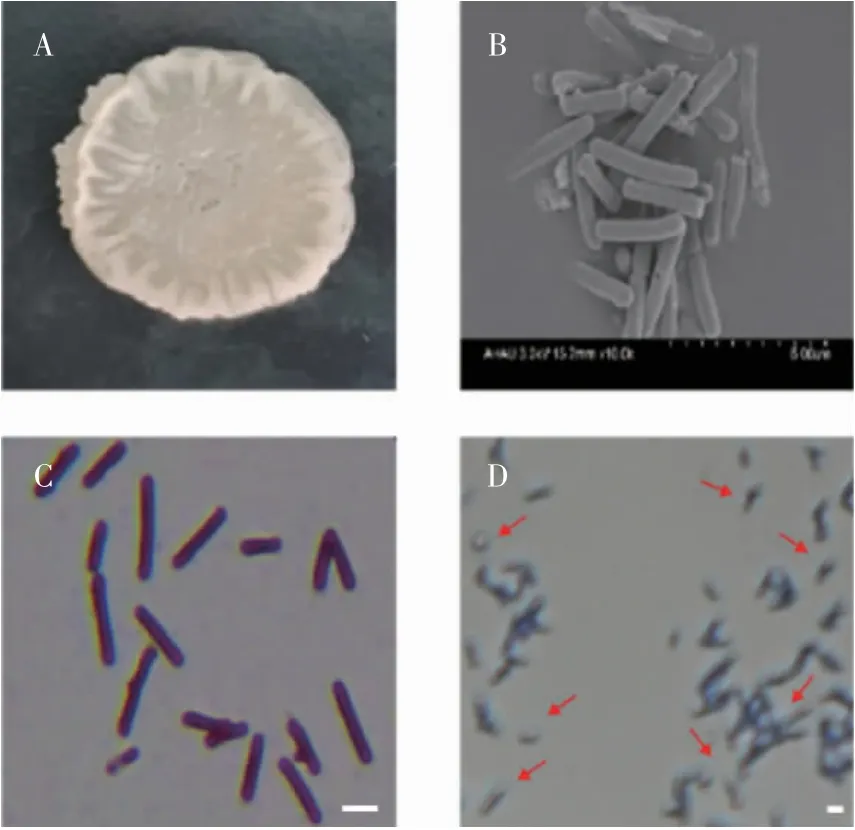
图1 生防菌A4的形态特征Fig.1 Morphological characteristicsof endophytic bacteria A4
2.1.2 分子生物学鉴定
芽孢杆菌在种间形态上极为相似,仅根据形态无法确定种属类别,需结合分子生物学方法进行具体判断。本研究参考李贺海等[12]的方法,对菌株A4进行16SrDNA和gyrB基因测序,并分别以菌株A4的16SrDNA的核酸序列(图2A)及gyrB的核酸序列(图2B)构建系统发育进化树,GenBank登录号分别为MW828618、MW900160。如图2所示,在16SrDNA序列构建的进化树中,共包含12个核酸序列信息,1 431个建树位点,采用Kimura 2-parameter方法进行计算。结果表明,菌株A4与3株贝莱斯芽孢杆菌(Bacillusvelezensisstrain Y2(KY887762.1)、Bacillus velezensisstrain NN95(MT114576.1)、Bacillusvelezensisstrain NN05(MT114571.1))单独构成一个分支(图2A)。在gyrB进化树中,共包含15个核酸序列信息,1 149个建树位点,采用Kimura 2-parameter方法进行计算。结果表明,菌株A4也与3株贝莱斯芽孢杆菌(Bacillusvelezensisstrain BCRC 17467(DQ903176.1)、Bacillusvelezensisstrain NN95(MT119763.1)、Bacillus velezensisstrain NN05(MT119758.1))单独构成一个分支,而同属于芽孢杆菌属(Bacillus)的其他菌种则聚于其他几个组中(图2B)。

图2 基于16SrDNA(A)和gyrB(B)序列的NJ系统发育树Fig.2 NJphylogenetic tree based on 16SrDNA(A)or gyrB(B)sequences
2.1.3 生理生化鉴定
生理生化特性鉴定结果见表1和图3。生防菌A4能耐受37℃及含10%氯化钠的LB培养液;接触酶反应呈阳性;Voges-Proskauer Reaction(V-P)反应、厌氧反应、苯丙氨酸脱氨酶反应均呈阴性。生防菌A4能利用蔗糖、果糖、甘露醇,但不能利用木糖、麦芽糖和柠檬酸盐;其能水解纤维素、淀粉、酪素、蛋白质,但不水解酪氨酸、吐温80。根据上述鉴定结果显示,生防菌A4与其他贝莱斯芽孢杆菌(Bacillusvelezensis)报道结果基本一致[18-19]。

图3 生防菌A4的生理生化特性试验Fig.3 Experiments on physiological and biochemical characteristics of endophytic bacteria A4

表1 生防菌A4的生理生化特性Table1 Physiological and biochemical characteristics of endophytic bacteria A4
根据菌体形态学特征、16SrDNA和gyrB的序列分析结果及生理生化特性,鉴定生防菌A4为贝莱斯芽孢杆菌(Bacillusvelezensis)。
2.2 生防菌A4对樱桃番茄灰霉病和青霉果腐病的生防效果
2.2.1 生防菌A4对灰霉和扩展青霉菌丝生长的影响
在平板对峙试验中发现:接种4 d后,生防菌A4可显著抑制灰霉菌的生长,且出现明显的抑菌圈,而对照培养基被菌丝完全覆盖(图4A);统计数据显示,生防菌A4对灰霉菌的抑制率从第3天开始逐渐增加,第5天抑制率高达66.56%(图4B)。生防菌A4对扩展青霉菌的抑制试验也显示类似的抑制效果,接种5 d后出现明显的抑菌圈(图4C),且抑制率从第4天开始逐渐上升,第6天时抑制率高达59.19%(图4D)。这些结果表明,A4菌株可以显著抑制番茄采后主要病原菌菌丝的体外生长,为该菌株在番茄采后病害防治的应用提供了理论依据。

图4 生防菌A4对灰霉和扩展青霉菌丝生长的影响Fig.4 Effectsof endophytic bacteria A4 on mycelial growth of B.cinerea and P.expansum
2.2.2 生防菌A4对灰霉菌及扩展青霉菌在樱桃番茄体内致病能力的影响
在探究生防菌A4对灰霉和扩展青霉的体外抑菌效果基础上,进一步探究其对病原菌果实致病能力的影响。试验结果显示:与对照组相比,A4菌株处理组病原菌的菌丝生长明显受到抑制(图5A和5B)。接种灰霉4 d时,对照组果实发病率高达83.3%,而预先接种A4菌悬液的处理组其患病症状显著减轻。在不同浓度A4处理后,发病率分别降低至33.34%、27.34%和14.7%(图5C)。生防菌A4对扩展青霉的抑制作用更强,接种扩展青霉4 d时,发病率分别降低至26.00%、8.67%和4.00%(图5D)。由此可见,A4菌悬液可以显著抑制灰霉及扩展青霉在樱桃番茄中的致病能力,从而对灰霉病和青霉果腐病有较好的生防效果。
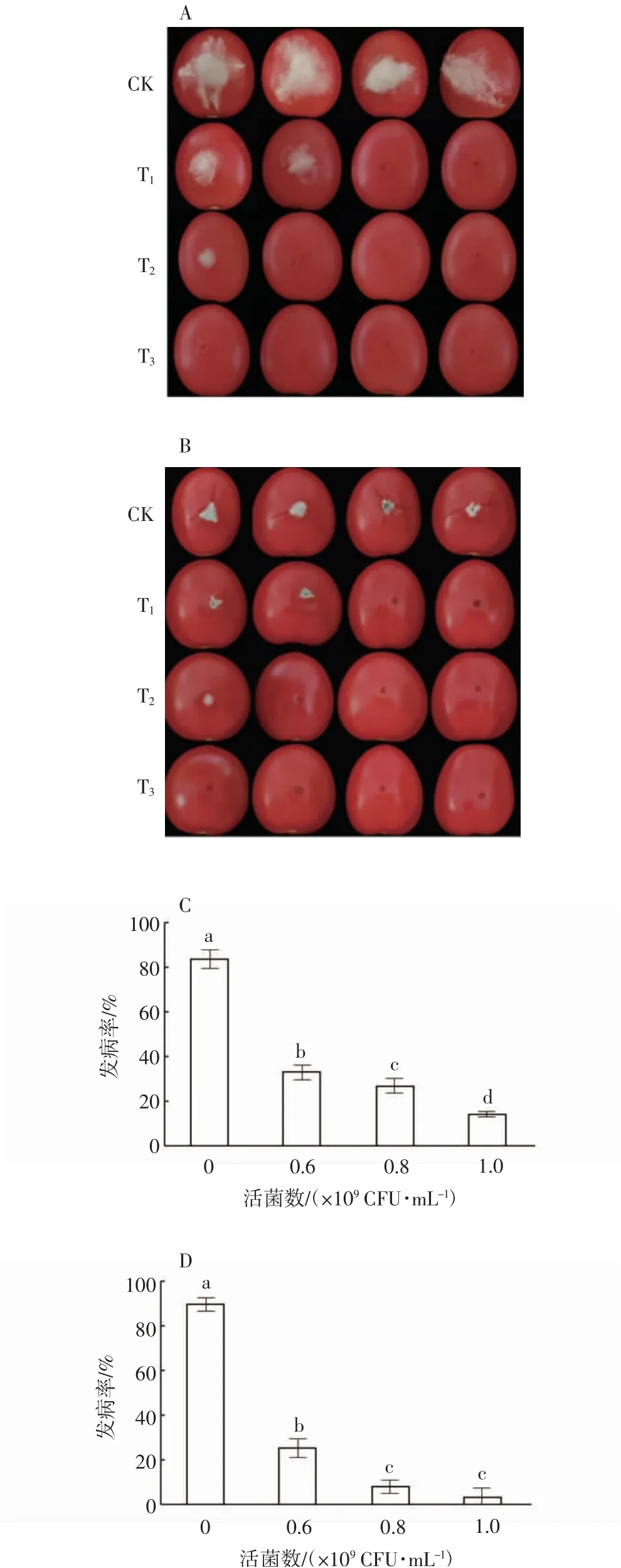
图5 生防菌A4对樱桃番茄灰霉病和青霉果腐病的抑制效果Fig.5 Inhibitory effectsof endophytic bacteria A4 on grey mould and fruit rot of Penicillium in cherry tomato
2.2.3 生防菌A4抑制灰霉和扩展青霉侵染樱桃番茄的扫描电镜观察
在明确生防菌A4能有效抑制灰霉和扩展青霉菌对樱桃番茄侵染的基础上,进一步通过扫描电镜探究生防菌A4的作用机理。结果显示(图6A和图6B),两种病原菌侵染番茄果实24 h后,孢子能正常萌发并形成大量菌丝,成功侵染番茄果实使其患病。而生防菌A4处理组显示:大量生防菌A4定殖于樱桃蕃茄,靠近或吸附在灰霉孢子上,造成灰霉孢子干瘪、畸形,显著抑制了灰霉孢子的萌发(图6C);而少量青霉孢子萌发成菌丝后也显示断裂、干瘪状态,失去致病能力,无法侵染番茄果实(图6D)。这些结果表明:生防菌A4可以靠近、吸附或寄生病原菌孢子及菌丝,使其干瘪变形、断裂或死亡,进而降低病原菌对果实的致病能力,减少病害的发生。

图6 生防菌A4对灰霉或扩展青霉侵染樱桃番茄果实的影响Fig.6 Effects of endophytic bacteria A4 on infection of cherry tomatoby B.cinerea and P.expansum
3 结果与讨论
灰霉(Botrytiscinerea)是一种多食性的植物病原菌,在采前和采后均可引起多种果蔬灰霉病。据报道,灰霉菌可以侵染200多种植物,包括番茄、葡萄、草莓、枣等。由灰霉菌引起的果蔬损失已成为一个世界性难题,造成的损失高达25%~55%,而高达89%的损失发生在采收后[20],全世界每年因该病造成的经济损失高达1 000亿美元[21]。其中扩展青霉(Penicllium expansum)也是易感染樱桃番茄的一种病原真菌,其分生孢子能迅速侵染果实表面伤口,在营养刺激下萌发,并完成在果实组织中的渗透和定殖[22]。过去的几十年里,樱桃番茄采后保鲜以化学保鲜技术结合低温、气调等物理保鲜技术为主。然而,化学产品的过度使用对环境、食品安全和人类健康造成危害,而物理保鲜技术成本较高。因此,迫切需要安全环保的生物源抗菌剂防治樱桃番茄的灰霉病和青霉果腐病,延长采后果实的贮藏寿命。
本实验室前期分离筛选得到一株生防菌A4,但未对其进行详细鉴定。本研究根据形态学鉴定初步判断该菌株为芽孢杆菌属细菌。分子生物学测定16SrDNA和gyrB基因核酸序列显示:菌种A4与贝莱斯芽孢杆菌的相似度最高,分别高达99.93%和99.43%,并分别构建系统进化树,结果均显示A4与贝莱斯芽孢杆菌(B.velezensis)之间的亲缘关系最近。同时,生化检测该菌对各种基质的代谢作用及其代谢产物的验证结果与贝莱斯芽孢杆菌的生化特性一致。综合形态学特征、分子序列信息和生理生化特性3方面信息,确定菌种A4为贝莱斯芽孢杆菌。
为了初步探究贝莱斯芽孢杆菌A4的生防能力,以灰霉及扩展青霉为指示菌,探究其对病原菌丝生长的抑制作用以及其对病原菌在樱桃番茄果实致病能力的影响,结果表明:生防菌A4可以显著抑制病原菌丝生长及减弱它们的致病能力。进一步通过扫描电镜观察表明,生防菌A4可以靠近、吸附于病原菌孢子或菌丝,使其干瘪变形、断裂或死亡,减少樱桃番茄的病害。可能是因为生防菌A4能分泌蛋白酶,降解真菌细胞壁及细胞膜中蛋白成分,使菌丝内容物渗出,从而导致菌丝死亡。生防菌A4利用其生长的种群优势,大量定殖于樱桃番茄,一方面可以与病原菌竞争其生长所需的营养物质和生存空间,从而抑制病原菌的生长;另一方面,生防菌A4可以附着在病原菌孢子及菌丝上,依靠病原菌提供的营养为生,从而达到抑菌目的。相关研究也表明:生防菌在伤口处快速定殖,同时可提高过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)的活性[23-24],诱导与防御相关酶的表达,从而提高果实自身的抗性。生防菌常以两种或三种机制协同作用于病原菌,减少病害的发生,因此关于贝莱斯芽孢杆菌A4对樱桃番茄采后病害的抑制机理还需要进一步的探究。

