碳青霉烯类耐药肠杆菌目细菌检测及鉴定现状
雷静 刘泽世 高兴辉 汤一苇★ 耿燕★
碳青霉烯类抗菌药物具有抗菌谱广、对大多数β⁃内酰胺酶稳定、不易被水解、不良反应相对较少的特点,是有效治疗革兰阴性杆菌严重感染的抗菌药物之一。然而,在抗生素滥用问题日益严峻的今天,碳青霉烯类抗菌药物也无法避免出现耐药危机,碳青霉烯类耐药肠杆菌目细菌(carbap⁃enem⁃resistant Enterobacterales,CRE)的出现,无疑使临床抗感染治疗陷于无药可用的境地[1]。CRE耐药问题不容小觑,尤其是产碳青霉烯酶肠杆菌目细菌(carbapenemase⁃producing Enterobacterales,CPE),早期快速、准确地检测CPE 是遏制其传播的关键,也有助于精准用药治疗[2]。
1 CRE 定义
美国疾病预防与控制中心(centers for disease control and prevent,CDC)将CRE 定义为满足以下任一条件:①肠杆菌目细菌对亚胺培南、美罗培南、厄他培南或多利培南任何一种碳青霉烯类抗菌药物耐药;对亚胺培南天然敏感性降低的细菌(如摩根菌属、变形杆菌属和普罗威登菌属等),需参考除亚胺培南外的其他碳青霉烯类抗菌药物的药敏结果;②产碳青霉烯酶[3]。
2 CRE 耐药机制
产碳青霉烯酶是CRE 耐药最主要的机制,其余耐药机制还包括外膜孔蛋白缺失或突变协同AmpC 酶或超广谱β⁃内酰胺酶的表达、外排泵系统过度表达[4⁃5]。根据Ambler 分子分类方法,可将碳青霉烯酶分为A、B 和D 三类。见表1。
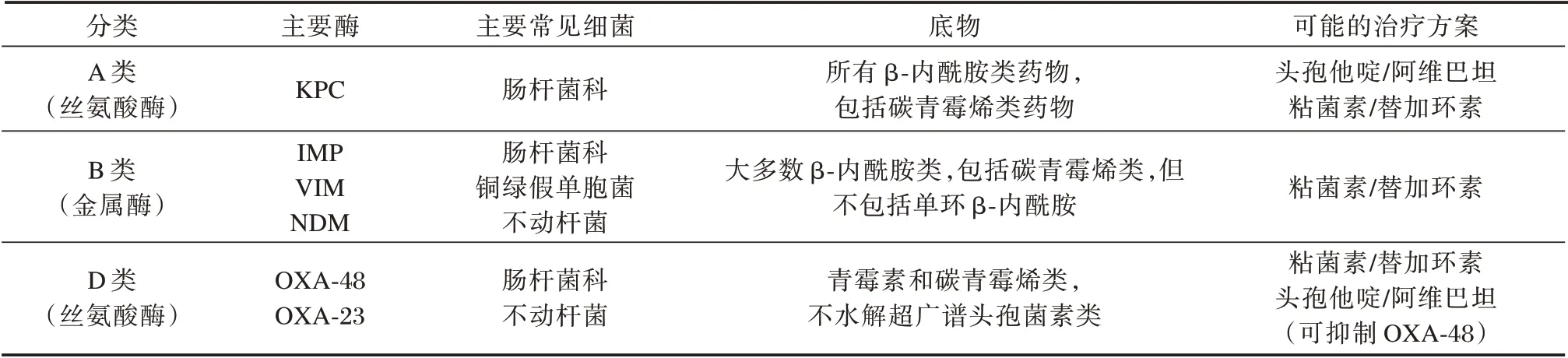
表1 碳青霉烯酶分类Table 1 classification of carbapenemases
3 CRE 表型检测方法
3.1 Carba NP 试验
Carba NP 试验是2015年CLSI 推荐的对CPE和产碳青霉烯酶铜绿假单胞菌的一种检测方法,其原理为碳青霉烯酶水解亚胺培南后导致溶液PH值改变而发生颜色变化。据报道,Carba NP 试验检测肠杆菌目细菌和铜绿假单胞菌产KPC、NDM、VIM、IMP 等碳青霉烯酶的灵敏度和特异度均>90%,但由于OXA⁃48 对碳青霉烯类药物活性较弱,导致其结果具有较高的假阴性。因此,Carba NP 试验在OXA⁃48 高流行区域(如土耳其和其他中东地区等)不具备检测优势[6⁃7]。另外,进行Car⁃ba NP 试验应选用非选择性培养基进行菌株培养。研究表明,从麦康凯和显色培养基获取的菌株在检测VIM 或OXA⁃48 存在假阴性,而使用MH 平板时,当菌株同时携带OXA⁃48 和NDM/VIM 时,结果存在假阴性[8⁃9]。
3.2 改良碳青霉烯酶灭活试验
2017年,CLSI 推荐改良碳青霉烯灭活试验(modified carbapenem inactivation method,mCIM)用于检测CPE。2018年,增加了EDTA 改良碳青霉烯灭活试验(EDTA⁃modified carbapenemase in⁃activation method,eCIM),根据碳青霉烯酶可水解美罗培南以及EDTA 可抑制金属β⁃内酰胺酶活性的原理,可区分细菌产酶类型。研究表明,mCIM检测CPE 的灵敏度和特异度均为100%;eCIM 区分丝氨酸酶的灵敏度和特异度分别为100%、95.1%,MBLs 的灵敏度和特异度为98.4%和100%,若待测菌株同时存在丝氨酸酶和MBLs,eCIM 试验结果将出现误差[10⁃12]。
3.3 碳青霉烯酶抑制剂增强试验
根据3⁃氨基苯硼酸和乙二胺四乙酸可分别抑制丝氨酸酶和金属β⁃内酰胺酶活性的原理,可判断待测菌株产酶类型,但无法检测OXA 酶[13]。研究显示,碳青霉烯酶抑制剂增强试验检测单一酶型菌株的灵敏度为100%,特异度>98.8%,检测同时产丝氨酸酶和MBLs 的灵敏度为96.8%,特异度为100%[14]。
3.4 质谱技术
基质辅助激光解吸电离飞行时间质谱(matrix⁃assisted laser desorption ionization time⁃of⁃flight mass spectrometry,MALDI⁃TOF MS)是近年来快速发展起来的一种检测生物大分子的重要手段,被认为是快速鉴定临床微生物的新利器,通过测定蛋白特征峰或碳青霉烯类药物结构的完整性检测酶的存在。结合目前研究结果,MALDI⁃TOF MS 技术检测KPC 酶的灵敏度和特异度分别为85.1%和100%[15⁃16]。目前MALDI⁃TOF MS 在此方面的研究存在异质性且无统一标准化的操作方法,进行酶水解法时某些抗菌药物溶液需自配,并需与待测菌共孵育1~2.5 h,且不同酶型孵育时间不同。
3.5 显色培养基
显色培养基已广泛应用于临床微生物的鉴别诊断,其原理为目标细菌产生的特异性酶作用于底物而长成有色菌落,由于添加抗菌药物或其他抑制剂,非目标性细菌生长受限,可从样本中直接分离出CRE。近年来,不同厂家研发了不同CRE商品化产品,如Brilliance CRE、bioMérieux chromID Carba、CHROMagar Colorex KPC 等。两项研究表明,与PCR 相比,以上3 种显色培养基的灵敏度分别为77.6%~78.0%、89.8%~91.0%和56.0%~83.7%,特异度分别为60.0%~87.1%、76.0%~95.0%和70.0~92.1%,但其对OXA⁃48 的检测能力有待提高[17⁃18]。此外,一些产中间型碳青霉烯酶(NDM⁃1)菌株可能生长不良[19]。CRE 表型检测方法。见表2。
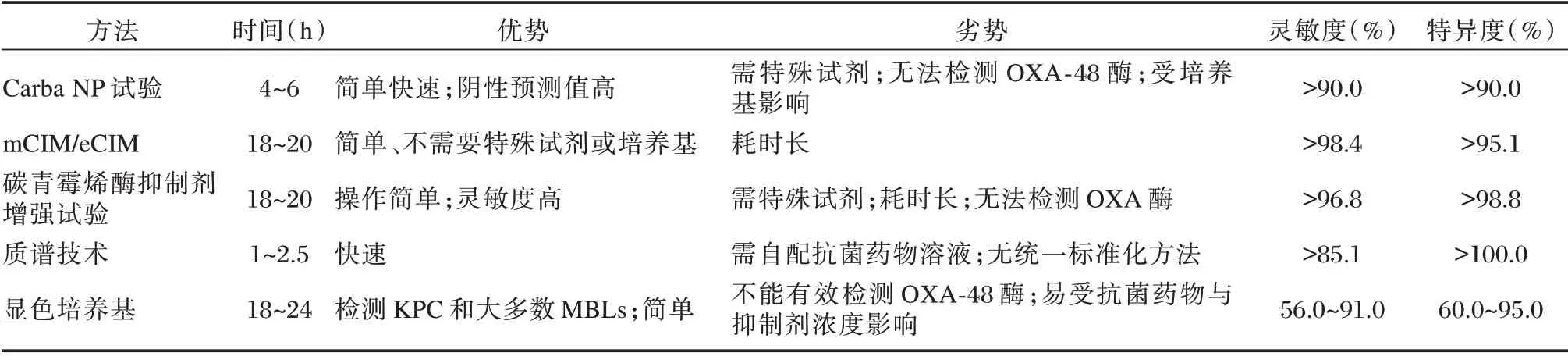
表2 CRE 表型检测方法Table 2 CRE phenotypic testing methods
4 碳青霉烯酶基因型检测
碳青霉烯酶基因型检测是检测能够编码碳青霉烯酶的DNA 序列。其主要检测方法包括靶向基因检测和二代测序。与表型方法相比,基因型方法的优势是能够检测并明确碳青霉烯酶基因型,检测速度快,节省时间;劣势是技术要求高,不能确定基因是否表达,检测成本高。见表3。

表3 CRE 耐药基因检测方法Table 3 CRE resistance genotype detection methods
4.1 酶免疫层析技术
酶免疫层析技术是一种以抗原抗体反应为基础,用于体外快速检测阳性血培养物以及纯菌落中碳青霉烯酶。近年来,不同厂家基于此技术推出不同的试剂盒,如NG⁃Test CARBA 5、RESIST⁃4 O.K.N.V.和免疫显色试剂,可对blaKPC、blaNDM、blaVIM、blaIMP(RESIST⁃4 O.K.N.V.不能检测)和blaOXA⁃48进行检测。研究显示,酶免疫层析技术检测碳青霉烯酶的灵敏度和特异度均>92.0%,但当细菌携带2 种或以上的酶型后,酶免疫层析方法只能检测到部分酶型从而产生重大错误[20⁃21]。
4.2 Carba⁃R Assay
Carba⁃R Assay 是一种荧光定量PCR 检测方法,可在50 min 内检测直肠拭子、尿液和纯菌落中5 种碳青霉烯酶。一项多中心研究发现,在直肠拭子和临床菌株中,与测序结果相比,Carba⁃R 检测碳青霉烯酶基因的总阳性符合率分别为96.0%和99.7%,总阴性符合率分别为94.0%和98.0%[22]。此外,在301 份痰标本中,Carba⁃R Assay 与PCR 方法相比,其阳性一致率和阴性一致率分别为92.9%和86.7%[23]。而检测血流感染菌株和阳性血培养物时,Carba⁃R 特异度为100%,NG⁃Test CARBA5和Carba⁃R 检测菌株的灵敏度分别为92.1%和100.0%,阳性血培养物的灵敏度分别为79.3%和100%[20]。应用Carba⁃R 对CPE 定植患者进行快速筛查,可将CPE 的定植率从28.6%降至5.6%,感染率从35.7%降至2.8%,有效地限制了其在医疗环境中传播[24]。
4.3 BDMAX
BD MAX 是一种单试剂、即用、全自动的多重实时PCR 体外诊断产品,能够检测菌株和直肠拭子中的blaKPC、blaNDM、blaVIM/blaIMP和blaOXA⁃48基因。一项研究结果显示,BD MAX 检测碳青霉烯酶的灵敏度和特异度可达97.1%和98.8%,但不能检测到IMP⁃11、IMP⁃13、IMP⁃14 和OXA⁃535 突变体,而在直肠拭子标本中,其灵敏度和特异度分别为92.8%和97.8%[25]。由于VIM 和IMP 之间缺乏区分,可能会限制BD MAX 在这些酶广泛流行的地区应用。
4.4 LightMix Modular Carbapenemases Kits
LightMix Modular Carbapenemases Kits 是一种多重PCR 方法,可根据需求选择检测靶标数量,操作时间约5 min,90 min 内报告结果。与测序结果相比,其对118 份临床分离株的总体敏感性和特异性分别为99%和100%,且在CPE 定植患者中,Light⁃Mix Modular Carbapenemases Kits 与Xpert Carba⁃R检测结果一致[26]。
4.5 ePlex BCID⁃GN panel
ePlex BCID⁃GN panel 是一种采用电润湿和电子传感器技术对血培养阳性瓶进行提取、扩增和竞争性DNA 杂交,可鉴定56 种细菌和真菌以及包括碳青霉烯酶在内的β⁃内酰胺酶检测试剂盒。研究显示,BCID⁃GN panel 对碳青霉烯酶的PPA 和NPA 分别为98.1%和99.9%[27]。
4.6 Verigene Gram⁃negative blood culture test
Verigene Gram⁃negative blood culture test 是一种非扩增方法,其依赖于从阳性血培养物中提取核酸,然后使用捕获和检测探针进行基于微阵列的检测。一项多中心研究表明,Verigene 与参考方法相比,对5 种碳青霉烯酶基因的阳性一致率>94.3%,阴性一致率>99.9%[28]。若阳性血培养物中为混合菌,Verigene 则无法确定耐药基因与特定细菌之间的关联[29]。
4.7 FilmArray BCID2
FilmArrayBloodCultureIdentification2(BCID2)采用巢式多重PCR 技术,可在1 h 内检测包括blaKPC、blaIMP、blaNDM、blaOXA⁃48⁃like、blaVIM在内的10 种耐药基因[30]。一项研究显示BCID2 鉴定微生物种类的灵敏度和特异度分别为98.8%和99.9%,检测耐药基因的灵敏度和特异度均为100%[31]。然而,在FilmArray 上进行测试的成本超过100 美元,这限制了该方法在低中度流行环境下检测blaKPC的实用性。
4.8 二代测序
全基因组测序(whole genome sequencing,WGS)被认为是检测碳青霉烯酶基因的最全面的分子检测方法,它还可测定除碳青霉烯酶外的其他耐药基因。在过去十年中,WGS 的成本急剧下降,在临床微生物学实验室中的应用已指日可待。然而,在将该技术纳入常规临床微生物学之前,还需要克服一些障碍,包括周转时间长和数据管理困难。宏基因组测序与WGS 类似,但它是直接从临床样本(如痰)中获得DNA,由于数据分析的高成本和复杂性,目前还不足以对感染进行评估。
5 质控菌株选择
进行以上碳青霉烯酶实验室检测时,应同时测试相应的阳性和阴性质控菌株。首选的阳性质控菌株为肺炎克雷伯菌ATCC BAA⁃1705(产KPC 型碳青霉烯酶)、肺炎克雷伯菌ATCC BAA⁃2146(产NDM 型金属β⁃内酰胺酶)和肺炎克雷伯菌ATCC BAA⁃2524(产OXA⁃48 型碳青霉烯酶),首选的阴性质控菌株为肺炎克雷伯菌BAA⁃1706(不产碳青霉烯酶)。若实验室不具备上述首选质控菌株,可选择经DNA 测序后相应已明确的碳青霉烯酶基因型作为阳性质控菌株,而阴性质控菌株可选择大肠埃希菌ATCC 25922[13]。
6 小结和展望
目前实验室的CRE 表型检测方法,灵敏度较高、操作方便、价格较低,但存在特异度较低、缺乏标准化、耗时较长等缺点,限制了其进一步使用。随着CRE 基因型方法的出现,提高了检测的灵敏度和特异度,且操作简单,但也只能检测已知基因,不能检测未知基因。全基因测序方法弥补这个缺陷,能够检测已知和未知CRE 基因,这能够帮助临床解决疑难问题。
随着CRE 在包括中国在内的全球范围内不断地蔓延,一些菌株携带CRE 酶型种类和数量也在增加。未来的CRE 实验室检测方法和应用可能有下面一些趋势:第一是检测样本的类型会拓展,除了已应用的菌落、阳性血培养物以及肛拭子以外,呼吸道标本可能获得更多的应用。第二是在检测CRE 存在的前提下,迅速对其酶型进行判断,可用于临床指导治疗依据。第三是既往菌种鉴定基础上的耐药性检测有望被快速的CRE 酶型检测的“功能性”鉴定所取代。

