COPD并RF经NIPPV后Fib、D⁃D、血气参数的变化及与肺功能的关系
杨茜 王慧婷 尹月嫡 金明月
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD)是由通气功能障碍引起的以肺功能减退为特征的肺部疾病。据统计,我国40岁以上人群COPD 的发病率达8.3%[1]。当COPD患者出现急性感染时易引发呼吸功能下降,乃至发展为呼吸衰竭(Respiratory failure,RF),严重时可危及患者的生命安全。据研究表明,当COPD患者合并RF 时,单纯的药物治疗并不能缓解大部分临床症状,因此联合机械通气治疗成为挽救COPD 合并RF 患者生命的重要手段[2]。常规有创通气虽能改善患者症状,但侵入性操作可增加患者发生医源性感染风险,在临床治疗的开展中存在一定局限性[3]。而无创正压通气(noninvasive intermittent positive pressure ventilation,NIPPV)为现阶段治疗COPD 合并RF 的常用方式,其具有无创性及并发症少等优点[4]。此外,COPD 合并RF易诱发低氧血症或高碳酸血症,且患者常存在缺氧及二氧化碳潴留表现。为此,本研究就COPD合并RF 经NIPPV 治疗后纤维蛋白原(Fibrinogen,Fib)、D⁃二聚体(D⁃dimer,D⁃D)、血气参数的变化及与肺功能的关系进行分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年4月至2021年2月于首都医科大学附属北京世纪坛医院接受治疗的98 例COPD 合并RF 患者为研究组,其中男62 例,女36 例,平均年龄(67.50±10.23)岁;平均病程(16.26±3.52)年。纳入指标:①满足中华医学会编订的《慢性阻塞性肺疾病诊治指南》内的相关诊断标准[5];②经肺功能检查、胸部X 线/CT 等检查确诊;③临床资料完整者;④无支气管哮喘病史。排除标准:①存在心、肝、肾和脑等脏器严重功能不全者;②昏迷状态下等无自主呼吸,无法配合治疗者;③存在精神疾病、意识障碍等配合度低的情况;④呼吸道的清除能力较差,而且误吸性极高者;⑤纳入研究前2周服用过抗血小板聚集、抗凝药者。另选取同期进行体检的86 例健康者作为对照组,其中男49例,女37 例,平均年龄(67.50±10.23)岁。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性,本研究经院医学伦理委员会批准通过,受试者或家属已签署知情同意书。
1.2 方法
1.2.1 治疗方法
COPD 合并RF 患者予以NIPPV 治疗:连接呼吸机管道,测试呼吸机功能是否正常,协助患者合理佩戴面罩。无创呼吸机参数的选择:将工作模式调节至S/T 模式;呼吸频率控制在12~16 次/min,依据患者病情发展、基础条件、生命体征等给予合适的辅助压力,呼吸机的吸气相压力从8~10 cm H2O 开始,以每次上调2 cm H2O 进行调节,由低到高逐步调节至12~20 cm H2O,呼气相压力也需从2~4 cm H2O 起,视患者的病情变化逐步调整至4~6 cm H2O 之间,使患者的血氧饱和度在体内含量达到90%以上,吸氧浓度35%~50%。
1.2.2 检测方法
检测时间为对照组体检时、研究组入院时及NIPPV 治疗4 h 后。抽取受检者5 mL 静脉血,3 000 r/min 离心10 min,离心半径10 cm,分离血清,置-80℃保存。采用沃芬ACL⁃TOP⁃750 型全自动凝血分析仪(西班牙沃芬集团)及配套试剂盒,采用凝固法检测纤维蛋白原(fibrinogen,Fib),采用乳胶免疫比浊法检测D⁃二聚体(D⁃Dimer,D⁃D)。抽取受检者1 mL 动脉血,采用美国沃芬GEM pre⁃mier 3500 型血气分析仪检测受检者动脉血氧分压(arterial partial pressure of oxygen,PaO2)、动脉血二氧化碳分压(Partial pressure of carbon dioxide inar⁃tery,PaCO2)。采用耶格肺功能检测仪检测肺功能,由专业人员操作,主要检测指标包括:用力肺活量(Forced vital capacity,FVC)、一秒用力呼气容积(Forced expiratory volume in one second,FEV1)及第一秒用力呼气量占所有呼气量的比例(FEV1/FVC)水平。
1.3 统计学方法
采用SPSS 22.0 统计软件进行统计分析,计量资料以(±s)表示,采用t检验;采用Pearson 直线相关分析COPD 合并RF 患者Fib、D⁃D、血气参数与肺功能的相关性,以P<0.05 表示差异有统计学意义。
2 结果
2.1 研究组治疗前后与对照组Fib、D⁃D、PaO2、PaCO2水平比较
Fib、D⁃D、PaCO2水平:研究组治疗前>研究组治疗后>对照组,PaO2水平:研究组治疗前<研究组治疗后<对照组,差异有统计学意义(P<0.05)。见表1。
表1 研究组治疗前后与对照组Fib、D⁃D、PaO2、PaCO2水平比较(±s)Table 1 Comparison of FIB,D⁃D,PaO2 and PaCO2 levels between the two groups at admission(±s)
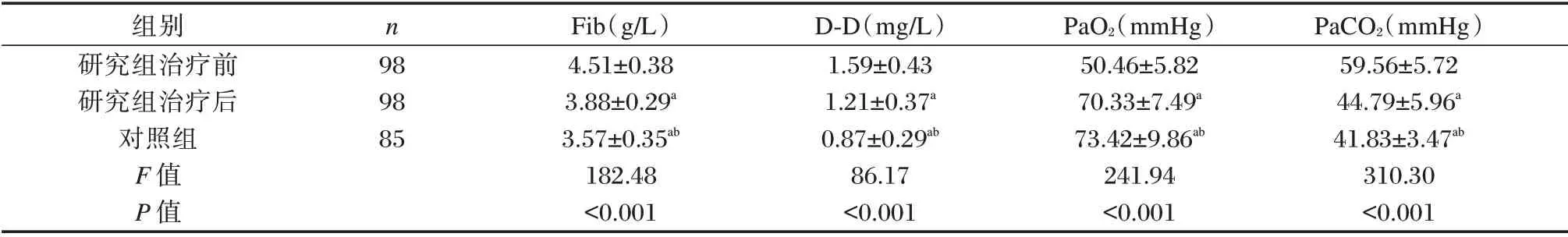
表1 研究组治疗前后与对照组Fib、D⁃D、PaO2、PaCO2水平比较(±s)Table 1 Comparison of FIB,D⁃D,PaO2 and PaCO2 levels between the two groups at admission(±s)
注:与研究组治疗前比较,aP<0.05;与研究组治疗后比较,bP<0.05。
组别研究组治疗前研究组治疗后对照组F 值P 值n 98 98 85 Fib(g/L)4.51±0.38 3.88±0.29a 3.57±0.35ab 182.48<0.001 D⁃D(mg/L)1.59±0.43 1.21±0.37a 0.87±0.29ab 86.17<0.001 PaO2(mmHg)50.46±5.82 70.33±7.49a 73.42±9.86ab 241.94<0.001 PaCO2(mmHg)59.56±5.72 44.79±5.96a 41.83±3.47ab 310.30<0.001
2.2 研究组治疗前后与对照组FVC、FEV1、FEV1/FVC 水平比较
FVC、FEV1、FEV1/FVC 水平:研究组治疗前<研究组治疗后<对照组,差异有统计学意义(P<0.05)。见表2。
表2 研究组治疗前后与对照组FVC、FEV1、FEV1/FVC水平比较(±s)Table 2 Comparison of FVC,FEV1 and FEV1/FVC levels between the two groups at admission(±s)
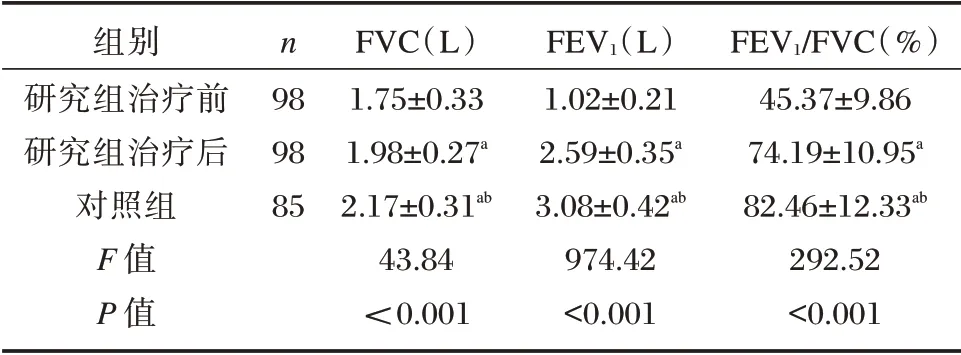
表2 研究组治疗前后与对照组FVC、FEV1、FEV1/FVC水平比较(±s)Table 2 Comparison of FVC,FEV1 and FEV1/FVC levels between the two groups at admission(±s)
注:与研究组治疗前比较,aP<0.05;与研究组治疗后比较,bP<0.05。
组别研究组治疗前研究组治疗后对照组F 值P 值n 98 98 85 FVC(L)1.75±0.33 1.98±0.27a 2.17±0.31ab 43.84<0.001 FEV1(L)1.02±0.21 2.59±0.35a 3.08±0.42ab 974.42<0.001 FEV1/FVC(%)45.37±9.86 74.19±10.95a 82.46±12.33ab 292.52<0.001
2.3 COPD 合并RF 患者Fib、D⁃D、血气参数与肺功能的相关性分析
Pearson 相关性分析显示:COPD 合并RF 患者Fib、D⁃D、PaCO2与FVC、FEV1、FEV1/FVC 呈负相关(P<0.05),PaO2与FVC、FEV1、FEV1/FVC 呈正相关(P<0.05)。见表3。
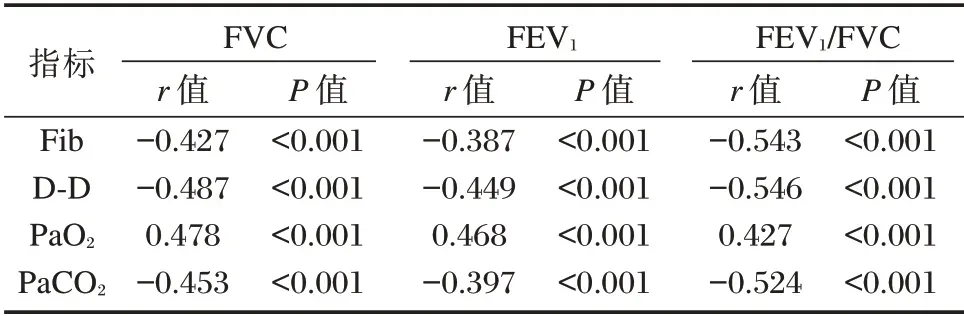
表3 COPD 合并RF 患者Fib、D⁃D、血气参数与肺功能的相关性分析Table 3 correlation analysis of coagulation function,blood gas parameters and lung function in patients with COPD complicated with respiratory failure
3 讨论
COPD 合并RF 主要以胸闷、气短、胸痛、咳痰等表现为主,故临床治疗主要以改善患者的肺通气能力为首要目标[6⁃7]。据研究显示,COPD 合并RF 的患者PaCO2水平会出现上升,同时PaO2水平会出现下降[8]。本研究显示,与对照组相比,COPD 合并RF 患者治疗前Fib、D⁃D、PaCO2水平升高,PaO2水平下降。既往研究显示,COPD 合并RF患者FVC、FEV1、FEV1/FVC 水平存在明显降低,这与本研究结果一致[9⁃10]。说明COPD 合并RF 存在明显的血气指标紊乱与肺功能下降。究其原因可能为,COPD 患者常存在感染、缺氧症状以及血栓前状态,当合并RF 时就会引起缺氧症状加剧,机体的炎症介质水平增加更为显著,持续性的血液高凝状态导致肾小球内微小血栓的形成,引起肾小球的损伤,同时又激活了纤溶系统,致使Fib 沉积在肾小球内[11];加之持续性的高碳酸血症以及低氧血症造成微血管的直接损伤,促使凝血系统激活,致使肝素抗凝活性下降,从而引起凝血因子的活性增加,造成继发性纤溶亢进,从而导致D⁃D、Fib 的表达水平上调[12]。
NIPPV 是当前国外推荐治疗COPD 合并RF 的首选方式,该方式在患者可自主呼吸的前提下,通过面罩连接人机界面,为患者提供压力水平以维持气道压,以此进行辅助通气[13⁃14]。既往Rong 等[15]研究指出,COPD 患者的缺氧主要与肺通气血流比例失衡相关。类似的,Zhou 等[16]研究认为,采取NIP⁃PV 低浓度给氧方式能有效纠正患者缺氧情况,根据肺泡通气和PaCO2的关系,当PaCO2>75 mmHg时,就会引起线性范围内的通气增多,致使PaCO2下降,酸碱值上升,因此认为COPD 合并RF 应用NIPPV 治疗疗效较佳。本研究结果说明NIPPV 治疗可改善患者血气参数和血液高凝状态以及肺功能,这与既往研究结果相似[17]。分析其中原因,NIPPV 通过促进机体潮气量的增加,改善患者的通气功能,从而减轻呼吸肌负荷,继而有效维持体内PaO2、PaCO2水平。此外NIPPV 可提供外源性的呼气末正压,在提高呼吸肌的性能的同时有效减少气道的阻力,扩张闭塞的肺泡,从而促进表面物质的释放以及痰液的排出,继而改善患者的肺换气功能[18]。本文研究结果提示Fib、D⁃D、血气参数指标与COPD 合并RF 患者肺功能相关。
综上所述,COPD 合并RF 患者肺功能受损会影响Fib、D⁃D、血气参数,采取NIPPV 治疗后能有效改善患者的肺功能、血气参数,有助于患者呼吸系统的恢复,减轻血液高凝状态。

