香菇GPX基因克隆及其在采后贮藏中的表达分析
韩云云,袁学文,栗艺芳,邓 冰,*
(1.山西农业大学资源环境学院,山西 晋中 030801;2.山西农业大学食品科学与工程学院,山西 晋中 030801;3.山西省襄垣县农业农村局,山西 长治 046200)
香菇(Lentinus edodes)属担子菌纲(Basidaiomycetes)伞菌目(Agaricales)口蘑科(Tricholomatacete)香菇属(Lentinus),2020年国内香菇总产量达到1 188.21万t,在所有食用菌中居于首位[1]。鲜食香菇在贮藏过程中极易发生褐变,造成了严重的经济损失[2-3]。对双孢菇和杏鲍菇的研究发现,以酪氨酸酶(Tyrosinase,TYR)、双酚氧化酶(Diphenoloxidase,DPO)和漆酶(Laccase,LAC)等为代表的多酚氧化酶(Poly phenol oxidase,PPO)是直接造成子实体褐变的关键酶之一[4]。TYR和LAC能催化酪氨酸(单酚化合物)形成3,4-二羟基苯丙氨酸,之后该化合物被进一步氧化成多巴醌,在非酶催化条件下多巴醌转化为多巴色素(红色)、5,6-二羟基吲哚和5,6-吲哚醌(黄色),并经过聚合反应形成黑色素(紫色)和黑素(黑色)等褐变物质[4-7]。目前香菇采后褐变过程中发挥主要作用的酶种类尚无定论,同时褐变过程中涉及的生理生化机制和分子机制尚不明确。过氧化物酶(Peroxidase,POD)是真核生物抗氧化系统中的关键酶,在机体应答生物胁迫和非生物胁迫相关的生物学过程中发挥重要作用[8-10]。另外有研究表明,在过氧化物氧化相关活性物质产生色素沉积的过程中POD发挥了重要作用,而通过外源处理钝化POD活性可以有效抑制香菇褐变发生,表明POD可能亦是造成食用菌褐变发生的关键酶[11-13]。谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)为含有巯基的POD酶类,目前研究发现GPX在调节机体生长发育、活性氧(Reactive oxygen species,ROS)代谢和抵抗压力胁迫等过程中发挥作用,但是对于其在园艺产品采后褐变,尤其是以香菇为代表的食用菌采后褐变发生中的作用机制尚不清楚[14-15]。
本研究基于香菇基因组数据筛选香菇LeGPX基因,通过基因克隆明确其编码序列,利用生物学软件预测其基本生物学信息,并通过荧光定量PCR(qRTPCR)技术研究其在香菇采后贮藏中的表达模式,通过以上研究以期为明确香菇采后褐变机制提供依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
香菇:于2021年5月采自山西省临县山圪崂农业专业合作社,挑选菌盖直径一致、无机械伤且未开伞香菇,采摘后置于4℃贮藏。分别在贮藏0、4、8、12、16、24、28 d留取菌盖和菌柄部位,所有样品经液氮速冻后置于超低温(-80℃)冰箱保存。
总RNA提取试剂盒、克隆载体、DH5α感受态细胞和Transetta感受态细胞:北京全式金生物技术股份有限公司;反转录试剂盒、质粒小提试剂盒、DNA纯化试剂盒、无缝克隆试剂盒:南京诺唯赞生物科技有限公司;pCOLD-ProS2载体:宝日医生物技术(北京)有限公司。
1.1.2 仪器与设备
NanoDrop ONE超微量分光光度计,美国赛默飞世尔科技公司;Mini-Sub cell GT电泳系统,CFX96荧光定量PCR仪,美国伯乐科技公司;Tone96G梯度PCR仪,德国耶拿分析仪器股份公司;Tanon4100凝胶成像仪,上海天能科技有限公司;WSC-S型色差仪,上海仪电分析仪器有限公司。
1.2 方法
1.2.1 基因鉴定
通过基迪奥云平台(https://www.omicshare.com/tools/)对课题组已获得转录组数据中所有的编码基因进行PFAM注释,以E值<0.01为准提取包含GPX结构的序列,之后利用NCBIBlastP确定蛋白的保守结构域。使用IBS1.0对蛋白注释结果和基因结构进行绘制。
1.2.2 基因克隆
1.2.2.1 总RNA提取和反转录
参照RNA提取试剂盒说明书提供的方法进行冻存样品总RNA的提取,用100μL无酶水溶解RNA沉淀,水平电泳检测RNA提取质量,NanoDrop ONE超微量分光光度计检测RNA浓度和纯度。以1μg总RNA为模板,参照反转录试剂盒说明进行反转录。反应产物稀释10倍,保存于-80℃冰箱备用。
1.2.2.2 基因克隆
参照“1.2.1”中鉴定的序列,使用Primer 5软件设计用于PCR反应的扩增引物(表1)。

表1 本研究所用引物Table 1 Primers in thisstudy
PCR反应体系:1μL模板,上游和下游引物(10μmol/L)各2μL,PCRSupermix25μL,无菌水20μL。
PCR反应条件:95℃变性5 min,扩增28个循环(95℃30 s,55℃10 s,72℃50 s),72℃延伸10 min。水平电泳检测PCR产物并回收目的片段凝胶,使用试剂盒纯化目的片段。将纯化产物连接至EASY cloning载体,重组载体转入大肠杆菌感受态细胞。37℃过夜培养后用PCR验证阳性菌落,委托上海生工生物工程有限公司进行测序。
1.2.2.3 系统发育树的构建及多序列比对
从NCBI下载部分真菌GPX蛋白序列,使用MEGA6.0软件构建系统发育树。参照系统发育分析结果,使用BioEdit软件对LeGPX蛋白与相近物种GPX蛋白进行多序列比对。
1.2.3 蛋白生物信息学分析
使用在线软件Sequence Manipulation Suite对蛋白氨基酸组成、分子式和分子质量、带电荷氨基酸组成和等电点、不稳定系数及总疏水指数进行预测。使用在线软件Prabi预测二级结构组成及分布,在线软件SWISS-MODEL构建蛋白质三级结构模型。使用在线软件ExPASy-ProtScale分析蛋白亲疏水基团组成和分布,Excel软件绘制图谱。使用在线软件SignalP 4.1 Server扫描蛋白序列前60位氨基酸中信号肽分布,Excel软件绘制图谱。使用在线软件TMpred Server扫描蛋白全位点跨膜结构,Excel软件绘制图谱。使用Cell-Ploc软件预测亚细胞定位情况。
1.2.4 蛋白原核表达及纯化
参照“1.2.2”获得的序列和pCOLD-ProS2图谱设计用于构建重组载体的引物,经片段纯化和连接构建原核表达载体,PCR验证载体构建成功后转入Transetta(DE3)感受态细胞[16]。参照苏俊等[16]的方法,采用15℃结合异丙基-β-D-硫代半乳糖苷(IPTG)(0、0.2、0.4、0.6、0.8、1.0 mmol/L)诱导蛋白表达,保存诱导前和诱导后菌液,十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)检测蛋白表达情况。采用镍离子亲和纯化方法对重组蛋白进行纯化,保存贯穿液和各浓度咪唑洗脱液(30、50、100 mmol/L),SDS-PAGE检测纯化效果[17]。
1.2.5 相对表达量测定
将“1.2.2”获得的cDNA稀释10倍作为模板,参照确定的基因序列设计用于荧光定量PCR反应的引物(表1),按荧光定量PCR试剂盒说明进行qRT-PCR反应程序。以起始点为对比,使用2-ΔΔt方法进行不同样品(均包含3个生物学重复)LeGPX基因相对表达量计算[18]。
1.2.6 色差测定
分别于贮藏0、4、8、12、16、24、28 d,使用WSC-S型色差仪测定菌盖表面标记部位及菌盖切开后中心部位(菌肉)色差值。不同部位色差值测定均以每5个香菇为一组,分别设置3组重复。
1.2.7 数据统计及分析
使用IBM SPSSStatistics软件对数据进行方差分析,使用Excel 2016软件进行数据分析和绘图。
2 结果与分析
2.1 LeGPX基因鉴定
在香菇转录组数据中筛选到1条与已知物种GPX基因具有同源性的编码序列(Coding sequence,CDS)。对该序列编码的蛋白进行PFAM注释,结果显示该蛋白48~156氨基酸残基为GPX结构域(图1A),结合CDD注释结果确定筛选到的序列为LeGPX基因的CDS。对LeGPX基因DNA序列进行分析,结果显示该基因DNA序列长度839 bp,包含5个外显子;对该基因上游2 kb序列进行启动子位点预测,结果显示该基因的启动子区位于上游802bp左右(图1B)。
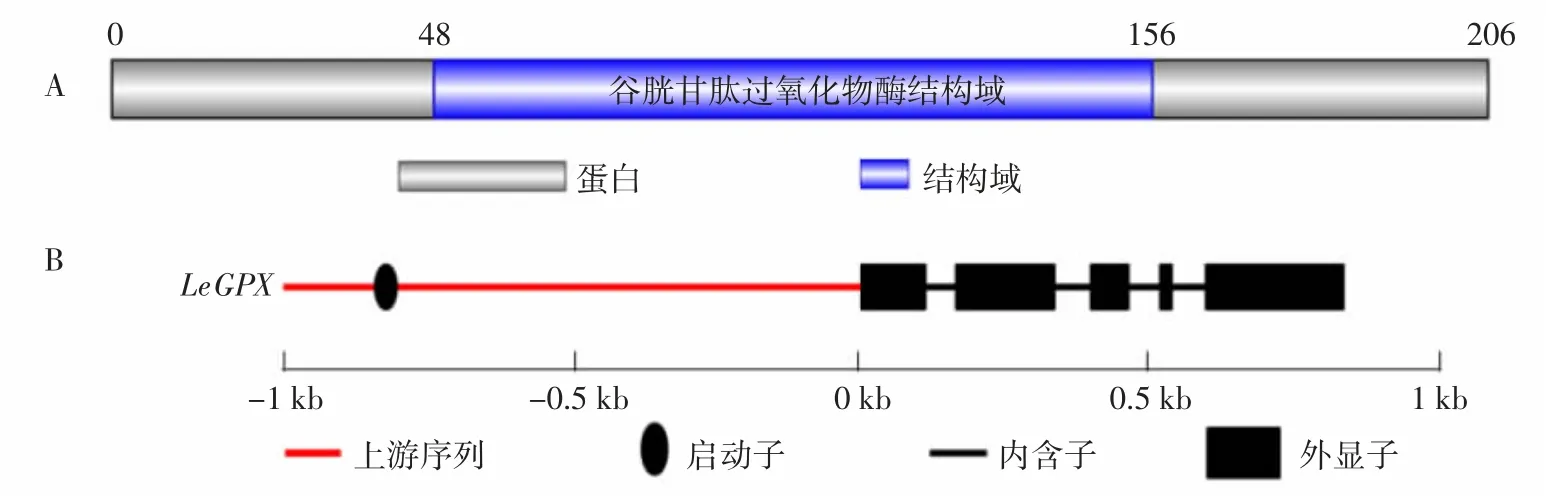
图1 LeGPX基因PFAM注释结果(A)及基因结构(B)Fig.1 PFAMannotation result(A)and gene structure(B)of LeGPX
2.2 LeGPX基因克隆
参照鉴定到的LeGPX基因序列设计用于扩增CDS的引物,以香菇cDNA为模板进行PCR反应,结果显示PCR产物符合预期大小(图2A);将克隆得到的序列与香菇基因组和转录组数据进行比对,结果显示所得序列与预测序列完全一致。为进一步验证克隆结果的可靠性,参照已公布的其他真菌GPX氨基酸数据构建了LeGPX蛋白系统发育树,结果显示LeGPX蛋白与小皮伞(Marasmiusfiardii)和灰色果腐菌(Moniliophthoraroreri)的GPX亲缘关系较近(图2B)。同时使用BioEdit软件对LeGPX、MfGPX和MrGPX蛋白的氨基酸序列进行同源比对分析,结果显示以上蛋白均包含3段GPX特征序列(NTASA(K)CGFT、I(V)L(V)AFPCNQF和KWNFEKFL(V))以及3个催化残基位点(图2C),符合GPX的一般特征[19]。以上结果证实已经成功克隆了香菇LeGPX基因。
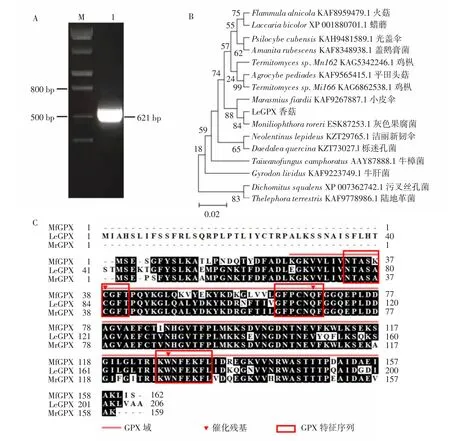
图2 LeGPX基因克隆(A)、系统发育分析(B)及蛋白同源比对分析(C)Fig.2 Gene cloning(A),phylogenetic analysis(B)and homologouscomparison(C)analysisof LeGPX
2.3 LeGPX蛋白生物信息学分析
2.3.1 LeGPX理化性质分析采用在线软件Sequence Manipulation Suite预测LeGPX蛋白的理化性质。LeGPX氨基酸残基数为206,其中亮氨酸(Leu,8.70%)、苏氨酸(Thr,7.80%)、丙氨酸(Ala,7.30%)和甘氨酸(Gly,7.30%)为该蛋白中占比最多的几种氨基酸;分子式为C1029H1599N269O301S8,分子量为22.811 kD;带正电荷氨基酸(精氨酸和赖氨酸)和带负电荷氨基酸(天冬氨酸和谷氨酸)数量分别为16和44,理论等电点8.83,为碱性蛋白;不稳定系数31.89(小于50),为稳定蛋白。
2.3.2 LeGPX蛋白二级结构和三级结构分析
使用在线软件Prabi对LeGPX蛋白的二级结构进行预测。LeGPX蛋白的二级结构以无规则卷曲(46.6%)和α-螺旋(29.1%)为主,延伸链和β折叠分别占17.5%和6.8%(图3A)。使用在线软件SWISS-MODEL对LeGPX蛋白的高级结构进行预测,结果显示无规则卷曲为该蛋白三级结构中最明显的组件;同时该蛋白三级结构中还存在3个可能的催化残基位点,与蛋白同源序列比对结果相符(图3B)。
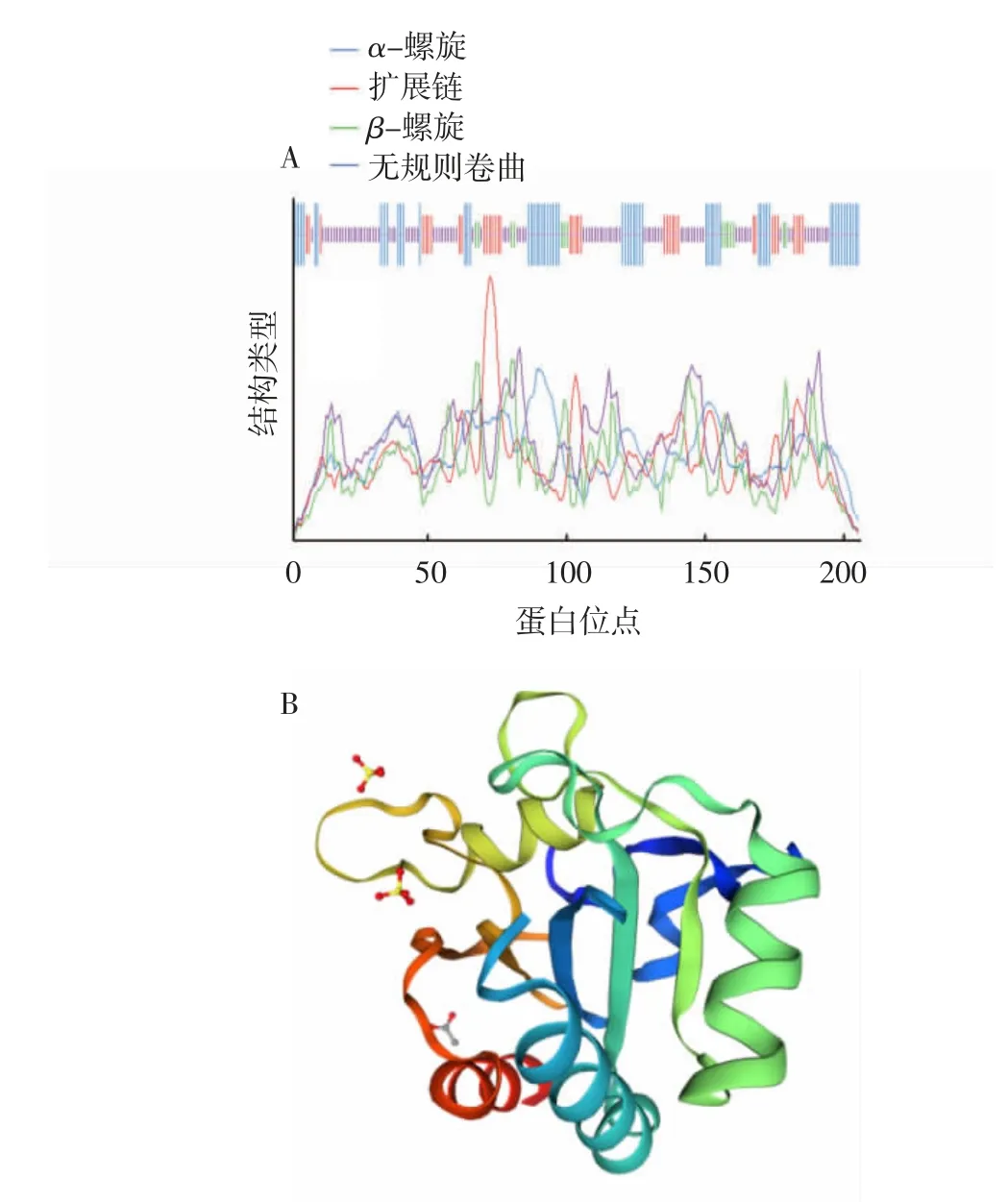
图3 LeGPX蛋白二级结构(A)和三级结构(B)预测结果Fig.3 Theprediction of secondary structure(A)and tertiary structure(B)of LeGPX protein
2.3.3 LeGPX蛋白亲水性分析
亲水性分析结果显示:LeGPX蛋白表面存在198个暴露的亲疏水基团,其中氨基酸残基第75位(缬氨酸)疏水性作用最强,为1.967;第98位(赖氨酸)疏水性作用最弱,为-2.511(图4)。整体来看LeGPX蛋白表面的总亲水位点数量(122个)多于总疏水位点(76个),整体疏水指数为-0.164(图4),说明该蛋白为亲水蛋白。

图4 LeGPX蛋白亲水性分析Fig.4 The hydrophilicity analysisof LeGPX protein
2.3.4 LeGPX蛋白细胞定位与信号肽分析
蛋白质在合成后需要转运至相应位置发挥作用,明确细胞定位对于探明其生物学功能具有重要意义。使用SignalP4.1 Server软件预测LeGPX蛋白信号肽,结果显示前60位氨基酸中最高信号肽分值(Max.C)、最高原始剪切位点分值(Max.Y)和最高综合剪切位点分值(Max.S)均小于0.5(图5A),且信号肽预测结果显示为不存在信号肽。使用在线软件TMpred Server预测蛋白跨膜结构域,结果显示该蛋白不存在跨膜结构(图5B)。综合信号肽和跨膜结构域预测结果可以说明LeGPX蛋白为非分泌蛋白,该蛋白在合成之后不进入内质网-高尔基体分泌系统,并且不存在进入其他细胞器的可能。使用在线软件Cell-Ploc分析其亚细胞定位情况,结果亦显示LeGPX蛋白定位于细胞质。
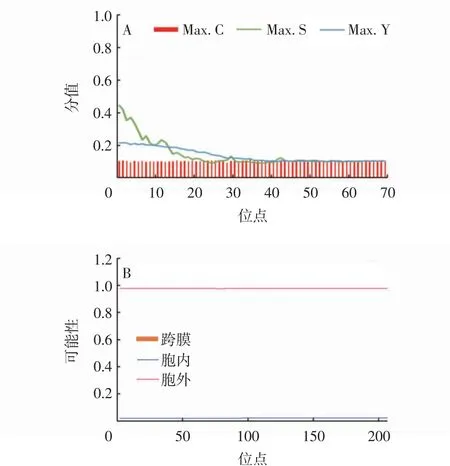
图5 LeGPX信号肽和跨膜结构域分析Fig.5 Signal peptide and transmembrane structural domain analysisof LeGPX protein
2.4 香菇GPX蛋白原核表达分析
将构建成功的pCOLD-ProS2-LeGPX载体转进Transetta感受态细胞,经低温结合IPTG诱导产生了大小约为50 kD的重组蛋白(图6中2~7泳道),并且对照组中未出现重组蛋白(图6中1泳道)。LeGPX-ProS2重组蛋白表达成功,并且外源IPTG浓度不会影响该重组蛋白的积累(图6中2~7泳道)。使用镍离子亲和纯化方法对上清蛋白进行纯化,结果发现采用50 mmol/L咪唑可有效洗脱LeGPX-ProS2重组蛋白(图7)。

图6 LeGPX蛋白原核表达Fig.6 Theprokaryotic expressionsof LeGPXprotein
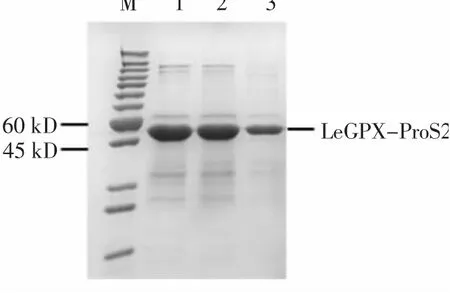
图7 LeGPX-ProS2重组蛋白纯化Fig.7 Purification of LeGPX-ProS2 recombinant protein
2.5 LeGPX基因在香菇采后贮藏期间的表达模式分析
香菇在采后贮藏期间会出现明显的褐变现象,有研究表明该现象的发生可能与代谢产物积累导致的氧化还原失衡有关。如图8A所示,香菇采后贮藏期间菌盖表面L*值呈逐渐下降趋势,反映在子实体上表现为表皮颜色由灰褐色逐步转变为黑色。菌肉部位发生褐变较晚,该部位L*值表现为贮藏初期无显著变化,至贮藏中期(12~16 d)和贮藏末期(20~24 d)出现两次显著下降(图8B)。通过相对表达量的分析发现,菌盖部位LeGPX基因表达量在贮藏期间整体呈先上升后下降的趋势,采后8、12、16、20、28d时LeGPX基因的相对表达量均显著高于贮藏初值(P<0.05),其中采后16、20 d时表达量达到初值12倍左右(图8C)。菌柄部位LeGPX基因在贮藏初期(4~8 d)即显著上调表达(15倍),贮藏12~28 d仍保持相对高表达状态(图8D)。整体来看,与菌盖部位相比,香菇采后贮藏期间LeGPX基因在菌柄部位表达更为活跃
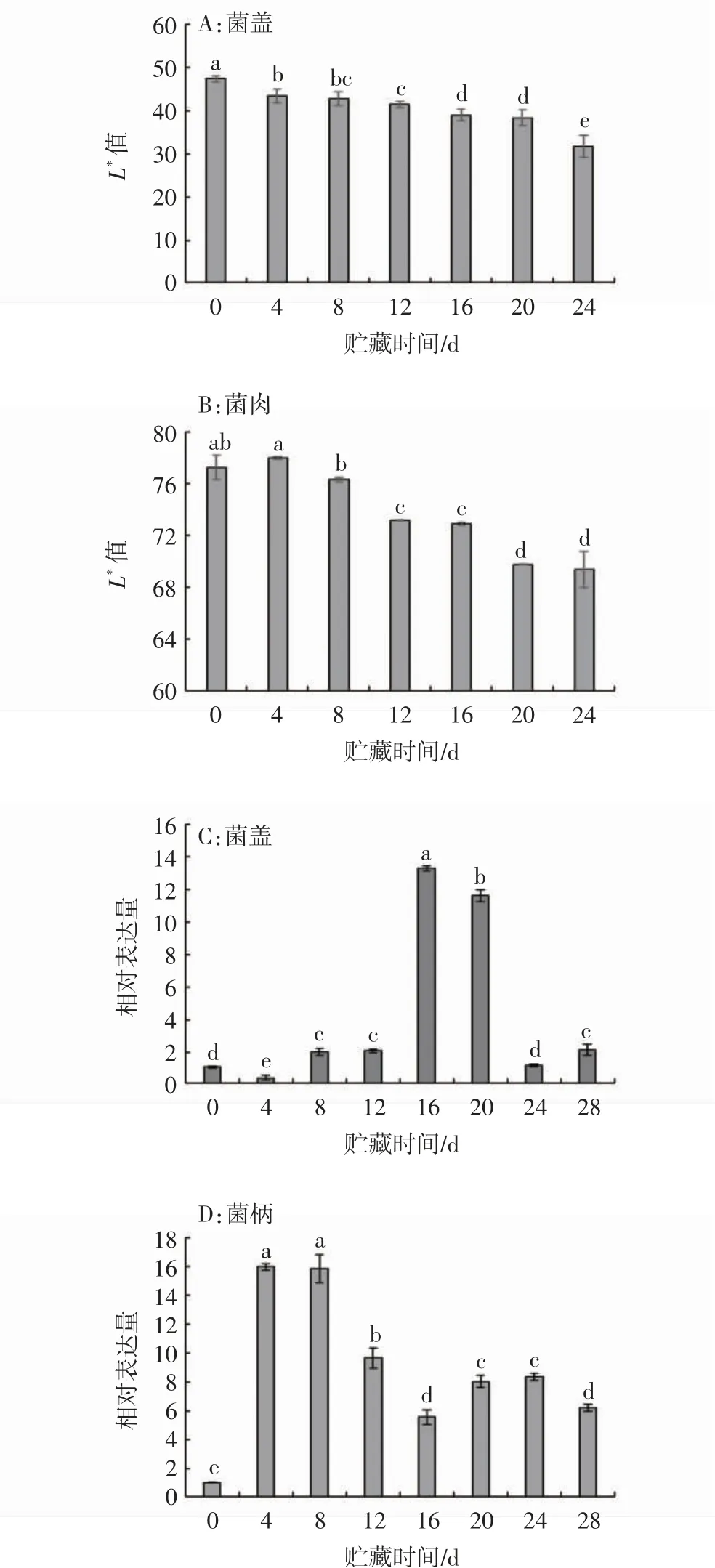
图8 香菇采后L*值及LeGPX基因相对表达量变化Fig.8 L*valuesand the relative expression levels changesof LeGPX gene in postharvest L.edodes
3 讨论与结论
真核生物氧化还原系统中存在丰富的抗氧化酶,其中POD是消除活性氧、酚类和胺类等氧化产物的关键酶[5]。目前动植物中已鉴定到的POD酶体包括辣根过氧化物酶(Horseradish peroxidase,HRP)、甲状腺过氧化物酶(Thyroid peroxidase,TPO)、血红素过氧化物酶(Heme peroxidase,HP)、木质素过氧化物酶(Lignin peroxidase,LiP)、锰过氧化物酶(Manganeseperoxidase,MnP)和GPX等,其中GPX为动物、植物和真菌共有[20]。动物GPX分子结构中一般含有1个硒代半胱氨酸,是酶分子中具有催化活性的作用位点;植物GPX与动物GPX序列高度相似,但是目前尚未发现含有硒的植物,其酶分子催化位点是半胱氨酸(Cystine,Cys)[21]。本研究通过基因克隆明确了LeGPX蛋白的氨基酸残基序列,通过同源序列比对发现其酶分子中的催化位点(Cys)与植物相同(灵芝以及草菇GPX研究中存在相同结果),并且催化活性区(NTASA(K)CGFT)和标志基序(I(V)L(V)AFPCNQF)也与其他植物GPX相似[19,22]。前期研究发现多种食用菌中均能检测到硒代半胱氨酸,结合香菇LeGPX催化位点特性,暗示其可能与植物GPX功能类似[23]。除此之外,本研究发现LeGPX蛋白不存在信号肽和跨膜结构域,是定位于细胞质的非分泌蛋白,该结果与多种植物GPX细胞定位情况相同[24]。
菌盖表皮和菌肉褐变是香菇采后贮藏期间的主要问题之一,目前对于该类褐变发生的机制尚无系统研究。荔枝表皮、鸭梨果心以及双孢蘑菇表皮采后褐变相关的研究中发现,褐变发生初始阶段机体的POD活性会迅速上升,褐变发生中期活性降低并保持平稳,褐变后期POD活性会随褐变程度加深而逐步升高;POD可能通过催化谷胱甘肽或酚类物质氧化引起呈色物质积累,进而造成机体发生褐变[4,25-26]。本研究发现菌盖和菌柄部位LeGPX基因在香菇发生褐变前期和末期均会出现显著上调表达,暗示该基因可能是造成香菇采后褐变的因素之一。本研究还发现,与菌盖部位相比LeGPX基因在菌柄部位更为活跃。脱离栽培基质后的菌柄可能承担为弹射孢子提供能量的作用,相比菌盖该部位代谢更为旺盛,由此造成的氧化损伤产物积累可能是引起香菇褐变发生的诱因。
本研究基于基因组数据鉴定并克隆了香菇LeGPX基因的编码序列,通过生物信息学分析明确了LeGPX蛋白的生物学特性,通过构建重组载体、原核表达和金属离子亲和纯化获得了LeGPX可溶蛋白,同时借助qRT-PCR方法明确了LeGPX基因在香菇褐变发生中的表达模式。以上结果为深入开展香菇采后褐变发生机制研究提供了基础。

