基于SEER数据库肺腺鳞癌淋巴结转移预测模型的构建
任昱恺,林宗祥,韦柏充,杨洋
(郑州大学第一附属医院 胸外科,河南 郑州 450000)
在过去的几十年里,肺癌是全球癌症相关死亡的主要原因之一,严重威胁着人类的健康[1]。腺鳞癌是一种相对罕见的肿瘤,仅占非小细胞肺癌的0.3%~5.0%,需要同时具有鳞状细胞癌和腺癌的成分[2]。与单一的肺腺癌和肺鳞癌相比,肺腺鳞癌的预后更差,因为其恶性程度更高,淋巴结的转移较其他肺癌相比更早,侵袭性也会更强[3]。癌症转移,也就是癌细胞从原发肿瘤部位扩散到其他组织或器官,并且开始恶性生长,转移是癌症相关死亡的最主要原因[4]。大多数的上皮原发性恶性肿瘤首先经过淋巴管进行扩散,并且到达相应区域引流的淋巴结进而发展为转移性生长[5]。肺癌淋巴结的转移受原发肿瘤的位置、大小、病理类型和分化程度等多种因素的影响[6]。目前,临床仅通过影像学检查来判断肺腺鳞癌术前淋巴结的转移与否缺乏有效的证据。因此,术前准确判断肺腺鳞癌的淋巴结转移情况对后续治疗有着极大的帮助。列线图是建立在多因素回归分析的基础上将多个由多因素回归模型筛选出的预测指标进行整合来对预测指标的风险评分进行个体化预测的工具模型,分数越高则表明淋巴结转移风险越高,被广泛用于临床上对疾病的预后评估中[7]。但目前缺乏预测肺腺鳞癌淋巴结转移的切实有效的模型。本研究基于SEER数据库建立预测肺腺鳞癌淋巴结转移的模型,用来帮助临床医生制定更好的治疗以及随访计划,有助于改善肺腺鳞癌患者的预后。
1 资料与方法
1.1 研究对象 本研究是一项回顾性的分析研究。搜集SEER数据库中2004—2015年肺腺鳞癌的临床数据,通过筛选共纳入2 669例患者作为研究对象(图1)。收集的资料包括种族、诊断年龄、性别、肿瘤位置、分化程度、TNM分期、肿瘤最大径、生存时间及死亡原因。
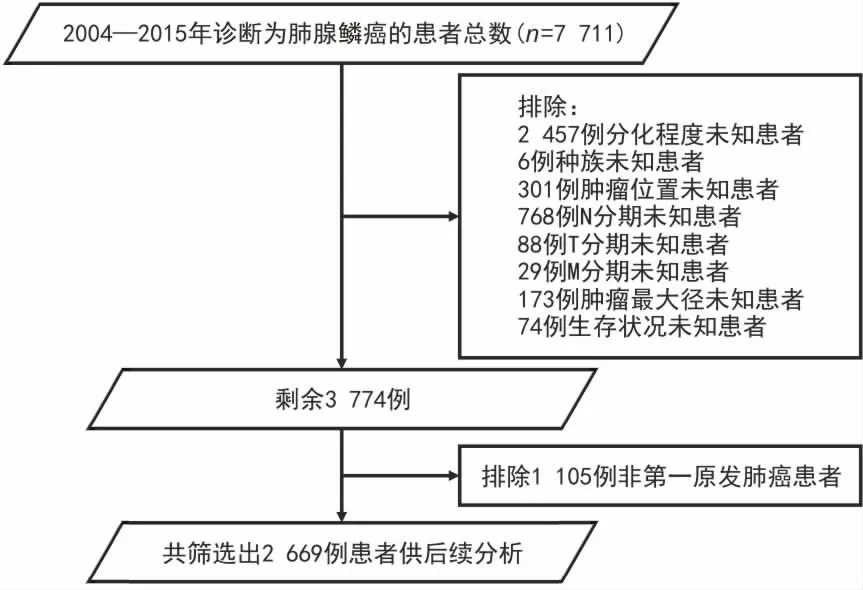
图1 SEER数据库患者的筛选流程图
1.2 纳入与排除标准 (1)纳入标准:①病理诊断为肺腺鳞癌;②临床信息完整;③年龄≥18岁。(2)排除标准:①临床/病理信息缺失或不明确;②非第一原发肺癌。
1.3 研究方法 收集患者的临床资料,包括性别、年龄(≤65岁、>65岁)、种族(白种人、黑种人、其他人种)、肿瘤位置(主支气管、上叶、中叶、下叶)、分化程度(Ⅰ、Ⅱ、Ⅲ、Ⅳ)、T分期(T1、T2、T3、T4)、M 分期(M0、M1)以及肿瘤最大径(≤3 cm、>3~5 cm、>5~7 cm、>7 cm)。首先进行单因素和多因素logistic回归分析,剔除与肺腺鳞癌淋巴结转移无关的变量,之后构建模型并绘制列线图,并对列线图进行验证来评判模型的准确性以及敏感性。
1.4 统计学方法 使用Excel表对数据进行收集和整理,使用SPSS 26.0、Graphpad Prism 8和R 4.1.1进行统计分析和绘图。首先将总数据集按7∶3比例分为训练集和测试集,在训练集上进行模型的构建,使用测试集对模型进行验证。使用单因素和多因素logistic回归分析筛选潜在影响淋巴结转移的变量并用于列线图模型的构建,分别在训练集和测试集构建一致性指数、受试者工作特征(receiver operating characteristic,ROC)曲线和校准曲线对预测模型进行评价。所有的统计检验均为双侧,P<0.05为差异有统计学意义。
2 结果
2.1 患者特征 共纳入了2 669例患者的临床信息,其中有1 486例(55.7%)淋巴结未转移的患者,1 183例(44.3%)患者发生淋巴结转移。训练集包括1 869例患者,测试集包括800例患者。全部病例的临床特征见表1。
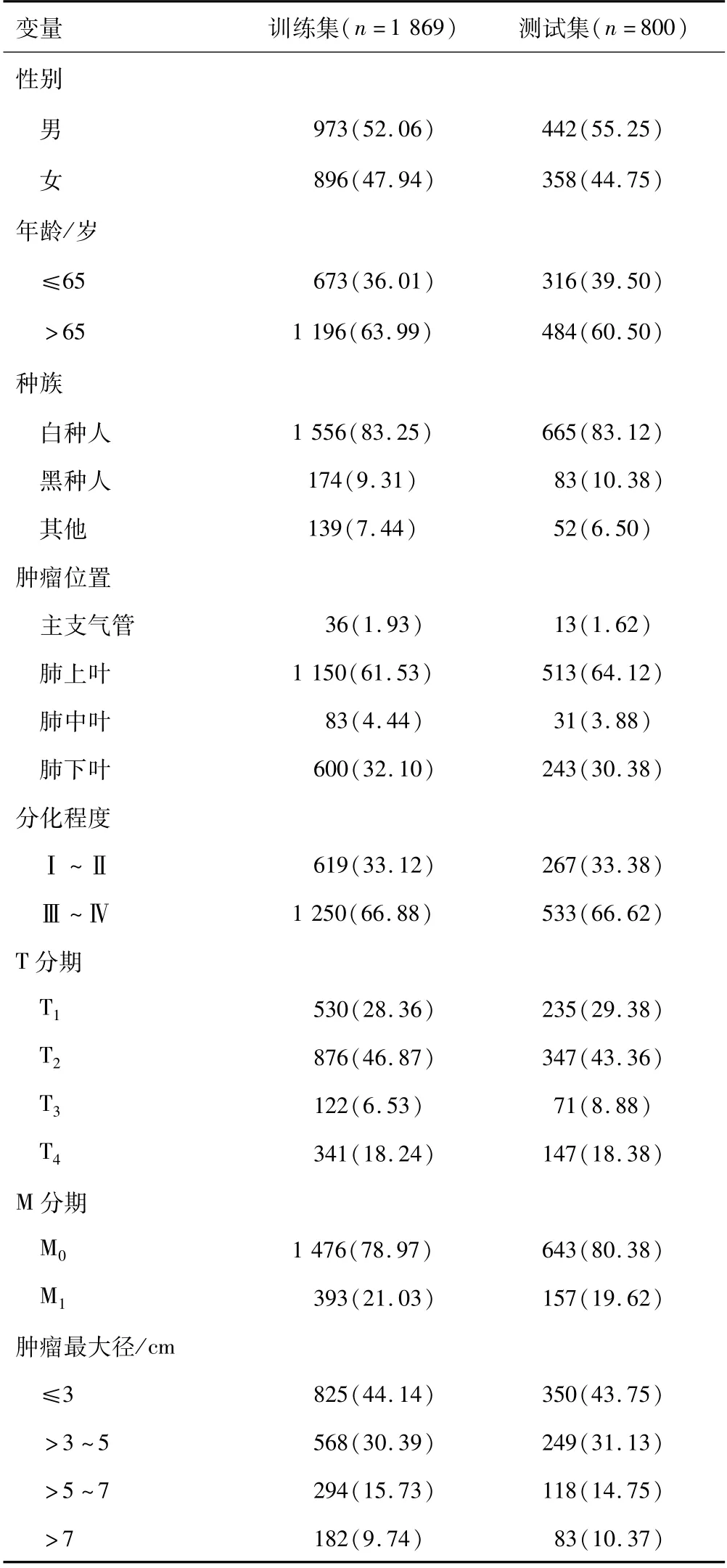
表1 患者的临床病理特征[n(%)]
2.2 肺腺鳞癌淋巴结转移的危险因素
2.2.1 单因素分析 单因素logistic回归分析结果显示,性别与肺腺鳞癌淋巴结转移无关(P>0.05),年龄、种族、肿瘤位置、分化程度、T分期、M分期以及肿瘤最大径与肺腺鳞癌淋巴结转移有关(P<0.05)。见表2。
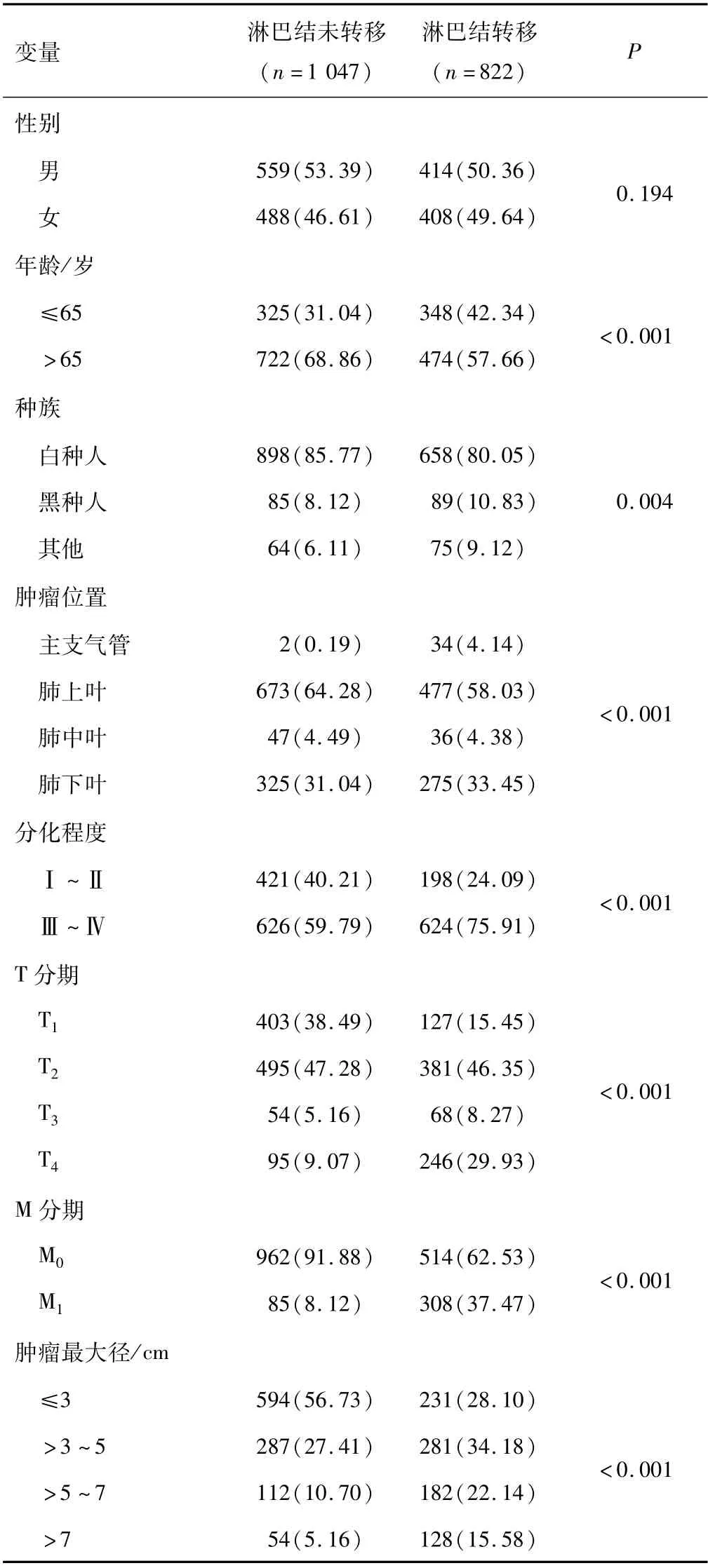
表2 肺腺鳞癌淋巴结转移危险因素的单因素分析结果[n(%)]
2.2.2 多因素分析 将性别这个无关变量剔除后,将2.2.1处其他变量共同纳入多因素logistic回归分析中,结果显示,年龄、肿瘤位置、分化程度、T分期、M分期以及肿瘤最大径均为肺腺鳞癌淋巴结转移的独立影响因素(P<0.05)。见表3。

表3 肺腺鳞癌淋巴结转移危险因素的多因素分析结果
2.3 列线图的构建与验证 基于多因素logistic回归分析筛选出年龄、肿瘤位置、分化程度、T分期、M分期和肿瘤最大径这6个独立影响因素的预后指标,用于构建肺腺鳞癌淋巴结转移模型,使用列线图的形式表现出来(图2)。当肿瘤位于主支气管时,淋巴结转移的概率达到100.00%。患者存在远处转移时,即M1期的淋巴结转移概率基本也达到了100.00%。此外,T分期和肿瘤最大径与淋巴结转移的风险也有关。进行训练集和测试集ROC曲线(图3)、校准曲线(图4)的绘制,可以看到训练集和测试集的一致性指数分别为0.766(95% CI:0.744~0.788)、0.742(95% CI:0.707~0.777),说明该模型预测精度较高。训练集及测试集的校准曲线基本达到了45°,说明模型的预测发生率与实际结果具有良好的一致性(图4)。
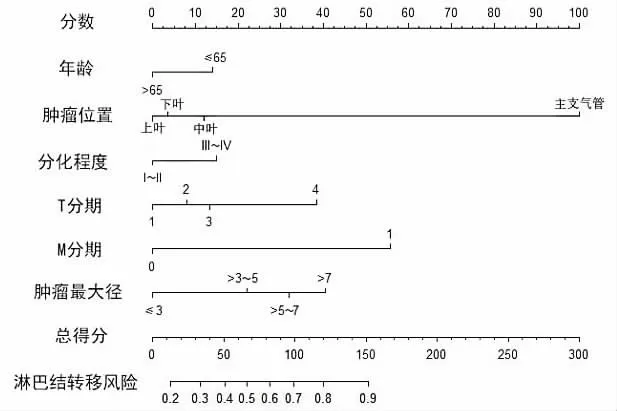
图2 预测肺腺鳞癌淋巴结转移的列线图

图3 训练集(A)和测试集(B)的ROC曲线
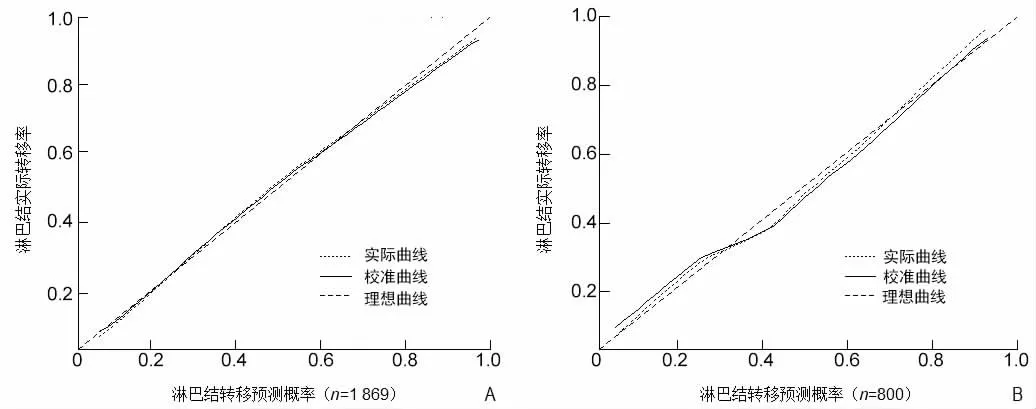
图4 训练集(A)和测试集(B)的校准图
3 讨论
肺腺鳞癌的发病率相较于其他类型的肺癌比较低,仅占所有肺癌病例数的0.4% ~4.0%[3]。虽然肺腺鳞癌与其他常见的肺癌的部分临床特征相似,但是肺腺鳞癌有自身的特点,其进展较快,侵袭性较强,易早期发生转移,而且淋巴结转移概率较高[8]。与鳞状细胞癌和腺癌相比,肺腺鳞癌的肿瘤体积更大,同侧多发结节更多见,而且血管、神经或淋巴管的侵袭倾向更高[9]。
肺腺鳞癌相较于肺腺癌和肺鳞癌的淋巴结转移率更高。本研究基于2004—2015年的SEER数据库共纳入2 669例诊断为肺腺鳞癌的患者,这些肺腺鳞癌患者的淋巴结转移率达到了44.3%。目前有很多研究也报道了肺腺鳞癌的淋巴结转移率更高,如Maeda等[10]报道了肺腺鳞癌相比于单纯组织学型为肺腺癌的患者有更高、侵袭性更强的淋巴结转移率,而与单纯组织学型为肺鳞癌的患者相比,淋巴结转移率无显著差异。Kong等[11]通过免疫组化和HE染色等方法对1 156例手术切除的肺癌患者的淋巴结转移情况进行了回顾性分析,其中有49例肺腺鳞癌患者,26例(53.1%)肺腺鳞癌患者存在淋巴结转移,肺腺鳞癌的N2期淋巴结转移率(40.5%)远远高于肺腺癌(18.7%)和肺鳞癌(21.6%)。
目前预测肺腺鳞癌的淋巴结转移风险模型的研究比较少。本研究通过单因素以及多因素logistic回归分析筛选出包括年龄、肿瘤位置、分化程度、T分期、M分期以及肿瘤最大径这6个变量作为肺腺鳞癌淋巴结转移的危险因素,之后进行模型构建并绘制列线图进行可视化。列线图结果显示淋巴结纳入的6个变量中,肿瘤位置、T分期、M分期以及肿瘤最大径与淋巴结转移有关。既往有研究发现肿瘤最大径是淋巴结转移的独立预测因子,肿瘤最大径越大,淋巴结转移的风险越大[12],这与本研究得出的结论相似。在第8版的TNM分期中,肿瘤最大径为3 cm被定义为T1和T2的分界线。在临床中,外科医生也将肿瘤最大径3 cm作为评估患者病情严重性的重要指标。Yu等[13]研究报道了肿瘤最大径≤1.0 cm的淋巴结转移率为3.2%,最大径为1.0~2.0 cm的肿瘤的淋巴结转移率为14.5%,瘤体最大径为2.0~3.0 cm的淋巴结转移率约为31.1%。Kanzaki等[14]对2006—2009年在大阪癌症心血管疾病医疗中心胸外科的非小细胞肺癌患者在术前对淋巴结的分期进行了回顾性评估,发现肿瘤最大直径超过3 cm是淋巴结转移的危险因素。Xue等[15]回顾性分析了2008—2013年在首都医科大学附属北京世纪坛医院接受手术切除的非小细胞肺癌患者的淋巴结转移特点,发现最大肿瘤直径大于2.85 cm的淋巴结转移风险小于2.85 cm的3倍左右,还发现65岁以下的非小细胞肺癌患者比65岁以上的患者更容易发生淋巴结转移,这与本研究结果相似。从本研究构建的列线图中可以发现年龄与淋巴结转移的风险呈负相关。这可能是由于肿瘤的生长和转移依赖于足够的血液供应。年龄小的患者拥有着血流和淋巴回流更加丰富的微环境,这可能导致了年龄小的患者相较于年龄大的患者更容易发生淋巴结转移[16-17]。随后对模型进行验证,训练集和测试集的C指数分别是0.766和0.742,训练集和测试集的校准曲线均接近完美曲线,这些结果表明了本研究构建的模型是可靠且敏感的。
虽然本研究纳入的数据量较大且经过验证有一定的可靠性,但仍存在一定的局限性。首先,本研究是基于SEER数据库的一项回顾性研究,无法获得患者的某些信息,会产生一定的偏倚。其次,由于缺乏其他数据库的数据支持,本研究中创建的模型仅在内部进行验证,未进行外部验证。
年龄、肿瘤位置、分化程度、T分期、M分期以及肿瘤最大径为肺腺鳞癌淋巴结转移的影响因素。通过绘制列线图进行可视化处理,并绘制ROC曲线和校准曲线进行验证,验证的结果表明本模型是可靠且敏感的,可以为临床预测肺腺鳞癌的淋巴结转移提供重要的参考价值。

