骨髓间充质干细胞复合仿生骨支架成骨效应的研究
李坡,程威,王家强,姚伟涛,徐云强,李瑞欣,张西正
(1.郑州大学附属肿瘤医院 骨与软组织科,河南 郑州 450008;2.河南中医药大学郑州人民医院 骨科,河南 郑州 450053;3.天津医科大学总医院 骨科,天津 300052;4.军事科学院系统工程研究院卫勤保障技术研究所 骨组织工程实验室,天津 300161;5.天津市口腔医院 中心实验室,天津 300041)
随着组织工程学的发展,将组织、基质、生长因子、干细胞和发育生物学、材料科学和生物信息学等这些学科融合与应用,以达到促进组织修复和再生的目的[1]。通过处理组织工程材料,作为种子细胞良好的基质,将细胞核生物材料共培养,加入生物活性因子或基因诱导剂或沉默剂,便于移入体内,帮助恢复组织器官的结构及功能。骨髓间充质干细胞(bone marrowmesenchymal stem cells,BMSCs)是骨髓内存在的一类非造血干细胞,为起源于中胚层的成体干细胞,具有自我更新层起源的多种细胞及多种间质组织,如骨、软骨、脂肪、韧带、骨髓造血组织等[2]。间充质干细胞的特性使其逐渐被用于更多的组织再生过程中。有研究表明,BMSCs甚至可以分化为神经组织等[3],具备多向分化潜能并可在不同调控下分化为中胚层。目前骨组织工程材料较多,各种有机材料如丝素蛋白、胶原蛋白以及无机材料羟基磷灰石等被大量研究。胶原蛋白大致分为3种,人体胶原蛋白形式主要以Ⅰ型胶原为主[4],丝素蛋白衍生自天然蚕丝[5-6],羟基磷灰石是人体骨主要的无机材料[7]。这3种材料有其优缺点,通过将其复合能弥补单一材料的不足,是构建骨组织工程的良好材料。本实验基于前期对材料相关研究[8]的基础上,选取丝素、胶原蛋白以及羟基磷灰石3种材料,将其均匀混合,并根据计算机软件设计三维模型,将3种共混复合材料通过3D打印为三维多孔结构材料。通过将提取的BMSCs接种到不同大小的支架上,探讨本实验制备的复合仿生骨材料生物相容性及其成骨诱导性,为组织工程骨的筛选提供一种良好的、可降解的生物材料。
1 材料与方法
1.1 动物 1月龄新西兰大白兔1只,雄性,重量1.5 kg,由军科院动物中心提供,动物合格证号为SYXK(津):2016-0012。本研究通过军事医学科学院动物伦理审查。
1.2 主要试剂 低糖DMEM培养液(Gibco公司),胎牛血清(优级),胰蛋白酶(联星生物制品有限公司),Percoll淋巴细胞分离液(Pharmacia公司),16号骨穿刺针(苏州医疗设备厂)。
1.3 实验方法
1.3.1 BMSCs的原代培养 在无菌条件下利用骨髓穿刺针穿刺麻醉好的新西兰大白兔的胫骨上端,抽取骨髓约3 mL,与DMEM培养液1∶4稀释成细胞悬液,在离心半径为160 mm的离心机中,1 000 r·min-1离心5 min后重悬细胞。Percoll工作液分离重悬细胞,放置于体积分数为5%的CO2、饱和湿度、37℃的孵箱中,24 h后半量换液,每3 d换液1次。
1.3.2 细胞形态学观察及组织化学特性鉴定 在培养的不同天数,利用倒置显微镜观察BMSCs的贴壁情况、克隆形成以及不同代的骨髓干细胞增殖生长情况。取P3代BMSCs 80%融合的细胞爬片,经过磷酸盐缓冲液(phosphate buffer solution,PBS)漂洗,40 g·L-1的甲醛固定,1% TritonX-100、PBS漂洗,分别行碱性磷酸酶(alkaline phosphatase,ALP)染色、糖原染色、脂肪染色、α-醋酸萘酚酯酶染色,以及兔抗CD44和CD54多克隆抗体(Ⅰ抗,赛默飞)、生物素化山羊抗兔IgG(Ⅱ抗,赛默飞)、二氨基联苯胺(diaminobenzidine,DAB)显色,倒置显微镜下观察、拍照。
1.3.3 丝素蛋白的制备及Ⅰ型胶原蛋白的制备 将蚕丝脱胶、干燥后备用。配制CaCl2·CH3CH2OH·H2O(1∶2∶8)三元溶液,溶解蚕丝,将溶解液透析、浓缩,得到稳定的丝素蛋白溶液。将新鲜牛肌腱粉碎,通过浸泡及胃蛋白酶的乙酸溶液溶解,经0.15 mol·L-1的NaCl溶液盐析,透析后收集胶原蛋白。
1.3.4 丝素蛋白/Ⅰ型胶原/纳米羟基磷灰石三维支架的制备 将丝素蛋白、Ⅰ型胶原、羟基磷灰石这3种生物材料按3∶9∶2混合,在乙酸中溶解均匀,利用设计软件CAD设计3D支架模型,按照模型进行低温打印。经过冷冻干燥3 d后,形成稳定的三维立体支架,Co60灭菌后低温冷冻保存备用。
1.3.5 三维支架的X衍射及红外光谱分析 将三维支架粉碎成微小的颗粒,采用300目的滤网过滤,采用广衍射角2θ为5°~90°,利用D8Advance型X射线衍射仪、Spectrum100红外光谱仪及Origin8.0记录超能探测计数器得到的衍射强度及红外光谱。
1.3.6 BMSCs与支架复合培养 将融合度到80%的BMSCs接种到1cm支架和2cm支架的复合培养组以及不接种的空白组,按照每个支架1×105个接种。将3组置于放置于体积分数为5%的CO2、饱和湿度的孵箱中4h后,待细胞贴壁后加入培养基,定期更换。
1.3.7 三维支架上BMSCs形态学观察 在培养的不同时期,利用戊二醛、锇酸将空白支架、细胞/支架复合物固定,利用扫描电子显微镜(scanningelectronmicroscope,SEM)观察细胞生长情况。将空白组及复合培养组用甲醛固定,染色,用于苏木精-伊红(hematoxylin-eosin,HE)成像。
1.3.8 三维支架上BMSCs的增殖和ALP活性测定三维支架BMSCs上生长的第3、5、7、14天,用MTT及ALP测定试剂盒(南京,建成)测量细胞增殖活性及ALP活性。
1.3.9 逆转录聚合酶链式反应(reversetranscription polymerasechainreaction,RT-PCR)及WB检测成骨分化相关基因、蛋白水平 复合培养3d和7d后终止培养,收集细胞,经过RNA裂解液提取,逆转录、扩增,利用逆转录试剂盒(赛默飞)及RT-PCR技术检测ALP、骨钙素(osteocalcin,OCN)、骨形态发生蛋白-2(bonemorphogeneticprotein-2,BMP-2)等目的基因的相对表达含量,利用一抗、二抗(赛默飞)及WB技术检测相关蛋白水平。
1.4 统计学方法 采用SPSS22.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,本实验方法为多组设计,采用单因素方法分析(ANOVA)进行比较,组间差异则进一步采用Bonferroni法进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学鉴定及细胞组织化学特性 培养2d,通过倒置显微镜可见部分细胞贴壁,部分细胞漂浮死亡(图1A)。培养5~7d,通过倒置显微镜可见细胞较前明显增多(图1B)。培养14d,可见细胞体积变大,核/浆比大,核居中,细胞核疏松,少数细胞可见2~3个核仁,细胞长满瓶底。常规传代,传至第6代,可见细胞克隆,体积扩大,相互融合成片状,细胞形态呈椭圆形,边缘圆润(图1C)。通过染色可见ALP染色(-)(图1D),细胞表面标志物CD44、CD54染色呈阳性(图1E、1F),α-醋酸萘酚酯酶染色(+)(图1G),糖原染色(+)(图1H),脂肪染色(-)(图1I)。
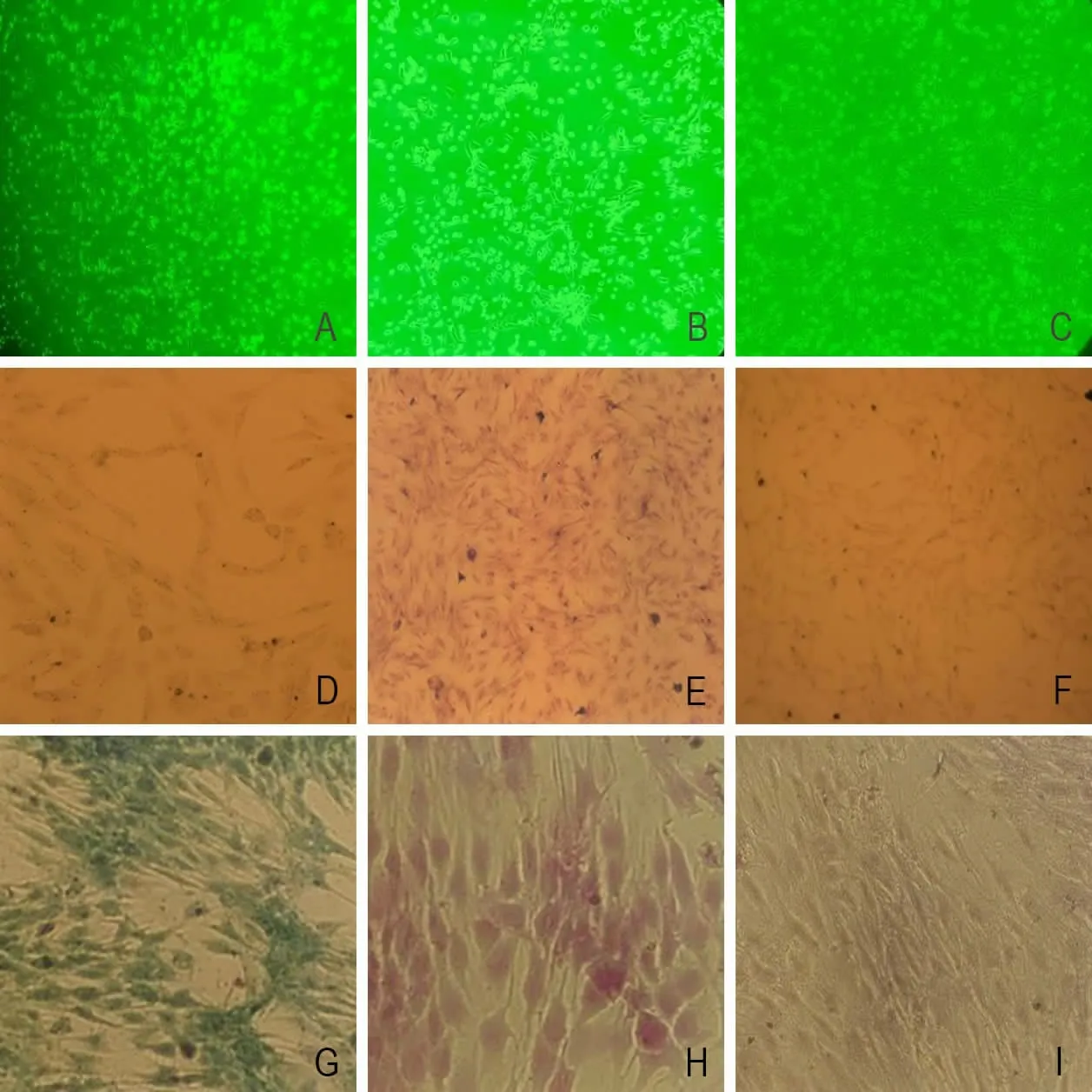
图1 细胞形态学及细胞免疫组化染色
2.2 X-衍射及红外光谱测定二级结构变化 X-衍射(图2A)结果显示,混合材料主要在19.2°、45.12°、58.38°以及73.53°出现较强的衍射峰,说明复合支架主要以无规卷曲和α螺旋结构共存。图2A显示3种材料混合后未产生新的衍射峰,未产生新二级结构。在图2B中可以观察到此支架的吸收峰主要集中在1 635 cm-1(酰胺Ⅰ)、1 586 cm-1(酰胺Ⅱ)、1 102 cm-1(酰胺Ⅲ)以及701 cm-1(酰胺Ⅴ)处,这些是β-sheet吸收峰的主要所在位置。
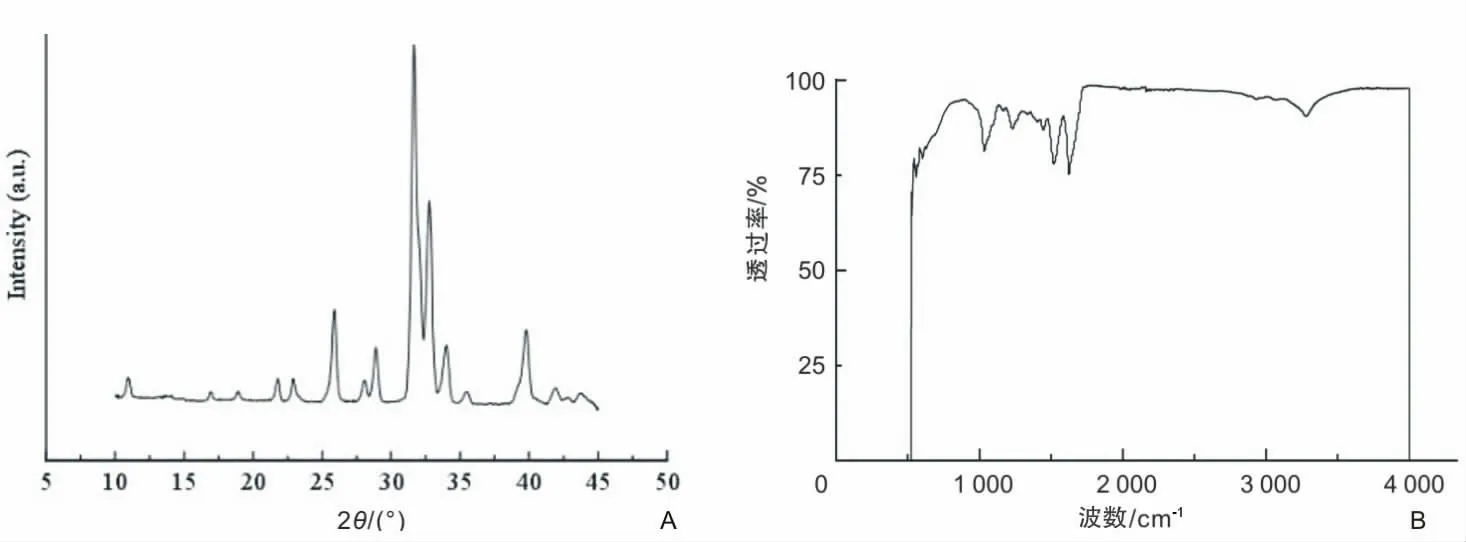
图2 三维支架的X-衍射及红外光谱
2.3 SEM 及HE观察细胞在支架表面的形态 将空白支架及细胞/支架复合物复合培养3 d后,SEM(图3)显示空白支架呈孔隙网状结构,孔径大小为(506.37±60.35)μm,孔隙连通性良好,细胞可以良好黏附在支架上生长。HE(图4)显示,空白支架内部疏松多空,细胞黏附于支架孔径周围生长,成梭形状,2 cm支架培养组下拨数目明显多于1 cm支架培养组。
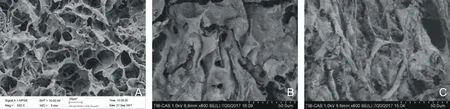
图3 SEM观察细胞在支架生长情况

图4 HE染色观察细胞在支架生长情况
2.4 复合支架上的成骨细胞增殖情况及ALP活性的测定 MTT(图5A)及ALP(图5B)结果显示,复合培养组实验初期细胞增殖、ALP水平均大于空白组(P<0.05),2 cm支架培养组实验晚期细胞增殖、ALP水平均大于1 cm支架培养组及空白组(P<0.05)。

图5 细胞增殖及ALP水平情况
2.5 复合培养对成骨分化相关基因、蛋白表达的影响 如图6所示,在实验初期,复合培养组成骨相关基因表达水平高于空白组(P<0.05),但复合培养组之间比较,差异无统计学意义(P>0.05);在实验的晚期,2 cm 支架培养组成骨相关基因表达水平(ALP、OCN、BMP-2)高于1 cm支架培养组及空白组(P<0.05)。蛋白水平表达情况及相对蛋白水平检测结果如图7A、7B所示,同mRNA水平变化一致。
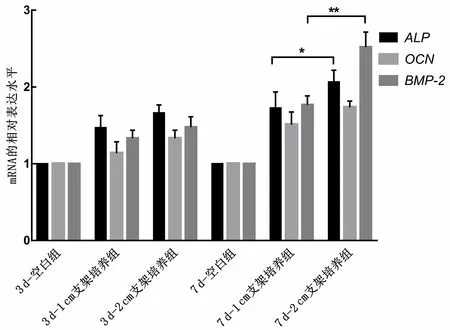
图6 复合培养下成骨细胞分化相关基因表达情况
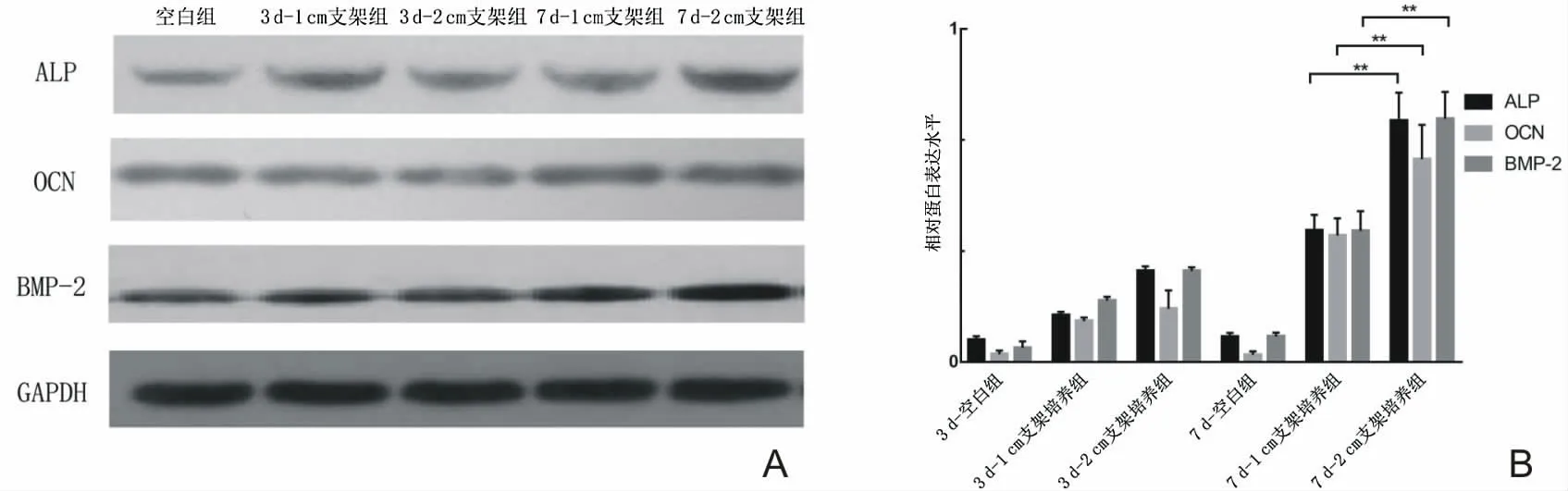
图7 复合培养下成骨细胞分化相关蛋白表达情况
3 讨论
骨髓中有许多种细胞成分,除基质细胞等已成熟分化的细胞外,还有BMSCs和造血干细胞。间充质干细胞属于混杂细胞群,它表达间质细胞、内皮细胞及表皮细胞的标志,包括黏附分子(CD44、CD54、CD106等)、生长因子及其受体(白细胞介素-1受体、白细胞介素-2受体、IFN-CR等)、整合素家族及成员(CD29、CD49a等)以及其他表面标志(CD90、CD105等)[9]。本实验所采用的CD44、CD54均为BMSCs的表面标志,是介导细胞与细胞间或细胞与细胞外基质间进行接触和结合从而进行信息交流的黏附分子表面抗原。CD54抗原为细胞间黏附分子,属于免疫球蛋白超基因家族一员,由5个Ig样位点功能区结构,第一、二功能区为淋巴细胞功能相关抗原-1,在淋巴细胞和造血细胞的产生中发挥作用,以及参与并调控炎症反应,间接为BMSCs的归巢创造了微环境[10]。
CD44是一类黏附分子家族的跨膜糖蛋白,具有Ⅰ型胶原蛋白、纤维粘连蛋白等细胞外基质分子的结合位点,通过与骨架的作用以及胞体氨基酸磷酸化和去磷酸化,使BMSCs与胞外基质蛋白结合,从而激活体内淋巴细胞、介导细胞间的多种信号传导以及促进细胞黏附等多种生物学功能[11]。目前未发现BMSCs的特异性标志物。一般认为细胞黏附分子CD44(HCAM)、CD54(ICAM-1)是BMSCs的重要标志物[12-13]。
本文图1显示,细胞增殖到第6代后,BMSCs就开始逐渐各向分化,细胞核变大,各向异性增加,随着传代次数的增加,增殖能力逐渐降低,这也是目前限制BMSCs大量应用的原因。目前骨组织工程中所用的材料有很多种,包括天然材料(蚕丝、胶原蛋白等)、合成材料(聚乳酸等)[14-16]及复合材料。但是单一的材料往往不能满足细胞生长的需要[17-18]。因此,骨组织工程材料应具有良好的性能及结构,如在体内为细胞提供黏附和生长的环境以及替代骨缺损部位的力学功能[19]。本课题组采用丝素蛋白、胶原蛋白、羟基磷灰石制备的三元复合材料,改变了降解、力学性能差、力学强度不足、材料脆性大等缺点[20]。在本文图2中,利用X-衍射及红外光谱可以知道,此三维支架主要以无规卷曲和α螺旋结构及β-sheet共存,说明本实验材料在混合中未产生新的结构,并且可以稳定存在及结晶,为细胞植入支架提供了良好的空隙及支撑。本实验采用BMSCs体外培养,通过接种于支架上,观察细胞的活性、黏附生长情况,经过一系列体外生物相容性实验发现,支架材料具有良好的生物相容性,无毒性,无免疫排斥反应,同时可以观察到细胞良好生长在支架上,并且随着培养时间的延长,相关成骨基因及蛋白的表达量明显升高。复合培养组虽然接种了相同的细胞数目,但在实验的中晚期,可以观察到2 cm复合培养组的细胞数目及成骨相关基因及蛋白表达均高于1 cm组。这可能是因为2 cm支架提供了更充足的空间与黏附面积。因此,本实验的支架材料可很好地促进成骨细胞的黏附、增殖以及分化,符合生物材料植入体内的无细胞毒性和良好生物相容性的要求[21]。
本实验证明了制备丝素蛋白/胶原蛋白/羟基磷灰石复合材料具有良好的相容性,细胞能在支架上良好的黏附、增殖,细胞主要集中在支架的孔壁周围,并且随着培养时间的延长,成骨分化相关基因的表达量以及蛋白表达量都逐渐升高,从而表明本实验室制备的支架有诱导成骨分化的能力。本实验制备的生物蛋白可降解支架可为组织工程骨的建成提供一种新的方式。

