山羊痘病毒晚转录因子VLTF-1的原核表达及生物信息分析
张 成,王玉婷,杨勇飞,柳 璇,吴锦艳,尚佑军,李有文*
(1.塔里木大学动物科学学院 新疆生产建设兵团塔里木畜牧科技兵团重点实验室,新疆 阿拉尔 843300;2.塔里木大学动物科学学院 新疆生产建设兵团南疆动物疫病诊断与防控工程实验室,新疆阿拉尔 843300;3.中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046)
羊痘(capripoxvirus disease)是由羊痘病毒引起一种羊口腔、唇部、乳房等部位出现痘疹的急性、烈性传染病[1-2]。羊痘发病率高,羔羊感染率达到100%,病死率可达80%;成年羊病死率相对较低,但可引发其他病原微生物的感染[3-4]。羊痘在世界各地广泛流行,羊痘病毒对我国的危害较为严重,尤其是在养羊业发达的地区,可对我国养殖业造成巨大的经济损失[2]。山羊痘病毒是在胞质内复制的双链DNA病毒,电镜下可观察到卵圆形或砖形颗粒,大小约194~200 nm[5-8],基因组中含有147个开放式阅读框(open reading frame,ORFs),分为核心编码区和侧翼区。核心编码区参与病毒复制、细胞内成熟和细胞外包膜病毒体构成和组装、RNA修饰和病毒的转录[9],而侧翼区主要与病毒的毒力和宿主免疫逃避有关。
转录因子是一种特殊的蛋白质,能够调控基因、表达相关的功能蛋白,与启动子中顺式作用原件相互结合的DNA蛋白[10-12]。基因的前段含有转录因子(transcription factor,TF)的结合位点,与转录因子DNA结合后对基因的表达具有一定的作用[13-17]。晚转录因子(VLTF)是生化反应后期起理化作用的转录因子。羊痘病毒含有4个晚期转录因子,其中两个中期转录因子VLTF-3(GTPV-099、115)均位于病毒的核心区。因此,转录因子在病毒转录复制过程中意义重大。本研究构建了VLTF-1的原核表达载体并进行了蛋白表达,为进一步了解羊痘病毒晚转录因子1(VLTF-1)的生物学特性,系统研究羊痘病毒的转录机制和转录因子的功能、特性提供参考。
1 材料与方法
1.1 试验材料
山羊痘病毒SS株、原核表达的DH5α、BL21感受态细胞,保存于塔里木畜牧科技重点实验室。
1.2 试剂与仪器
主要试剂:PCR Mix(纽英仑生物科技公司)、Prime STAR聚合酶(大连宝生物科技公司);EcoR1、Xho I等限制性内切酶以及dNTPs、PCR试剂(Thermo生物科技公司);琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒(OMEGA生物科技有限公司)等。
主要仪器:干式恒温箱(杭州奥盛仪器有限公司)、DK-8D电热恒温水槽(上海精宏实验设备有限公司)、伯乐T100梯度PCR仪(北京智杰方远有限公司)、凝胶成像分析系统(ChemiDoc XRS)。
1.3 试验方法
1.3.1 引物设计
根据GenBank上发表的山羊痘病毒Pellor株(登录号:NC-004003.1)的基因序列,利用DNAstare软件对VLTF-1基因设计一对合理的、特异性强的引物。为便于载体构建,在引物5'端添加酶切切位(划线处);引物送往上海生工生物工程股份有限公司合成。引物合成信息见表1。

表1 引物合成Tab.1 Primer synthesis table
1.3.2 羊痘病毒SS基因组的提取
取2 cm2的病料、5 mL维持液、0.5 mL青霉素、0.5 mL链霉素和适量高压灭菌的石英砂,充分研磨病料后4℃保存过夜,4 000 r/min离心5min。取200~300μL按照Ezup柱式病毒DNA抽提试剂盒说明书提取DNA,检测浓度。
1.3.3 目的基因PCR扩增及回收
以提取羊痘病毒SS株的基因组为模板,以特异VLTF-1F、VLTF-1R和primer star聚合酶扩增目的基因。
PCR反应体系为(25μL):模板1μL、引物F 0.5μL、引物R 0.5μL、buffer 5μL、dNTP 1μL、prime star酶1μL、ddH2O 16μL。
PCR扩增程序:95℃5 min,94℃45 s,52℃30 s,72℃90 s,40个循环。
扩增产物采用琼脂糖凝胶电泳鉴定,DNA凝胶回收试剂盒回收目的基因。
1.3.4 原核表达载体的构建
1.3.4.1 酶切
将回收的VLTF-1基因片段和pET42b载体利用NdeⅠ、XhoⅠ限制性内切酶双酶切。
50μL酶切体系为:VLTF-1基因片段(载体)25μL、1×Buffer 5μL、NdeⅠ2μL、XhoⅠ2μL、ddH2O 16μL。混匀后放入37℃水浴锅中酶切3 h,酶切的片段和pET42b载体切胶回收。
1.3.4.2 连接
在PCR管中加入酶切回收的7.5μLVLTF-1基因和1μL载体,加入0.5μL T4连接酶、1μL 10×Buffer混匀,16℃水浴过夜。
1.3.4.3 转化与鉴定
将连接的质粒转入已经制备好的感受态细胞DH5α中,在含有氨苄西林(amoxicillin,AMP)抗性的LB平板37℃培养16 h,挑取单个菌落利用PCR鉴定。鉴定成功后,提取大量质粒酶切鉴定。提取的质粒送生工生物工程股份有限公司做测序鉴定,测序结果采用DNAstar软件进行序列和遗传进化分析。
1.3.5 VLTF-1的原核表达
经鉴定阳性的原核表达载体转化BL21感受态细胞,挑取单菌落含有AMP抗性的LB平板培养皿,采用0.1 mmol/L IPTG进行诱导表达,12 000 r/min离心3 min去上清,沉淀加入25μL 5×buffer,煮沸10 min,采用SDSPAGE对蛋白的表达情况进行检测。
1.3.6 Western Blot鉴定
诱导表达的VLTF-1经SDS-PAGE电泳后,转移至硝酸纤维素滤膜上,加入10 mL 5%的脱脂牛奶,4℃封闭过夜,TBST洗涤3次,每次5min。加入10 mL TBST1∶2 000稀释鼠源一抗含GST标签,室温摇床孵育1~2 h,TBST洗涤3次,每次10 min。加入10 mL TBST1∶10 000稀释的HRP羊抗小鼠免疫球蛋白G(IgG)二抗,室温摇床孵育1 h,DAB染色观察。
1.3.7 生物信息学分析
利用ProtParam、ProtScale、SignalP 4.1Server、NetPhos 3.1 Server、TMHMM Server v.2.0和SOPMA服务器对晚转录因子VLTF-1蛋白的生物信息进行系统的分析和研究。
2 结果与分析
2.1 晚转录因子VLTF-1基因PCR产物电泳(见图1)
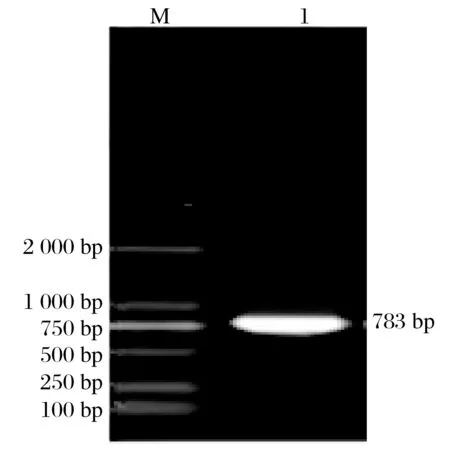
图1 晚转录因子VLTF-1基因PCR产物电泳Fig.1 Electrophoresis of PCR products of late transcription factor VLTF-1 gene
由图1可知,目的基因通过PCR扩增并用琼脂糖凝胶电泳鉴定,大小约783 bp,与理论大小相符。
2.2 pET42b载体PCR产物电泳(见图2)
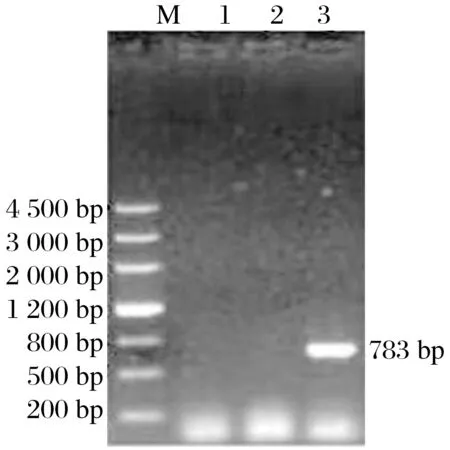
图2 p ET42b载体PCR产物电泳Fig.2 Electrophoresis of PCR products of pET42b vector
由图2可知,目的基因片段与pET42b载体构建的表达载体用PCR检测,结果与预期相符。
2.3 酶切VLTF-1质粒产物(见图3)
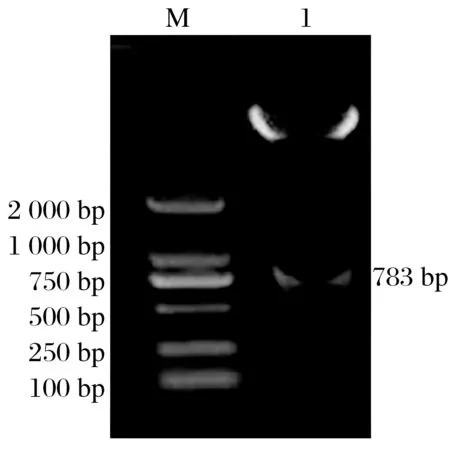
图3 酶切VLTF-1质粒产物Fig.3 Enzyme digestion of VLTF-1 plasmid product
由图3可知,采用质粒小提试剂盒提取构建好的pET42b-GTPV-054质粒,NdeⅠ、XhoⅠ酶切鉴定构建成功。
2.4 序列分析
利用DNAMAN、DNAStar将目的基因与设计的引物和Pellor基因进行同源性分析,同源性为100%。
2.5 晚转录因子VLTF-1遗传进化树分析(见图4)
由图4可知,在NCBI上查找VLTF-1同源性接近的基因只有1个,利用DNAStar进行遗传进化树分析。结果显示,目的基因与山羊痘毒株属同一分支,其保守性较强,遗传关系亲近。

图4 晚转录因子VLTF-1遗传进化树分析Fig.4 Genetic evolution tree analysis of late transcription factor VLTF-1
2.6 晚转录因子VLTF-1蛋白电泳及Western Blot检测(见图5、图6)

图5 晚转录因子VLTF-1蛋白表达产物SDS-PAGE电泳Fig.5 SDS-PAGE electrophoresis of late transcription factor VLTF-1 protein expression products
由图5、图6可知,对重组的质粒转BL21表达蛋白并进行活化、诱导表达蛋白,进行SDS-PAGE电泳和Western Blot鉴定,得到大小为27 kDa的蛋白,Western Blot检测该蛋白特异性表达。
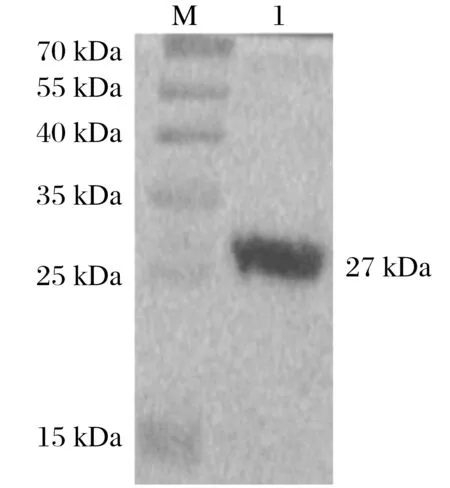
图6 晚转录因子VLTF-1蛋白Western Blot鉴定Fig.6 Western Blot identification of late transcription factor VLTF-1 protein
2.7 晚转录因子VLTF-1蛋白亲疏水性分析(见图7)
由图7可知,该蛋白含有260个氨基酸,分子式为:C1354H2133N353O388S15,分子量为30 ku,等电点为8.10,含有负电荷氨基酸29个,正电荷氨基酸31个,不稳定系数46.17(>40),说明VLTF-1蛋白属于不稳定性蛋白。脂肪族系数98.92,平均亲水值-0.030,PoatScale服务器对晚转录因子VLTF-1蛋白的亲疏水性分析,标度值在大于0的区域比较密集,结合亲水值判断该蛋白为亲水性蛋白。

图7 晚转录因子VLTF-1蛋白亲疏水性分析Fig.7 Hydrophilicity analysis of late transcription factor VLTF-1 protein
2.8 晚转录因子VLTF-1蛋白信号肽、磷酸化位点及跨膜域结构域的预测分析(见图8、图9)
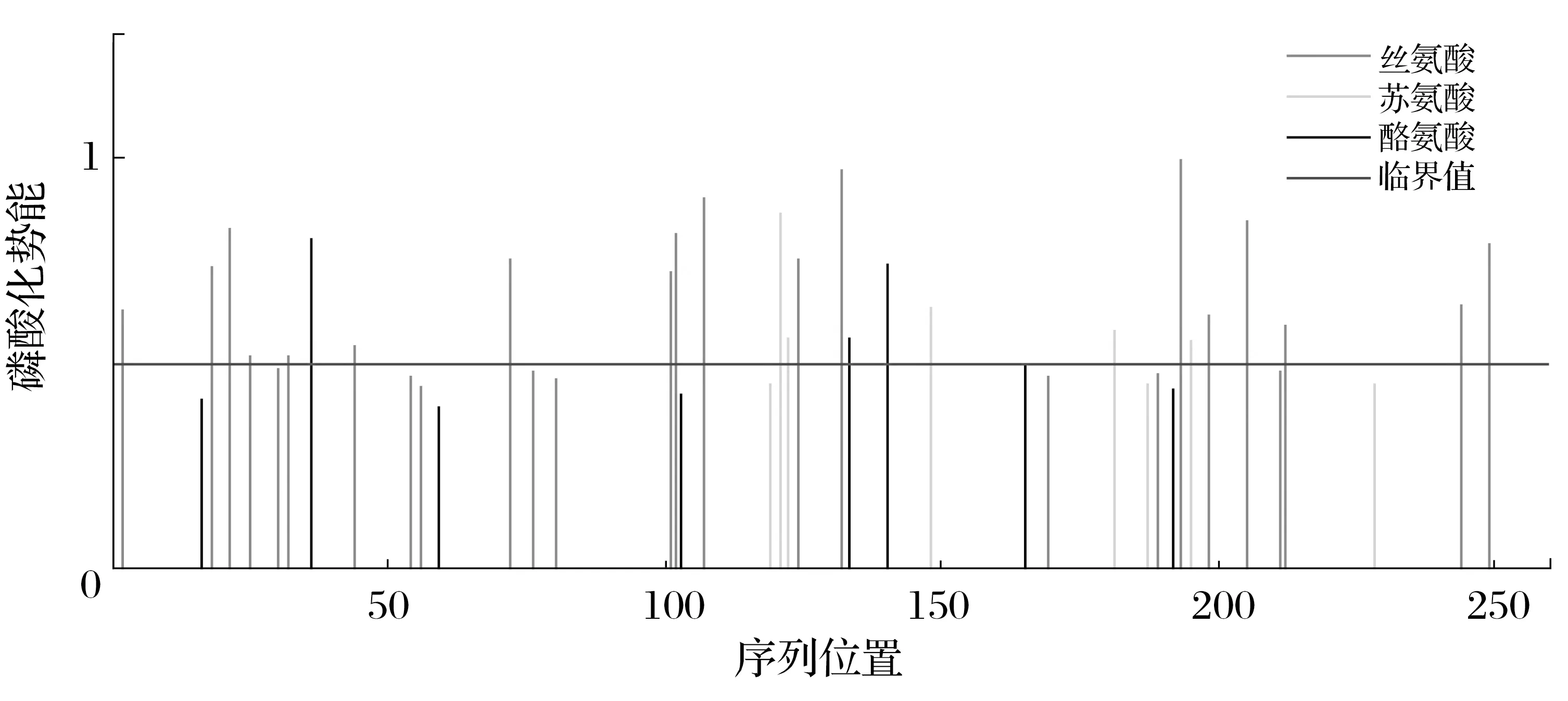
图8 晚转录因子VLTF-1蛋白的磷酸化位点Fig.8 Phosphorylation sites of late transcription factor VLTF-1 protein
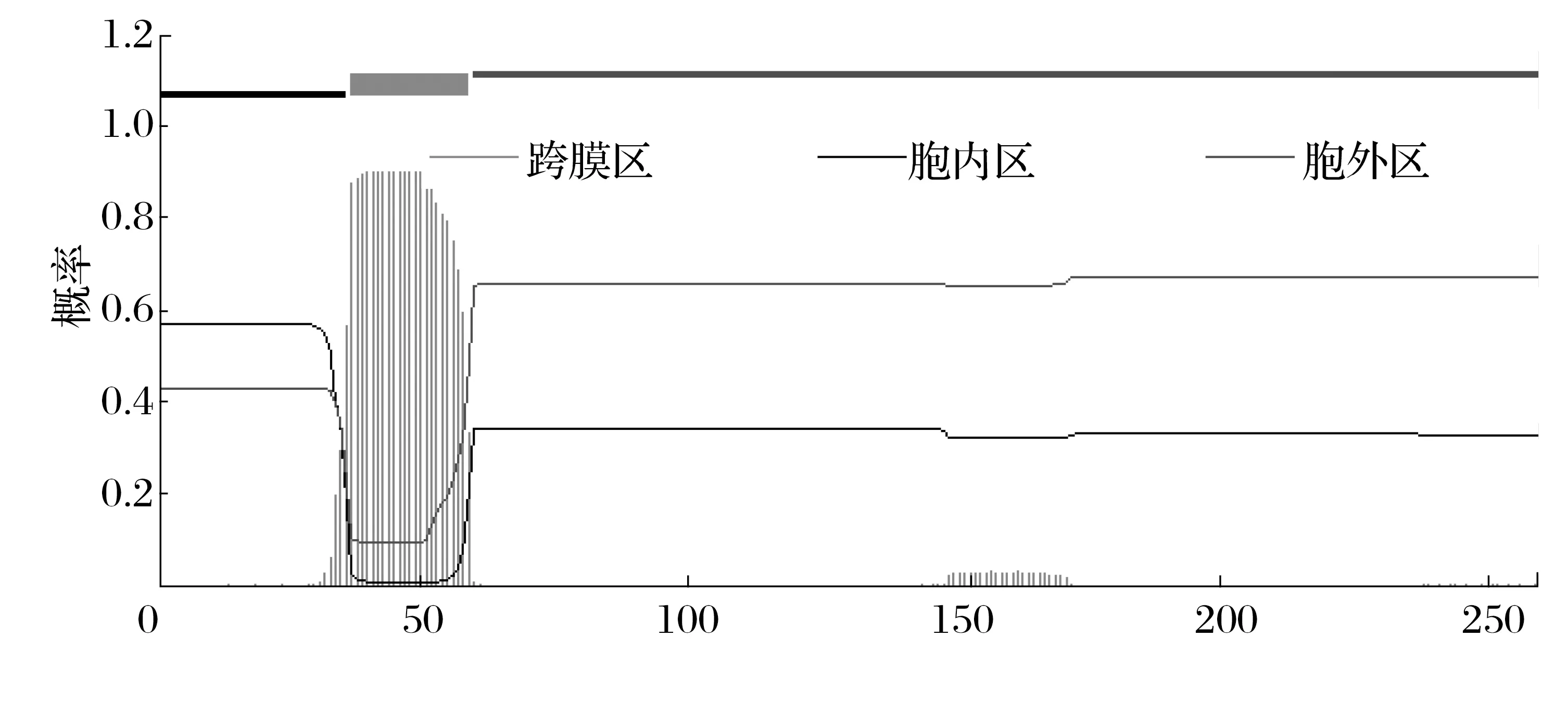
图9 晚转录因子VLTF-1蛋白的跨膜结构域Fig.9 Transmembrane domain of late transcription factor VLTF-1 protein
由图8、图9可知,利用signalP 4.1 Server服务器分析显示,VLTF-1蛋白无信号肽;NetPhos 3.1 Server分析表明,当阈值为0.5时,晚转录因子VLTF-1蛋白有26个磷酸化位点,丝氨酸、苏氨酸、酪氨酸磷酸化位点分别为18、5、3个;TMHMM Server v.2.0服务器分析表明,VLTF-1蛋白有1个跨膜结构域。
2.9 晚转录因子VLTF-1蛋白的二级结构(见图10)

图10 晚转录因子VLTF-1蛋白的二级结构Fig.10 Secondary structure of late transcription factor VLTF-1 protein
由图10可知,VLTF-1蛋白的二级结构由27.31%的α-螺旋(h)、12.69%的β-转角(t)、23.08%的无规则卷曲(c)和36.92%的延伸链(e)组成。
优势的抗原表位区域为:5~6、29~33、41~46、52~54、60~64、69~72、81~84、90~96、101~103、110~121、128~131、132~137、163~165、173~176、181~186、218~223、233~237、246~250、257~260。
3 讨论
转录是在细胞核内进行的、以碱基互补配对为原则、以DNA一条链为模板合成mRNA的过程,是蛋白生物合成的第一步。真核生物含有DNA复制和基因转录的机器,许多病毒依赖于宿主实现复制和转录,故需要在细胞核中完成病毒转录。但在DNA病毒中,痘病毒科家族是例外,其复制和转录均在细胞质内进行,需要病毒编码因子参与成熟mRNA的产生过程,如RNA聚合酶因子Rpo147、Rpo132和转录因子VTF等。转录因子在转录过程中扮演关键的角色。痘病毒中,vRNAP能够根据DNA模版催化合成RNA,但需要其他辅助因子。病毒早期基因的转录需要早期转录因子(异二聚体VETF),晚期转录时也需要VLTF。本研究主要对山羊痘病毒的晚转录因子VLTF-1蛋白原核表达和蛋白的基本特性进行简单的研究,为进一步研究山羊痘病毒的机制和其他功能性蛋白提供参考。
羊痘病毒含有4个晚转录因子,本研究对其中之一的VLTF-1基因进行PCR扩增,得到其大小为783 bp。通过同源性比较发现,SS株的VLTF-1基因与印度绵羊的亲缘关系最近为100%,推测此毒株可能由印度传播到中国新疆。遗传进化树分析表明,羊痘病毒属的3个种各分成一个分支,而SS株的VLTF-1基因与山羊痘病毒属同一分支。对VLTF-1进行原核表达,SDS-PAGE电泳和Western Blot验证得到大小为27 kDa的蛋白。但其以包涵体形式表达在沉淀中,与生物信息分析其为亲水性蛋白存在差异,原因可能与表达条件的选择有关,应进一步优化表达条件,获得可溶性表达的蛋白。
痘病毒的转录含有5'帽子和poly-A尾巴,与宿主细胞产生mRNA类似。帽子结构包含一个N7-甲基化鸟苷残基,通过一个反向的5'-5'三磷酸连接加到新产生的转录产物的5'端,加帽过程发生在转录起始后不久[18]。对VLTF-1蛋白的氨基酸特性进行分析,发现其上有26个磷酸化位点,具有上述转录因子的特点。因此,该蛋白可能具有识别蛋白激酶的位点,干扰宿主机体信号传导。VLTF-1蛋白是一个膜蛋白,可能与其进出核膜或发挥其他生物学功能有关。
痘病毒的转录在胞质中完成,但整个过程中不可能与胞核无关;且作为典型的转录因子,应含有DNA结合区、转录调控区、寡聚化位点以及核定位信号等功能区域。二级结构分析结果表明,VLTF-1蛋白为混合型蛋白,无规则卷曲和α-螺旋结构占主导位置,β-转角结构比较少。无规则卷曲和β-转角结构与抗体结合是形成抗原表位的关键,故VLTF-1蛋白可能含有许多B细胞抗原表位[19]。但不排除其他区域也存在抗原表位,是否存在还需要进一步研究加以确认。
4 结论
本研究成功克隆晚转录因子VLTF-1基因,通过原核表达系统制备了VLTF-1蛋白,并利用生物信息学分析研究蛋白的结构和功能,为全面研究山羊痘病毒提供参考。
——一道江苏高考题的奥秘解读和拓展

