新疆驴细管冻精的制作
李梦雨,董 红,范洪先,郑新宝,张永生,李超程,孙玉江,贾 斌*
(1.石河子大学动物科技学院,新疆石河子 832003;2.新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830000;3.青岛农业大学动物科技学院,山东青岛 266109)
近年来,我国驴产业发展迅速,驴已由役用向药、肉、乳、保健美容及生物制品等多产业方向发展并呈良好势头[1]。因机械化在农业和交通运输中的快速普及和城镇化水平提高,驴的役用功能被机械取代,饲养量越来越少。我国驴存栏量从1991年的1 120万头下降至2018年的253.3万头[2]。新疆驴是南疆地区经精心培育的优良驴品种,具有繁殖力强、抗病力强、耐粗饲等特性。
人工授精是提高新疆驴群体数量的重要技术手段,在驴的品种改良中起到重要作用。驴人工授精技术一般可分为:采集鲜精加入精液稀释液,分装直接输精;冷冻精液人工授精技术,即采集鲜精后经处理先冷藏再冷冻,使用时解冻再进行输精。冷冻精液便于运输,使用冷冻精液输精可最大限度地提高种公驴精液的利用率,使异地配种成为现实,有益于地方品种改良[3]。精液冷冻保存实现了低成本保存种质资源,促进了种质资源的利用[4]。目前,适用于新疆驴的低成本、高效精液冷冻技术的相关研究较少,故生产集约化的冷冻精液迫在眉睫[5]。本研究通过对比4种精液冷冻保存液,筛选出成本低且可高效利用的精液冷冻保存液,探索适合新疆驴精液冷冻的条件,为提高新疆驴精液冷冻技术、经济效益和品种保护提供参考。
1 材料与方法
1.1 试验动物
试验动物为新疆喀什市泽普县新疆金胡杨药业有限公司提供的4头成年种公驴。种公驴的饲养管理根据GB/T 1.1—2020规范起草的《种公驴饲养管理技术规程》进行饲喂。采用单圈饲养,选择有充足的阳光及运动场所,自由饮水、自由采食。
1.2 主要试剂
精液冷冻保存稀释液选用INRA-Freeze(IMV公司)、Optidyl(IMV公司)、房氏驴精液冷冻保存液[6]、马精液冷冻保存液[7]等4种。
1.3 主要仪器
假阴道(中国农业大学马研究中心);恒温水浴锅、恒温冰箱、离心机(安徽中科中佳科学仪器有限公司);0.5 mL细管(法国卡苏公司);可调式微量移液器(Eppendorf公司);显微镜(Olympus);载玻片、盖玻片、汤麦氏血球计数板(上海化科学器材有限公司);兽用精液过滤纸(世博畜牧设备有限公司);Minitube SDM6 Peinter精液密度测定仪(北京布拉德科技发展有限公司)。
1.4 试验方法
1.4.1 精液的采集及预处理
采用假阴道法采集种公驴精液,过滤后置于量筒内,记录每头驴的精液量;制作精子涂片,采用10级评分法检测精子活力,新鲜原精活力一般为0.7~0.8左右,冷冻保存精液精子活力应在0.3级以上[8]。50μL原精液加生理盐水稀释20倍混匀,吸入0.2 mL稀释后的精液样品滴至盖有盖玻片的血球计数板计数池,静置5 min计数。遵循“计上不计下、计左不计右”的原则,5点取样法记录方格中总精子数,计算精子密度。

将精子活力≥0.7且密度为2~3亿/mL的精液应用于细管冷冻精液的制作[9]。精液预处理时添加精液稀释液按照1∶1~1∶2比例添加[10],使用600×g离心10 min,除去精清后添加精液冷冻液调整精子密度至1×108个/mL。
1.4.2 对比筛选不同冷冻液对精子冻后活力的影响
分别采集4头种公驴精液,每头种公驴精液等比例分为4组。每组分别标记INRA-Freeze、Optidyl、房氏冷冻液、马精液冷冻液,调整精液密度至1×108个/mL。4℃降温平衡1.5 h,在4℃环境中装入0.5 mL/支细管;将细管置于细管架上,倒入10 cm深液氮,待蒸汽消散将细管架固定于距离液氮面高度2~3 cm处,熏蒸7 min后整体投入液氮,每组取3支细管37℃水浴30 s,制作精子涂片测定精子活力。每组重复3次平行试验。
1.4.3 对比筛选不同降温时间对精子冻后活力的影响
分别采集4头种公驴精液,每头种公驴精液等比例分成3组。离心除精清后,使用试验1.4.2中结果最好的冷冻液INRA-Freeze冷冻液稀释精液,将精液密度调整至1×108个/mL。稀释好的精液缓慢降温至4℃,分别采用不同平衡时间(90、120、150 min)进行降温平衡处理,取10μL滴在38℃的载玻片上,制作精子涂片测定精子活力。使用1.4.2的液氮熏蒸方法进行冷冻并检测、记录精子活力。每组重复3次平行试验。
1.4.4 对比筛选不同熏蒸时间对精子冻后活力的影响
分别采集4头种公驴精液,每头种公驴精液等比例分为6组。离心除精清后使用INRA-Freeze冷冻液稀释精液,精液缓慢降温至4℃,90 min降温平衡处理,取10μL滴于38℃的载玻片,制作精子涂片测定精子活力。
采用1.4.2的液氮熏蒸方法熏蒸时间分别设置为5、6、7、8、9、10 min熏蒸后整体投入液氮。每组取3支细管37℃水浴解冻30 s,制作精子涂片测定精子活力并记录。每组重复3次平行试验。
1.5 数据统计与分析
采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),Duncan's法进行多重比较。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 新疆驴鲜精理化性质测定结果(见表1)
采集新疆驴鲜精,编号并进行进行理化性质测定。由表1可知,编号005精液密度最高,编号001精液量最高。

表1 新疆驴鲜精理化性质测定结果Tab.1 Determination results of physicochemical properties of fresh essence of Xinjiang donkey
2.2 不同精液冷冻液对驴精子冻后活力的影响(见图1)
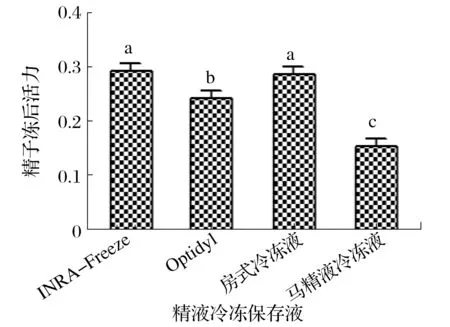
图1 不同精液冷冻液对驴精子冻后活力的影响Fig.1 Effect of different semen freezing solutions on motility of donkey sperm after freezing
由图1可知,使用INRA-Freeze的精子冻后活力最高,显著高于使用Optidyl冷冻液和马精液冷冻液的精子冻后活力(P<0.05)。
2.3 不同降温平衡时间对精子冻后活力的影响(见图2)
由图2可知,使用INRA-Freeze冷冻液,在4℃冰箱中平衡90、120、150 min的精子冻后活力差异均不显著(P>0.05)。
2.4 不同熏蒸时间对驴精子冻后活力的影响(见图3)
由图3可知,使用INRA-Freeze冷冻液,在4℃恒温冰箱中平衡后放入细管架熏蒸时,熏蒸7 min的精子冻后活力显著高于熏蒸5、9、10 min的精子冻后活力(P<0.05)。
3 讨论
人工授精中使用冷冻精液的受胎率低于使用新鲜精液或冷却精液。研究表明,在冷冻过程中,温度、渗透压的变化或冷冻液和精子细胞内形成冰晶引起的应激均对精子细胞有害[11],可影响精子的功能及运动能力,降低精子细胞寿命。有研究实现了利用INRA-Freeze使冷冻精液的受胎率达到61.5%,表明INRA-Freeze是首选的冷冻液[5,11]。Rota等[12]在比对INRA和GLY冷冻液后发现,在添加INRA-Freeze冷冻液的精液中可观察到直线运动精子的个数更多且速率更高。因此,选用INRA-Freeze冷冻液可将冷冻程序对精子的损害降至最低。在本研究中,房氏冷冻液可达到与INRA-Freeze相同的冷冻效果,表明在制作驴的细管冻精时,使用INRA-Freeze和房氏冷冻液均可得到较好的结果。
细管精液预处理方案分别为稀释-离心-再悬浮和离心-再悬浮。两者差别仅在于鲜精是否进行稀释以及不同稀释液的选择对冷冻液冷冻后是否存在影响。Alvarenga等[13]、Joseph等[5]指出,种公马的精液在600×g离心10 min时,精子损失和精子损坏可降至最低。本试验除精清过程选择上述离心方法以减少离心对精子的损伤。但要保持精子质膜完整性,则需去除离心的步骤[14]。
本试验制作细管冻精的方法采用新疆畜牧科学院畜牧研究所的专利《一种驴精液冷冻保存的方法》,此方法在羊、驴等家畜中均有应用[15]。Alvarenga等[13]提到4种冷冻方案,其中两种方案均为先进行冷却处理,一种进行中等冷冻(-20℃),另一种则为快速冷冻(液氮熏蒸);另外两种方案不进行冷却处理,直接进行中等冷冻和快速冷冻。使用先冷却再冷冻可更好地保持精子膜的完整性,且直线运动精子的百分比高于直接冷冻的方案。本研究中选择先冷却处理再进行快速冷冻以提高冻后有效精子数。
有研究表明,精液降温平衡的时间为20 min~4 h[16],时间越长冷冻液的毒性越大。杨秋凤等[17]研究发现,降温平衡时间过长或过短均可降低细管精液的冷冻效果。本试验中进行比对的时间段为中间时段,最终冷冻效果差异不显著。国内研究者指出,液氮熏蒸的时间一般低于15 min,通常为7~8 min[18-20];而国外研究者则认为液氮熏蒸时间一般高于15 min[5,11]。本试验最佳液氮熏蒸时间为6~8 min,与其他国内研究者的结论一致。
本试验对新疆驴制作冷冻精液流程中使用冷冻液进行评估,探索了降温平衡的时间和液氮熏蒸时间,总结出了最适冷冻液和冷冻过程中的降温以及熏蒸时间,以期为新疆驴种质资源的保护提供参考。本试验采用手工冷冻检测,因季节性原因未进行细管冻精受胎率试验,故细管冻精的使用效果仍有待进一步试验加以验证。
4 结论
在制作新疆驴细管冻精过程中,使用INRA-Freeze冷冻液稀释已过滤的驴精液,4℃平衡90 min后装入0.5 mL的细管依次摆放于细管架上,置于液氮熏蒸7 min后可得到精子冻后活力最佳的细管冻精。

