利用高密度Bin图谱定位水稻抽穗期剑叶叶绿素含量QTL
赵凌,张勇,魏晓东,梁文化,赵春芳,周丽慧,姚姝,王才林,张亚东
利用高密度Bin图谱定位水稻抽穗期剑叶叶绿素含量QTL
赵凌,张勇,魏晓东,梁文化,赵春芳,周丽慧,姚姝,王才林,张亚东*
江苏省农业科学院粮食作物研究所/江苏省优质水稻工程技术研究中心/国家水稻改良中心南京分中心,南京 210014
【目的】挖掘新的控制水稻叶绿素含量的相关位点和基因,为水稻叶绿素含量的遗传机制研究提供理论基础。【方法】利用剑叶叶色存在明显差异的粳稻TD70和籼稻Kasalath杂交构建的包含186个株系的重组自交系群体为供试材料,通过对两亲本及RIL群体重测序,构建了包含12 328个Bin标记的高密度遗传图谱。RIL群体及亲本分别于2011和2020年正季在江苏省农业科学院种植。抽穗后第3天使用叶绿素仪测定剑叶SPAD值。使用IciMappingv3.4软件完备区间作图法,对控制水稻抽穗期剑叶叶绿素含量的QTL进行鉴定。利用便携式光合仪测定RIL群体中20个SPAD极端株系的水分利用效率、蒸腾速率、气孔导度和净光合速率等光合作用参数。【结果】2年共检测到19个抽穗期剑叶叶绿素含量相关QTL,分别分布在除第8、9和10染色体外的其他9个染色体上。单一QTL贡献率为3.09%—13.13%,LOD值为2.74—14.08。通过物理位置比对,发现其中10个QTL与前人定位到的叶绿素含量相关位点在相同或邻近区域。和2年均被检测到,表现出较强的稳定性。位于第2染色体的7.63—7.71 Mb处,2年LOD值分别为14.08和7.93,贡献率分别为13.13%和7.94%。位于第5染色体的23.44—23.49 Mb处,2年LOD值分别为4.31和3.76,贡献率分别为3.57%和4.82%。结合功能注释和亲本间序列分析,分别在和染色体区间内找到2个与剑叶叶绿素含量相关的基因和。这两个基因的核苷酸序列在两亲本间均存在差异。编码水稻天冬氨酸氨基转移酶(AAT1),是水稻氮代谢途径中的重要酶,与蛋白质及氨基酸含量有关。编码叶面斑点相关蛋白,推测与叶片颜色有关。根据在CDS+273 bp有无突变对RIL群体进行等位型分类。在20个SPAD极端株系中,不同等位型株系的剑叶SPAD值和水分利用效率、蒸腾速率、气孔导度和净光合速率等光合作用指标均存在显著差异。【结论】共检测到19个控制水稻抽穗期剑叶叶绿素含量QTL,鉴定了2个稳定存在的QTL——和,在这两个QTL区间筛选到2个可能调控水稻抽穗期剑叶叶绿素含量的基因。其中1个()不同等位型的光合作用参数在20个极端SPAD株系中存在显著差异,推测其为最可能的候选基因,可用于后续剑叶叶绿素调控基因的功能研究。
水稻;重组自交系;高密度Bin图谱;叶绿素含量;QTL
0 引言
【研究意义】水稻是世界主要三大粮食作物之一,其产量主要来自于叶片光合作用的产物。叶绿素是水稻光合作用的物质载体,是将光能转化为化学能的主要元素,叶绿素含量是直接决定光合潜力和初级生产能力的因素[1-2]。提高叶片中叶绿素含量可以提高光合速率,进而提高产量。此外,作物叶片叶绿素含量不仅可以作为营养水平的指标(如氮素含量),还可以指示作物对逆境胁迫的承受程度等[3-4]。有研究报道,剑叶在作物光合作用中起着积极的作用,对产量具有重要的促进作用[5-6]。因此,改善水稻剑叶的叶绿素含量是提高水稻生物量和籽粒产量的有效途径。【前人研究进展】近年来,水稻叶绿素相关性状的研究越来越受到重视,报道了苗期、分蘖期、齐穗期等时期以及不同氮素供应、干旱、高温等各种胁迫下水稻叶绿素含量和叶绿素a/b比等相关性状的QTL定位结果,克隆了、等一些相关基因[7-12]。QTL定位是目前剖析水稻复杂数量性状最有效的工具之一。传统分子标记构建的遗传图谱密度较低,定位区间过大,容易导致精细定位和基因克隆困难。随着基因组测序技术的快速深入发展,水稻遗传育种已经进入高通量、大规模的全基因组水平时代。SNP标记由于分布广泛、多样性高、数量大等特点,在水稻复杂数量性状研究中得到了高度重视和广泛应用。取一定数量的连续SNP标记作为判断染色体重组事件的最小单位(recombination bin),判断子代每个Bin的来源,得到每个子代的全基因组物理图谱,所构建出的遗传图谱称之为Bin图谱[13]。Bin图谱是基于SSR/RFLP标记的传统遗传图谱后的新一代遗传图谱,通过高通量测序进行,自动化程度高、构建时间短、精确度高,可以直接进行QTL定位后续的候选基因筛选和分子标记开发[14]。【本研究切入点】已经定位和克隆的QTL/基因并不能完全解释水稻叶绿素相关性状的遗传及变异,其分子机理还需要更加深入地研究。【拟解决的关键问题】本研究利用抽穗期剑叶叶绿素含量存在显著差异的籼稻Kasalath和粳稻TD70衍生的重组自交系群体(RIL)为作图群体,构建了包括12 328个Bin标记的高密度连锁图谱,定位和分析控制抽穗期剑叶叶绿素含量的QTL,寻找一些新的、稳定的叶绿素含量相关位点,以期为水稻叶绿素含量相关基因的鉴定提供基础,为水稻分子标记育种提供新的筛选靶标。
1 材料与方法
1.1 试验材料
以一个来源于天鹅谷///9520//(72-496/苏御糯)的粳稻品系TD70和籼稻品种Kasalath为亲本配制组合。2005年夏从F1单株收取自交种子,以单粒传方法构建成由186个株系组成的RIL群体[15]。基因型调查为F10世代,表型调查为F7和F11世代。
1.2 田间试验及叶绿素测定
分别于2011和2020年于江苏省农业科学院粮食作物研究所试验田种植186个RIL群体及2个亲本,随机区组设计。2011年和2020年均于5月10日播种,6月10日移栽,每个株系种植4行,每行7株,单本栽插,行株距为25 cm×16.7 cm。移栽后至收获不施肥,搁田后,田间保持干干湿湿至收获,其他田间管理按常规栽培管理方法。
使用叶绿素仪(SPAD-502,Monito,Japan)测量186个株系及亲本抽穗期的剑叶叶绿素含量。以每株系小区内50%单株始穗日期为该株系的抽穗日期。每个株系抽穗后第3天测定剑叶SPAD值。随机调查3个代表性植株,每个植株选择位置一致的3张剑叶,每张叶片测量不同位置的5个SPAD值,取平均值作为该植株的叶绿素含量SPAD值,3个植株SPAD的平均值作为整个株系的叶绿素含量值。下文中叶绿素含量均用SPAD值来表示。
1.3 连锁图谱构建与QTL定位
对186个粳稻TD70与籼稻Kasalath的RILs群体进行全基因组重测序和基于SNP的Binmap连锁图谱构建。构建的高密度遗传图谱含有12 328个Bin标记,各染色体Bin标记数为763—1 367个,标记间平均物理距离为30.26 kb[16]。利用QTL IciMapping V3.4软件,采用完备区间作图法(inclusive composite interval mapping,ICIM)在全基因组范围内进行扫描[17],扫描步长为1.0 cM,检测控制剑叶叶绿素含量的QTL。以LOD2.5作为阈值检测QTL的存在,QTL的命名方法参照McCouch等[18]规则。
1.4 光合速率的测定
在RIL群体中选取剑叶叶绿素含量极高和极低的株系各10个,在成熟期,利用便携式光合仪(Li-6800,LI-COR,USA)于上午9:00—11:00进行光合参数测定。测量时,光照有效辐射和CO2含量分别设置为1 500 μmol·m-2s-1和400 ppm。每个株系测定3个植株作为生物学重复。
2 结果
2.1 RIL群体及其亲本的剑叶叶绿素含量表型变异
2011和2020年RIL群体及其双亲的剑叶叶绿素含量的表型变异见图1。亲本TD70剑叶的SPAD平均值分别为48.2和46.2,而Kasalath的剑叶SPAD平均值为34.50和38.10,2年不同环境下TD70的剑叶叶绿素含量均极显著高于Kasalath(<0.01,表1)。
2011年RIL群体的剑叶叶绿素含量SPAD均值为42.08,剑叶叶绿素含量最高的株系达到49.0,最低的株系为30.51(表1)。2020年RIL群体的剑叶叶绿素含量SPAD均值为40.58,剑叶叶绿素含量最

图1 亲本及部分RIL群体株系抽穗期的剑叶叶色
高的株系达到50.83,最低的株系为27.53(表1),群体中剑叶叶绿素含量存在明显的超亲现象。2011和2020年RIL群体的剑叶叶绿素含量峰度和偏度的绝对值都小于1,呈连续性并为正态分布,表现出数量性状的遗传特点(图2),可以对其进行QTL定位分析。
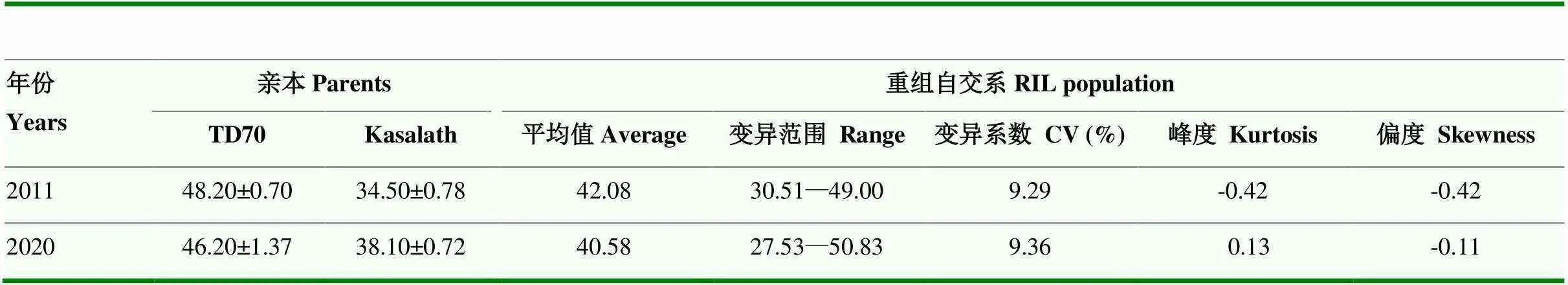
表1 亲本与重组自交系群体抽穗期剑叶的叶绿素含量
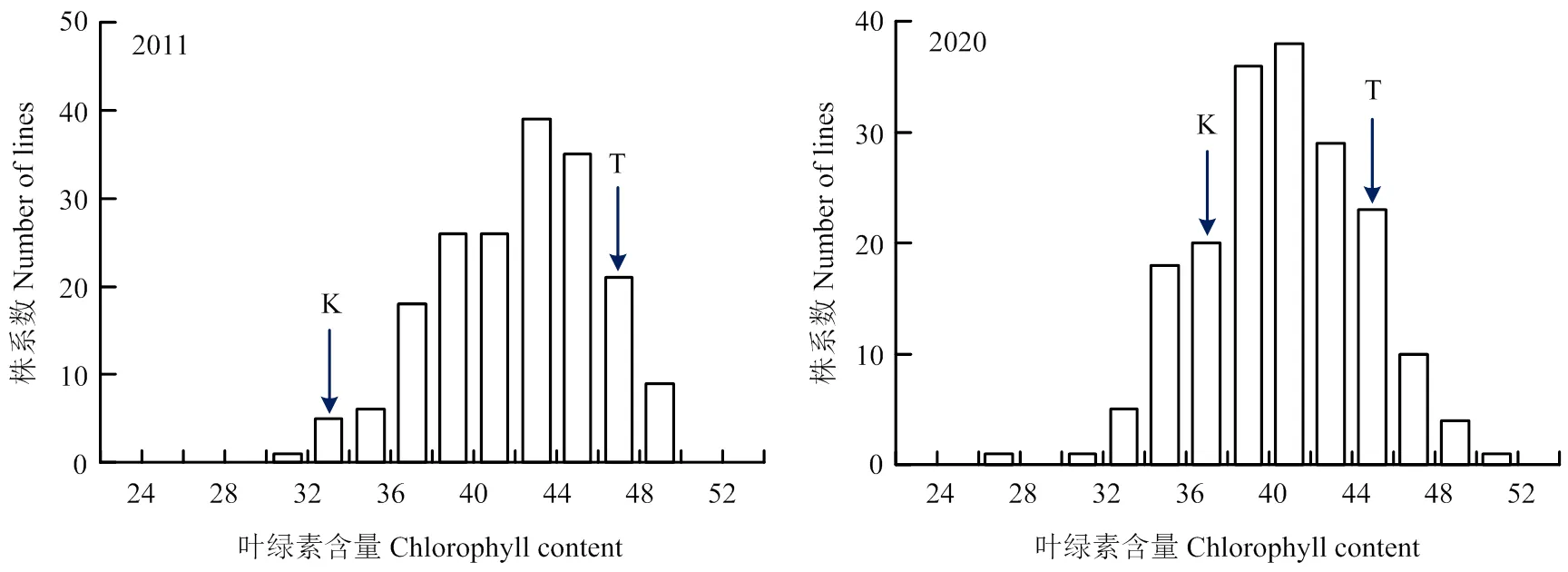
K:Kasalath;T:TD70
2.2 剑叶叶绿素含量的QTL检测
对RIL群体进行剑叶叶绿素含量的QTL检测,2年共检测到19个QTL,分别分布在除第8、9和10染色体外的其他9个染色体上(表2)。其中,2011年检测到8个QTL,分布于第1、2、3、5、6和7染色体,LOD值介于2.74—14.08,贡献率介于3.57%—13.13%。2020年检测到13个QTL,分别位于第1、2、3、4、5、6、11和12染色体,LOD值介于2.84—9.19,贡献率为3.09%—10.95%。其中2个QTL(和)在2年均被检测到。
位于第2染色体的7.63—7.71 Mb处,在2年环境中均被检测到,表现出较强的稳定性。在2011年可解释13.13%的表型变异,是2011年检测到效应最大的QTL,来自于Kasalath的等位基因可使剑叶叶绿素含量的SPAD值升高1.81。在2020年检测到LOD值为7.93,可解释7.94%的表型变异。来自于Kasalath的等位基因可使剑叶叶绿素含量的SPAD值升高1.24。
2年均被检测到的QTL位于第5染色体的23.44—23.49 Mb处,在2011年检测到LOD值为4.31,可解释3.57%的表型变异,来自于TD70的等位基因可使剑叶叶绿素含量SPAD值升高0.91。在2020年可解释4.82%的表型变异,来自于TD70的等位基因可使剑叶叶绿素含量SPAD值升高0.86。
第1染色体上共有4个影响剑叶叶绿素含量的QTL,其中和在2011年被检测到,分别位于第1染色体的25和31 Mb处,LOD值约为6.4,分别解释6.47%和5.55%的表型变异,增效基因均来自于Kasalath。和在2020年被检测到,位于第1染色体3—4 Mb,LOD值都在8以上,效应较大,解释的表型变异大于9%,增效等位基因均来自于TD70,可使剑叶叶绿素含量SPAD值升高1.42和1.32。

表2 检测到控制抽穗期剑叶叶绿素含量的QTL
加性效应值为正值,表明增效等位基因来源于TD70。*:在2年间重复检测到的QTL。下同
Positive additive effect showed that source of favorable allele came from TD70.*: the QTL was detected in both two years.The same as below
第2染色体上共有3个控制剑叶叶绿素含量的QTL,除2年均被检测到外,2011和2020年分别检测到和,LOD值为2.74和3.27,均为来自于Kasalath的等位基因,可使剑叶叶绿素含量的SPAD值升高1.14和1.28。
第3染色体在2011和2020年各检测到1个QTL(和),分别位于第3染色体25 Mb和顶端,LOD值均超过4.5,解释的表型变异大于9%,均为来自于TD70的增效等位基因,可使剑叶叶绿素含量的SPAD值升高0.9左右。
第4、7和11染色体2年均只检测到1个QTL,其中,2011年检测到,2020年检测到和。是所有检测到的位点中增效效应最大的位点,位于第7染色体的24.3 Mb处,来自于TD70的增效等位基因可使剑叶叶绿素含量的SPAD值升高2.37。和分别解释7.7%和3.89%的表型变异。
除在2年中均被检测到外,第5染色体上在2020年还检测到,位于第5染色体的顶端,LOD值4.72,来自于TD70的等位基因可使剑叶叶绿素含量的SPAD值升高1.11。
2011和2020年分别在第6染色体上检测到1个QTL。2011年检测到的位于29.4 Mb,LOD值4.67,解释3.92%的表型变异;2020年检测到的位于24.4 Mb左右,LOD值为5.63,解释5.68%的表型变异,它们均携带来自Kasalath的增效等位基因。
在第12染色体上共检测到3个QTL,均于2020年被检测到。其中,位于8.13—8.45 Mb,携带来自于TD70的增效等位基因;另外2个QTL(和)位于25 Mb相邻的区域均携带来自Kasalath的等位基因,可升高SPAD值1左右。
2.3 候选基因的筛选
利用水稻基因组注释数据库(http://rice.uga.edu/)对2年重复检测到的影响剑叶叶绿素含量位点和区间内的基因进行功能注释(表3)。
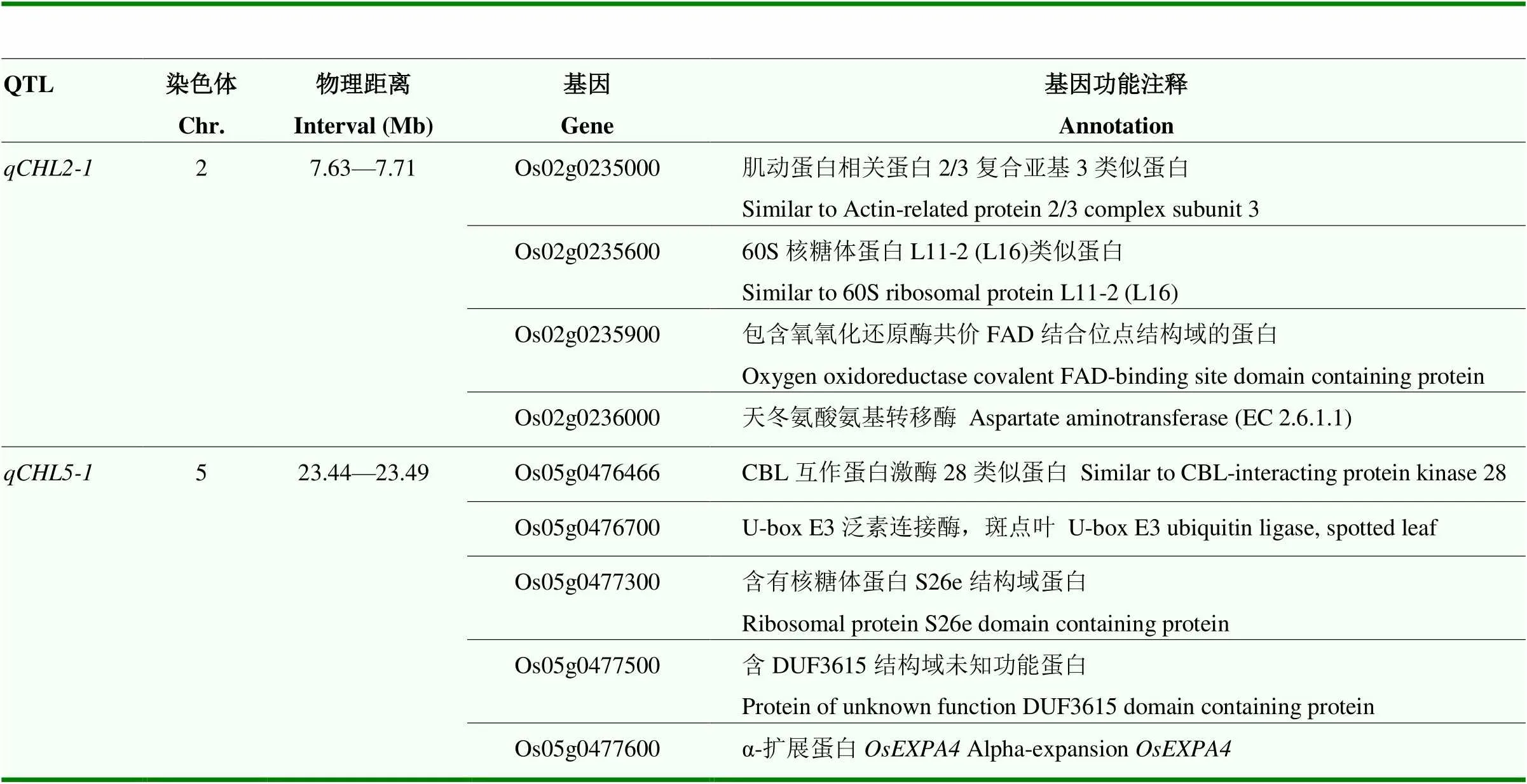
表3 2个重复检测到QTL区间内基因的注释
位于第2染色体的7.63—7.71 Mb处,该区间内经过查询,共有8个注释基因,除去不转录蛋白、假定蛋白等基因外,还有4个注释有功能的基因。比较这4个基因在2个亲本基因组中的序列,发现除基因外,其他3个基因的编码区在亲本间不存在错义突变。是水稻天冬氨酸氨基转移酶(aspartate aminotransferase,AAT1)基因,编码的天冬氨酸氨基转移酶(EC 2.6.1.1)是水稻氮代谢途径中的重要酶。已有报道与控制蛋白质和氨基酸含量的QTL有对应关系[19]。由于氮代谢和水稻叶色有非常重要和直接的关系,初步推测其可能与叶片颜色有关[20]。进一步序列比较发现TD70和Kasalath的存在20处碱基差异,其中11处为单碱基转换。有1处错义突变发生在CDS+273 bp(T/C),编码的氨基酸分别为Ser和Pro。根据在CDS+273 bp有无突变对RIL群体进行等位型分类,在CDS+273 bp处无突变的命名为HapA,碱基T突变为C的株系命名为HapB。分析20个叶绿素含量极端株系的光合速率测定结果发现,与HapA相比,HapB的株系显著降低了剑叶SPAD值和叶绿素含量,同时HapB株系的水分利用效率、蒸腾速率、气孔导度和净光合速率等光合作用指标均显著降低(图3)。推测是水稻光合作用通路中比较重要的功能基因。
位于第5染色体的23.44—23.49 Mb处,经过数据库查询,该区间内共有9个注释基因,除去不转录蛋白、假定蛋白等基因外,发现有1个基因()注释是叶面斑点基因,推测与叶片颜色有关。基因序列分析发现,除外,其他基因的编码区在2个亲本基因组中不存在错义突变。的产物是可表达的蛋白,其涉及的生物学进程包括细胞内骨架、泛素连接酶催化活性等。TD70和Kasalath的有5个位点变异,其中1个错义突变发生在CDS+571 bp(C/A),编码的氨基酸分别为Asp和Glu。
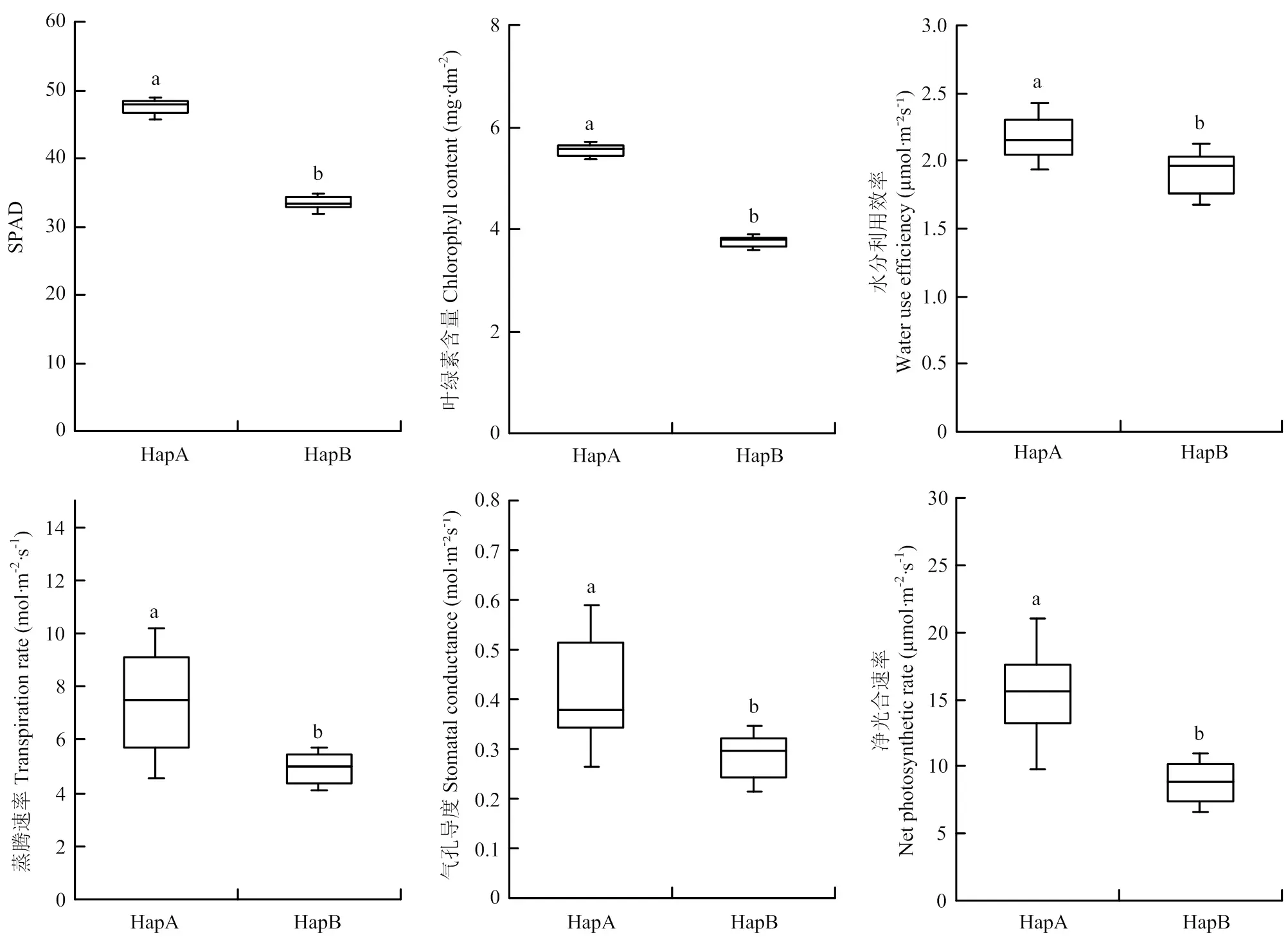
HapA:AAT1在CDS+273 bp处为T;HapB:AAT1在CDS+273 bp处为C。不同小写字母表示差异显著(P<0.05)
3 讨论
叶绿素含量是水稻生长的重要农学参数。在一定的养分水平下,叶绿素含量代表了水稻的生产能力。当叶绿素含量较高且相对稳定期较长时,叶片能够吸收更多的光能,从而更好地发挥产量潜力。在生产实践中,尽管叶片叶绿素含量可以判断水稻植株营养状况、光合能力、逆境胁迫抗性,但作为多基因控制的复杂数量性状,遗传复杂,而且受氮肥等因素影响较大,在育种中很难有效选择。目前已经定位和克隆了一些控制不同时期水稻叶片叶绿素含量的QTL,在基因克隆方面也取得了进展。但鉴定到的位点大都利用初级作图群体,标记数目较少往往导致QTL区间较大,很难进行深入的效应估计和候选基因鉴定以及标记辅助选择。本研究通过高密度的Bin图谱对水稻抽穗期剑叶的叶绿素含量进行QTL定位分析,希望能够为剖析其遗传规律提供新的研究基础。
3.1 Bin图谱定位水稻复杂性状QTL具有明显的优势
基于测序技术构建的Bin图谱与传统遗传图谱相比,不仅标记密度更高,能够提供准确的物理位置,而且能够精确检测双交换事件,使QTL定位更准确,区间更小。本研究采用基因分型测序(genotyping by sequencing,GBS)技术构建的高密度Bin图谱共包含12 328个Bin标记,标记间平均物理距离为30.26 kb,使得直接从定位区间筛选候选基因成为可能。
已有研究表明,QTL的紧密连锁或者成簇分布可能是水稻叶绿素含量的遗传基础之一[21-22]。当LOD值超过阈值的一段区域内存在多个峰值时,通过传统遗传图谱很难区分开,往往导致效应较小的位点被遮盖[23]。本研究在位置相邻的区域定位到了控制剑叶叶绿素含量的多个QTL,如和分别位于第2染色体35.03—35.10 Mb和35.12—35.15 Mb;和分别位于第12染色体25.50—25.54 Mb和25.70—25.74 Mb。此外,本研究鉴定的一些位点和已知水稻叶绿素含量相关QTL或者基因之间也存在这种位置相邻的现象,如:位于第3染色体25.41—25.44 Mb处,而已经克隆的叶绿素b还原酶基因()位于25.52 Mb。和位点附近,也有影响叶绿素含量的谷氨酸-1-半醛转氨酶基因(glutamate -1-semialdehyde aminotransferase,GSA)、羟甲基后胆色素原合成酶基因()和硝酸盐转运蛋白基因。位于第5染色体23.44—23.49 Mb处,而已经克隆的水稻叶色相关基因()位于23.35 Mb(http://www.gramene.org),编码谷氨酸-1-半醛转氨酶,具有一个吡哆醛磷酸盐介导的转移酶结构域,在叶绿素生物合成从谷氨酰到叶绿素a的过程中发挥作用[24]。董骥驰等[25]利用02428和玉针香高密度Bin图谱进行水稻抽穗期QTL定位,发现定位的抽穗期QTL之间存在这种位置相邻的现象。说明利用Bin图谱进行QTL检测可将位置非常临近的QTL有效地分离开来,测序分型得到的大量SNP标记还可以快速应用于分子育种,在水稻复杂性状的定位、候选基因鉴定和标记辅助选择方面具有非常大的应用前景。
3.2 本研究与前人定位QTL的比较
诸多研究者利用不同的遗传群体和标记,定位到很多控制不同时期、不同部位叶片的叶绿素含量相关QTL,比较发现这些位点的贡献率绝大多数在10%以下,主效基因较少,表明叶绿素含量主要由微效QTL控制,这和叶绿素a和叶绿素b通过多个步骤合成相一致[22]。本研究应用水稻籼粳交RIL群体构建高密度Bin连锁图谱,2年共检测到19个控制抽穗期剑叶叶绿素含量的QTL,贡献率为3.09%—13.13%,与上述研究结果基本一致,反映了叶绿素含量这一生理性状遗传的复杂性。
通过遗传图谱的对比(http://www.gramene.org),发现本研究定位到的一些剑叶叶绿素含量位点和已知影响水稻叶绿素含量的位点间有着区间的重叠(表4)。如本研究检测到的位于第1染色体31.76—31.83 Mb,在该区域检测到多个相关QTL。胡颂平等[26]利用珍汕97B/IRAT109的RILs群体在30.1—33.86 Mb检测到控制干旱胁迫下的剑叶或倒2叶叶绿素含量的QTL,表型贡献率为6.46%,LOD值为4.56。Teng等[27]利用ZYQ8/JX17的DH群体,检测到控制分蘖期上部展开叶叶绿素含量的,位于30.06—32.06 Mb。刘进等[28]利用沈农0530-9/北陆129的F2及F2:3群体,在这个区域也检测到了控制拔节期剑叶叶绿素含量的QTL。此外,胡茂龙等[29]利用日本晴/Kasalath//日本晴的BILs群体,在第1染色体25.13—26.19 Mb区间检测到控制抽随后7 d叶绿素含量的位点,表型贡献率为10.7%,LOD值为3.34,和本研究的在同一区域内。
在2年均被检测到的位点和附近也发现有多个叶绿素含量相关位点。在第2染色体7.63—7.71 Mb内的位点,表型贡献率为13.13%,LOD值为14.08,是本研究定位到的效应最大的叶绿素含量位点。在其所在区域有多个相关QTL被检测到,如利用沈农265/丽江新团黑谷的RILs群体、岗46B/A232的RILs群体、ZS97/WY2的DHs群体,以成熟期、分蘖期剑叶叶绿素含量和发育期剑叶叶绿素b含量为表型,分别在第2染色体2.88—9.47、5.20—8.76和7.43—11.41 Mb区间内检测到了相关QTL[11, 30-31]。这些QTL区间较大,都覆盖了本研究定位的。第5染色体上的位点也是相同的情况,利用窄叶青8号/京系17的DHs、Dular/Lemont RILs、十和田/丽江新团黑谷RILs分别检测到了控制齐穗期剑叶叶绿素b含量、齐穗期剑叶叶绿素含量和孕穗期剑叶叶绿素b含量的位点,分别在第5染色体19.27—31.45 Mb和3.89—24.09 Mb附近,覆盖了本研究所在的23.44—23.49 Mb区间[32-35]。和不仅在本研究中稳定存在,而且位于多个不同群体鉴定到的叶绿素含量QTL的区域内,值得进一步深入研究。
位于第4染色体23.3 Mb,表型贡献率为7.71%,LOD值为7.47,在该区域检测到多个已知的叶绿素含量相关QTL,与分蘖期剑叶、苗期的叶绿素含量、抽穗5和25 d叶绿素含量的降低等性状相关[30, 36, 38]。已经定位的苗期叶绿素含量QTL(AQAE002)覆盖了此区域[36]。、、这3个位点分别和已经发表的控制干旱胁迫下的剑叶或倒2叶叶绿素含量、抽穗后5 d和25 d叶绿素含量的降低、成熟期剑叶的叶绿素含量QTL存在区域重叠现象,其他QTL所在区域暂时未发现相关报道。
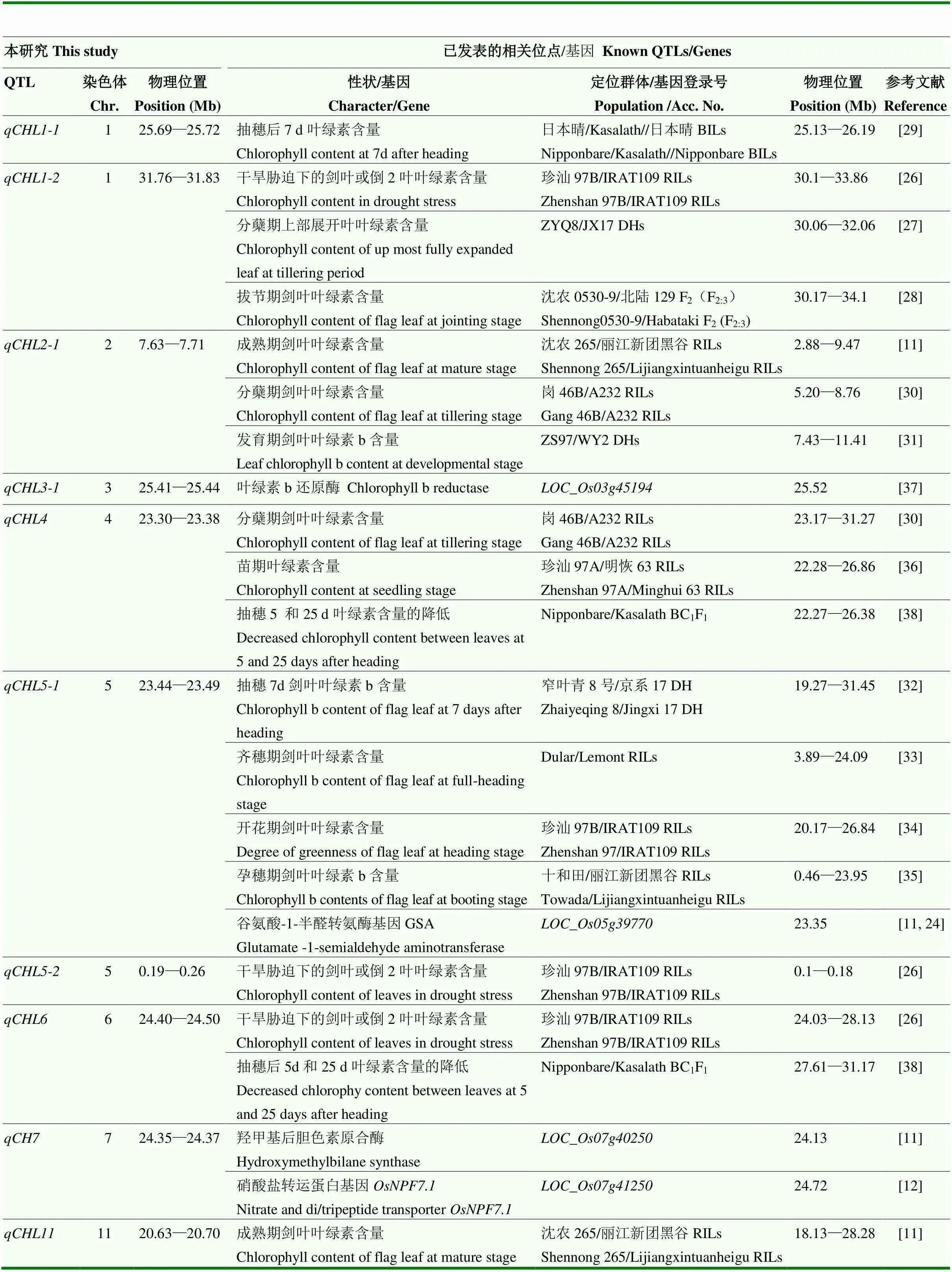
表4 本研究定位的QTL和已知叶绿素含量相关位点的位置比较
4 结论
检测到19个控制抽穗期剑叶叶绿素含量的QTL。鉴定了2个稳定存在的QTL——和。编码水稻天冬氨酸氨基转移酶的可能是调控抽穗期剑叶叶绿素含量的候选基因。
[1] CURRAN P J, DUNGAN J L, GHOLZ H L.Exploring the relationship between reflectance red edge and chlorophyll content in slash pine.Tree Physiology, 1990, 7: 33-48.
[2] FILELLA I, SERRANO I, SERRA J, PEÑUELAS J.Evaluating wheat nitrogen status with canopy reflectance indices and discriminant analysis.Crop Science, 1995, 35: 1400-1405.
[3] NOODEN L D, GUIAMET J J, JOHN I.Senescence mechanisms.Physiologia Plantarum, 1997, 101: 746-753.
[4] NEUFELD H S, CHAPPELKA A H, SOMERS G L, BURKEY K O, DAVISON A W, FINKELSTEIN P L.Visible foliar injury caused by ozone alters the relationship between SPAD meter readings and chlorophyll concentrations in cut leaf coneflower.Photosynthesis Research, 2006, 87: 281-286.
[5] XUE D W, CHEN M C, ZHOU M X, CHEN S, MAO Y, ZHANG G P.QTL analysis of flag leaf in barley (L.) for morphological traits and chlorophyll content.Journal of Zhejiang University (Science B), 2008, 9: 938-943.
[6] LI Z K, PINSON S R M, STANSEL J W, PATERSON A H.Genetic dissection of the source-sink relationship affecting fecundity and yield in rice (L.).Molecular Breeding, 1998, 4: 419-426.
[7] TAKAI T, KONDO M, YANO M, YAMAMOTO T.A quantitative trait locus for chlorophyll content and its association with leaf photosynthesis in rice.Rice, 2010, 3:172-180.
[8] YANG L, WANG J, LEI L, WANG J, SUBHANI M J, LIU H, JIAN S, ZHENG H, ZHAO H, ZOU D.QTL mapping for heading date, leaf area and chlorophyll content under cold and drought stress in two related recombinant inbred line populations (rice) and meta-analysis.Plant Breeding, 2018, 137: 527-545.
[9] YOO J H, PARK J H, CHO S H, YOO S C, LI J, ZHANG H, KIM K.The rice bright green leaf (bgl) locus encodes OsRopGEF10, which activates the development of small cuticular papillae on leaf surfaces.Plant Molecular Biology, 2011, 77: 631-641.
[10] KANBE T, SASAKI H, AOKI N, YAMAGISHI T, OHSUGI R.The QTL analysis of RuBisCO in flag leaves and non-structural carbohydrates in leaf sheaths of rice using chromosome segment substitution lines and backcross progeny F2populations.Plant Production Science, 2009, 12(2): 224-232.
[11] 姜树坤, 张喜娟, 徐正进, 陈温福.粳稻叶绿素含量QTL与其合成降解相关基因的比较分析.作物学报, 2010, 36(3): 376-384.
JIANG S K, ZHANG X J, XU Z J, CHEN W F.Comparison between QTLs for chlorophyll content and genes controlling chlorophyll biosynthesis and degradation inrice (L.).Acta Agronomica Sinica, 2010, 36(3): 376-384.(in Chinese)
[12] 叶卫军.水稻叶绿素含量QTL_L的精细定位&叶色控制基因的克隆与功能分析[D].杭州: 浙江大学, 2016.
YE W J.Fine mapping leaf chorlphy II content QTLand cloning and function analysis of leaf color gene[D]Hangzhou:Zhejiang University, 2016.(in Chinese)
[13] 唐立群, 肖层林, 王伟平.SNP分子标记的研究及其应用进展.中国农学通报, 2012, 28(12): 154-158.
TANG L Q, XIAO C L, WANG W P.Research and application progress of SNP markers.Chinese Agricultural Science Bulletin, 2012, 28(12): 154-158.(in Chinese)
[14] 王朝欢, 宋博文, 余思佳, 肖武名, 黄明.基于全基因组测序构建水稻RIL群体遗传图谱.华南农业大学学报, 2021, 42(2): 44-50.
WANG C H, SONG B W, YU S J, XIAO W M, HUANG M.Construction of a genetic map of rice RILs based on whole genome sequencing.Journal of South China Agricultural University, 2021, 42(2): 44-50.(in Chinese)
[15] 董少玲, 张颖慧, 张亚东, 陈涛, 赵庆勇, 朱镇, 周丽慧, 姚姝, 赵凌, 王才林.水稻重组自交系分子遗传图谱构建及分蘖角的QTL检测.江苏农业学报, 2012, 28(2): 236-242.
DONG S L, ZHANG Y H, ZHANG Y D, CHEN T, ZHAO Q Y, ZHU Z, ZHOU L H, YAO S, ZHAO L, WANG C L.Construction of molecular genetic linkage map based on a rice RIL population and detection of QTL for tiller angle.Jiangsu Journal of Agricultural Sciences, 2012, 28(2): 236-242.(in Chinese)
[16] 张亚东, 梁文化, 赫磊, 赵春芳, 朱镇, 陈涛, 赵庆勇, 赵凌, 姚姝, 周丽慧, 路凯, 王才林.水稻RIL群体高密度遗传图谱构建及粒型QTL定位.中国农业科学, 2021, 54(24): 5163-5176.
ZHANG Y D, LIANG W H, HE L, ZHAO C F, ZHU Z, CHEN T, ZHAO Q Y, ZHAO L, YAO S, ZHOU L H, LU K, WANG C L.Construction of high-density genetic map and QTL analysis of grain shape in rice RIL population.Scientia Agricultura Sinica, 2021, 54(24): 5163-5176.(in Chinese)
[17] MENG L, LI H, ZHANG L, WANG J.QTL IciMapping: Integrated software for genetic linkage map construction and quantitative trait locus mapping in bi-parental populations.Crop Journal, 2015, 3: 269-283.
[18] MCCOUCH S R, CHO Y G, YANO M, PAUL E, BLINSTRUB M, MORISHIMA H, MCCOUCH S, CHO Y, PAUL E, MORISHIMA H.Report on QTL nomenclature.Rice Genetics Newsletter, 1997, 14: 11-13.
[19] 周莹.水稻中天冬氨酸转氨酶的分子生物学研究和转基因应用[D].武汉: 华中农业大学, 2009.
ZHOU Y.Research of progress molecular biology and application of aspartate aminotransferase in rice[D].Wuhan: Huazhong Agricultural University, 2009.(in Chinese)
[20] 赵全志, 丁艳锋, 王强盛, 黄丕生, 凌启鸿.水稻叶色变化与氮素吸收的关系.中国农业科学, 2006, 39(5): 916-921.
ZHAO Q Z, DING Y F, WANG Q S, HUANG P S, LING Q H.Relationship between leaf color and nitrogen uptake of rice.Scientia Agricultura Sinica, 2006, 39(5): 916-921.(in Chinese)
[21] 范淑秀, 王嘉宇, 毛艇, 徐正进.水稻孕穗期叶绿素含量的QTL定位.华北农学报, 2010, 25(4): 69-72.
FANG S X, WANG J Y, MAO T, XU Z J.Identification of QTLs for chlorophyll content at booting stage in rice.Acta Agriculturae Boreali-Sinica, 2010, 25(4): 69-72.(in Chinese)
[22] 沈波, 庄杰云, 张克勤, 戴伟民, 鲁烨, 傅丽卿, 丁佳铭, 郑康乐.水稻叶绿素含量的QTL及其与环境互作分析.中国农业科学, 2005, 38(10): 1937-1943.
SHEN B, ZHUANG J Y, ZHANG K Q, DAI W M, LU Y, FU L Q, DING J M, ZHENG K L.Analysis of interaction between QTL and environment on chlorophyll contents in rice.Scientia Agricultura Sinica, 2005, 38(10): 1937-1943.(in Chinese)
[23] YANO M, HARUSHIMA Y, NAGAMURA Y, KURATA N, MINOBE Y, SASAKI T.Identification of quantitative trait loci controlling heading date in rice using a high-density linkage map.Theoretical Applied Genetics, 1997, 95(7): 1025-1032.
[24] KOTHARI K S, DANSANA P K, GIRI J, TYAGI A K.Rice stress associated protein 1 () interacts with aminotransferase () and pathogenesis-related 1a protein (OsSCP) and regulates abiotic stress responses.Frontiers in Plant Science, 2016, 7: 1057.
[25] 董骥驰, 杨靖, 郭涛, 陈立凯, 陈志强, 王慧.基于高密度Bin图谱的水稻抽穗期QTL定位.作物学报, 2018, 44(6): 938-946.
DONG J C, YANG J, GUO T, CHEN L K, CHEN Z Q, WANG H.QTL mapping for heading date in rice using high-density Bin map.Acta Agronomica Sinica, 2018, 44(6): 938-946.(in Chinese)
[26] 胡颂平, 梅捍卫, 邹桂花, 刘鸿艳, 刘国兰, 蔡润, 李明寿, 罗利军.正常与水分胁迫下水稻叶片叶绿素含量的QTL分析.植物生态学报, 2006, 30(3): 479-486.
HU S P, MEI H W, ZOU G H, LIU H Y, LIU G L, CAI R, LI M S, LUO L J.Analysis of quantitative trait loci for chlorophyll content in rice leaves under drought stress.Chinese Journal of Plant Ecology, 2006, 30(3): 479-486.(in Chinese)
[27] TENG S, QIAN Q, ZENG D, KUNIHIRO Y, KAN F, HUANG D, ZHU L.QTL analysis of leaf photosynthetic rate and related physiological traits in rice (L.).Euphytica, 2004, 135: 1-7.
[28] 刘进, 姚晓云, 范淑秀, 黎毛毛, 郭乃辉, 王鑫瑞, 王嘉宇, 陈温福.水稻叶绿素含量和穗部性状的QTL及其相互关系分析.沈阳农业大学学报, 2018, 49(6): 641-648.
LIU J, YAO X Y, FAN S X, LI M M, GUO N H, WANG Q R, WANG J Y, CHEN W F.Mapping of QTLs for chlorophyll content and panicle traits and their relationship in rice (L.).Journal of Shenyang Agricultural University, 2018, 49(6): 641-648.(in Chinese)
[29] 胡茂龙, 张迎信, 孔令娜, 杨权海, 王春明, 翟虎渠, 万建民.利用回交重组自交系群体检测3个水稻光合功能相关性状QTL.作物学报, 2006, 32(11): 1630-1635.
HU M L, ZHANG Y X, KONG L N, YANG Q H, WANG C M, ZHAI H Q, WAN J M.QTL Detection for three traits associated with photosynthetic functions in rice using backcross inbred lines.Acta Agronomica Sinica, 2006, 32(11): 1630-1635.(in Chinese)
[30] 李永洪, 李传旭, 刘成元, 何珊, 向箭宇, 谢戎.利用岗46B/A232重组自交系群体分析叶绿素含量相关QTL.西南农业学报, 2018, 31(11):2223-2228.
LI Y H, LI C X, LIU C Y, HE S, XIANG J Y, XIE R.QTL analysis for chlorophyll content using recombinant inbred lines of Gang46B/A232.Southwest China Journal of Agricultural Sciences, 2018, 31(11): 2223-2228.(in Chinese)
[31] JIANG G, ZENG J, HE Y.Analysis of quantitative trait loci affecting chlorophyll content of rice leaves in a double haploid population and two backcross populations.Gene, 2014, 536: 287-295.
[32] 杨国华, 李邵清, 冯玲玲, 孔进, 李辉, 李阳生.水稻剑叶叶绿素含量相关性状的QTL分析.武汉大学学报(理学版), 2006, 52(6): 751-756.
YANG G H, LI S Q, FENG L L, KONG J, LI H, LI Y S.Analysis of QTL underlying the traits relative to the chlorophyll contents of the flag leaf in rice.Journal of Wuhan University (Natural Science Edition), 2006, 52(6): 751-756.(in Chinese)
[33] 孙小霞, 邓家耀, 江宝月, 贾小丽, 熊君, 林文雄.水稻生育后期叶绿素含量的QTLs及其与环境的互作分析.应用生态学报, 2008, 19(12): 2651-2655.
SUN X X, DENG J Y, JIANG B Y, JIA X L, XIONG J, LIN W X.Analysis on quantitative trait loci associated with leaf chlorophyll content and their interactions with environment at late growth stage of rice.Chinese Journal of Applied Ecology, 2008, 19(12): 2651-2655.(in Chinese)
[34] YUE B, XUE W Y, LUO L J, XING Y Z.QTL analysis for flag leaf characteristics and their relationships with yield and yield traits in rice.Acta Genetica Sinica, 2006, 33: 824-832.
[35] 杨树明, 刘关所, 张素华.不同生长环境下水稻孕穗期叶绿素QTL定位.云南大学学报(自然科学版), 2017, 39(4): 684-690.
YANG S M, LIU G S, ZHANG S H.Identification of QTL for chlorophyll contents at booting stage of rice under different growing environments Journal of Yunnan University (Natural Sciences Edition), 2017, 39(4): 684-690.(in Chinese)
[36] CUI K, PENG S, XING Y, YU S, XU C.Molecular dissection of relationship between seedling characteristics and seed size in rice.Acta Botanica Sinica, 2002, 44: 702-707.
[37] SATO Y, MORITA R, KATSUMA S, NISHIMURA M, KUSABA M.Two short-chain dehydrogenase/reductases, NON-YELLOW COLORING 1 and NYC1-LIKE, are required for chlorophyll b and light-harvesting complex II degradation during senescence in rice.The Plant Journal, 2010, 57(1): 120-131.
[38] ISHIMARU K, YANO M, AOKI N, ONO K, HIROSE T, LIN SY, MONNA L, SASAKI T, OHSUGI R.Toward the mapping of physiological and agronomic characters on a rice function map: QTL analysis and comparison between QTLs and expressed sequence tags.Theoretical and Applied Genetics, 2001, 102(6/7): 793-800.
Mapping of QTLs for Chlorophyll Content in Flag Leaves of Rice on High-Density Bin Map
ZHAO Ling, ZHANG Yong, WEI XiaoDong, LIANG WenHua, ZHAO ChunFang, ZHOU LiHui, YAO Shu, WANG CaiLin, ZHANG YaDong*
Institute of Food Crops, Jiangsu Academy of Agricultural Sciences/Jiangsu High Quality Rice R&D Center /Nanjing Branch of China National Center for Rice Improvement, Nanjing 210014
【Objective】Finding new loci and genes related to rice chlorophyll content, and providing new theoretical basis for the research on the genetic mechanism of rice chlorophyll content.【Method】A recombinant inbred line (RIL) population containing 186 lines was constructed by crossing the japonica rice TD70 and the indica rice Kasalath with obvious difference in the chlorophyll content of the flag leaf.The two parents and RIL population were re-sequenced to construct a high-density genetic linkage map with 12 328 recombination Bin markers.The RILs and two parents were planted in fields at the Jiangsu Academy of Agricultural Sciences, in Nanjing in 2011 and 2020.The contents of chlorophyll of flag leaves were directly measured using the chlorophyll meter SPAD-502 on the 3rdday after heading.QTLs that control the chlorophyll content of the flag leaf at the heading stage of rice were detected by IciMappingv3.4 software with inclusive compound interval mapping method.The photosynthesis parameters of 20 SPAD extreme strains in the RIL population were measured with a portable photosynthesis system.【Result】19 QTLs controlling chlorophyll content of flag leaves were detected on 9 chromosomes except Chr.8, Chr.9 and Chr.10 in two years.The phenotype variation explained (PVE) of single QTL ranged from 3.09% to 13.13%, LOD value ranged from 2.74 to 14.08.After comparing the physical positions, 10 QTLs were found to locate in the same interval or adjacent to previously QTLs.andwere detectedevery year showing their genetic stabilitywas mappedbetween the 7.63-7.71 Mb on chromosome 2, and the two-year LOD values are 14.08 and 7.93 with the PVE 13.13% and 7.94%, respectively.was mappedbetween the 23.44-23.49 Mb on chromosome 5, and the two-year LOD values are 4.31 and 3.76, respectively.After the annotation and sequences analysis of genes located in the region ofandtwo genes,and, were found to be associated with chlorophyll content of flag leaves in the rice.There are differences in sequences of the two genes between TD70 and Kasalath.is thegene encoding the Aspartate Aminotransferase, whichis an important enzyme in nitrogen metabolism and related to protein and amino acid content of rice.encodes protein relating to spotted leaf, which might associate with leaf color.Based on the mutation ofat CDS+273 bp, the haplotypes ofwere classified in RIL population.Among the 20 extreme SPAD RIL lines,there were significant differences between different haplotype of【Conclusion】19 QTLs associated with chlorophyll content in flag leaf at heading stage of rice were detected and two stable QTL loci,andwere identified.Two candidate genes were obtained after annotation and sequence comparison.One of them,, was considered as the most possible candidate gene after effort analysis of different haplotypes in photosynthetic efficiency.The QTLs and gene we obtained could be used for subsequent functional studies of flag leaf chlorophyll regulation and molecular marker breeding.
rice (L.); recombinant inbred lines; high-density bin map; chlorophyll content; QTL
2021-10-20;
2021-11-25
江苏省重点研究发展计划(BE2019375)
赵凌,Tel:025-84390306;E-mail:zhaoling@jaas.ac.cn。通信作者张亚东,Tel:025-84390314;E-mail:zhangyd@jaas.ac.cn
(责任编辑 李莉)

