茚虫威降解菌海藻酸钠微球制剂研制及应用效果
汪育泰,许智帆,刘婕,钟国华
茚虫威降解菌海藻酸钠微球制剂研制及应用效果
汪育泰,许智帆,刘婕,钟国华*
华南农业大学植物保护学院,广州 510642
【目的】以海藻酸钠为载体制备降解菌斯氏假单胞菌()ACCC 02521菌株微球制剂,确定该制剂降解农田土壤茚虫威的应用条件。【方法】通过微滴包埋成球法,将湿菌体重悬后加入海藻酸钠溶液,混匀后逐滴滴至CaCl2溶液造粒,低温固定后,以0.9% NaCl溶液洗涤,测定降解菌微球的传质性能和机械强度,确定海藻酸钠最佳浓度。通过单因素优化获得最佳制剂配方,在3.0%海藻酸钠溶液中分别滴入1.0%—5.0% CaCl2溶液、40—200 g·L-1菌量或20—100 g·L-1制剂,根据茚虫威降解率,分别确定降解菌微球制剂CaCl2浓度、包埋菌量和用量。通过扫描电镜观察固菌前后微球形态、降解菌细胞形态和菌群分布情况。在不同类型土壤悬液、温度、pH或不同时间条件下投入定量降解菌微球制剂,通过计算释放菌量(CFU/mL)或茚虫威降解率,评价环境因素对制剂释放能力、降解效果和稳定性的影响。喷雾施用后2 d撒施降解菌微球制剂,采集表层土壤检测茚虫威残留量,确定田间施用剂量,明确制剂田间应用条件。茚虫威残留浓度变化均以HPLC法检测追踪。【结果】制剂由3.0%海藻酸钠、2.0% CaCl2及80 g·L-1降解菌组成,粒径约3.0 mm,降解菌微球粒径大小均匀,机械强度适中,传质性能、降解活性和贮藏稳定性良好。扫描电镜观测表明,降解菌在海藻酸钠微球中分布均匀,菌体形态正常。在10—30℃、pH为6.0—8.0的土壤中,降解菌稳定释放,对茚虫威降解率达到85%以上,释放性能不受土壤类型影响,稳定性良好,受环境条件影响小。田间喷施150 g·L-1茚虫威乳油(EC)有效成分20 mg·L-1后2 d撒施降解菌微球制剂90—900 kg·hm-2时,茚虫威残留半衰期(T1/2)缩短至2.49—3.32 d(空白对照区T1/2为7.53 d);有效成分5、20、50 mg·L-1喷施后2 d,均匀撒施降解菌微球制剂量450 kg·hm-2,土壤茚虫威残留T1/2由6.03—7.45 d缩短至2.34—3.59 d。【结论】以海藻酸钠为载体制备降解菌斯氏假单胞菌微球制剂性能稳定,可显著降解农田土壤茚虫威残留,缩短残留半衰期,为土壤农药残留污染生物修复提供了技术和产品支撑,具有进一步优化和应用的潜力。
茚虫威残留;生物修复;海藻酸钠;斯氏假单胞菌;降解菌制剂
0 引言
【研究意义】茚虫威(indoxacarb)属噁二嗪类钠通道阻断剂型氨基甲酸酯类杀虫剂,对多种作物害虫高效[1-2],与氰氟虫腙、高效氯氰菊酯、溴虫腈可能有交互抗性,与氰虫酰胺、氯虫苯甲酰胺、阿维菌素等常用药剂无明显交互抗性[3],在棉田、稻田和甘蓝田土壤的半衰期为7—11 d[4-6]。茚虫威对快速生长发育期的大鼠具有明显的抑制作用,主要靶器官是脾脏和肝脏[7],对蜜蜂、斑马鱼和家蚕属中等毒性或高毒农药[8];斑马鱼暴露于茚虫威后会出现肝细胞凋亡现象,DNA损伤显著,表现出遗传毒性[9]。土壤农药残留不仅直接影响非靶标生物安全,而且可能会增加作物吸收积累[10-11],研发茚虫威土壤残留污染控制治理技术对于确保其安全高效使用、保障生态环境安全具有重要意义。【前人研究进展】微生物降解是土壤农药残留污染治理的高效安全方法[12-14]。实践中,直接投放活性菌株的方式往往降解效果不佳[15-16]。合适的降解菌(或酶)制剂能够改善降解菌在环境中的存活、定殖、增殖和扩散,提高降解效果。微生物固定化技术是制备降解菌制剂的关键技术,是利用物理或化学手段,将游离微生物定位于限定的空间区域,保持微生物对农药残留物的代谢活性[17-18]。其中,活菌包埋法具有操作条件温和、固定效果好、生物毒性低等特点,有利于保持较高的菌群浓度、存活率和代谢活性,常用于降解菌制剂制备[19-20],如以改性蔗渣MSB-Mo作为载体材料,对降解菌HZ-2固定化处理,制备获得的降解菌制剂3 d对硝磺草酮降解率达到99%[21];采用海藻酸钠(sodium alginate,SA)固定化处理菌株MB-1,对废水中醚苯磺隆5 d降解率达到85%[22]。【本研究切入点】海藻酸钠是一种天然多糖,亲水性强、黏着性小,水合能力强,能与二价阳离子发生交联作用形成凝胶,是一种稳定、环保、生物相容性好的活菌包埋载体[23-27]。本研究利用海藻酸钠与CaCl2交联形成的复合物为降解菌固定化载体,构建高效、稳定、降解活性高的斯氏假单胞菌()制剂,降低农田土壤茚虫威残留,为农产品安全生产提供选用产品。【拟解决的关键问题】明确茚虫威降解菌海藻酸钠微球制剂(简称:降解菌微球制剂)的制备方法及应用条件,维持并提高降解菌在实际环境的存活率、抗逆性及降解活性,为农田茚虫威残留污染生物修复提供技术和产品基础。
1 材料与方法
1.1 降解菌培养
经筛选获得茚虫威降解菌斯氏假单胞菌,进一步研究时购自中国农业微生物菌种保藏管理中心(ACCC),菌株编号为ACCC 02521(降解活性得到验证)。将-80℃冻存菌室温融解后,按0.1%(/)接种至Luria-Bertani(LB)培养基,置于30℃、160 r/min摇床培养24 h。经过4℃、6 500 r/min离心10 min收集菌体沉淀,0.9%生理盐水冲洗离心3次得到湿菌体(约8.0×1010CFU/mL),置于4℃冰箱备用。
1.2 供试药剂
茚虫威标准品(纯度97%)购自上海安谱实验科技股份有限公司;150 g·L-1茚虫威乳油(EC),美国富美实公司生产(PD20101870),色谱级乙腈和甲醇购自赛默飞科技公司,其他试剂均为国产分析纯。
1.3 色谱检测方法
取5 g土壤样品或5 mL含药LB培养基于50 mL离心管,加入5 mL乙腈,涡旋振荡30 s,加入NaCl 3 g后振荡30 s,超声处理30 min,以6 000 r/min离心5 min,取上清液1 mL经0.22 μm微孔有机膜过滤后滤液收集于棕色进样瓶,高效液相色谱法(HPLC)分析。检测条件:Agilent 1260型高效液相色谱仪,C18色谱柱(Athena 250×4.6 mm,5 μm),紫外检测器,乙腈﹕水=80﹕20(﹕)流动相,流速1 mL·min-1,柱温30℃,检测波长310 nm,进样量20 μL。在此方法下,茚虫威峰型尖锐、对称,保留时间6.29 min,标准曲线方程=50.592+39.838,相关系数2=0.997。培养液茚虫威添加浓度1、20、50 mg·L-1,回收率94.3%—101.8%,RSD 2.8%—4.3%;土壤茚虫威添加浓度0.1、1、20、50 mg·kg-1,添加回收率83.5%—102.3%,RSD 2.6%—5.6%。
1.4 降解菌微球制剂的制备及性质检测
将斯氏假单胞菌湿菌体重悬后加入100 mL海藻酸钠溶液(已灭菌处理,下同),混匀后逐滴滴至CaCl2溶液造粒。置于4℃冰箱固定2 h后,用0.9% NaCl溶液洗涤微球3次,室温下置于无菌滤纸充分滤干,移入离心管中密封保存、备用。用游标卡尺测量1 000粒降解菌微球粒径,统计分析其粒径分布情况。
将40 g·L-1菌悬液加入1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%海藻酸钠溶液制备降解菌微球制剂,测定降解菌微球的传质性能[28]和机械强度[29],确定海藻酸钠最佳浓度(传质性能测定方法略有改进,利用图片软件ImageJ分析微球灰度值,值越大表示传质能力越强)。
按上述方法制备两组降解菌微球制剂:(1)将菌悬液按40 g·L-1用量加入到3.0%海藻酸钠溶液(浓度由上述试验确定,下同),然后分别滴入浓度为1.0%、2.0%、3.0%、4.0%、5.0% CaCl2溶液[30];(2)将40、80、120、160、200 g·L-1菌悬液分别加入到3.0%海藻酸钠溶液。将制备得到的两组制剂按60 g·L-1用量加至50 mL摇瓶培养基(pH 7.0,含20 mg·L-1茚虫威)中,于30℃、160 r/min恒温摇床培养7 d,以空白海藻酸钠微球为对照(下同),根据茚虫威降解率,确定降解菌微球制剂中CaCl2浓度和包埋菌量。
将40 g·L-1菌悬液加至3.0%海藻酸钠溶液,按上述方法制备降解菌微球制剂后,分别以制剂量20、40、60、80、100 g·L-1加进50 mL摇瓶培养基(pH 7.0,含20 mg·L-1茚虫威),于30℃、160 r/min恒温摇床培养7 d,测定茚虫威降解率,确定制剂用量。
1.5 降解菌微球内部形态观察
取降解菌微球制备扫描电镜样品,以空白海藻酸钠微球作为对照,观察固菌前后微球形态、降解菌细胞形态和菌群分布情况。扫描电镜样品采用临界点干燥法制备,取降解菌微球剖开,用1 mL生理盐水冲洗两次,加入2.5%戊二醛固定液1 mL,放入4℃冰箱过夜固定。用pH 7.0磷酸盐缓冲液(PBS)处理10 min,共处理3次,用1%锇酸熏蒸固定样品60 min,分别用30%、50%酒精冲洗样品10 min,70%酒精处理2 h,90%、100%酒精冲洗样品10 min。经高真空镀金膜处理,进行扫描电镜观察。
1.6 环境因素对降解菌微球制剂释放能力的影响
设计3组试验:(1)分别在100 mL锥形瓶加入50 g灭菌黄壤土(采集于华南农业大学农场,呈土黄色,粉土含量高,富含矿物质)和50 g灭菌红壤土(采集于湖南省株洲市茶陵县,呈红色,富含铁、铝氧化物),各加入50 mL灭菌水,调节土悬液pH至7.0,加入5 g降解菌微球制剂,置于30℃、160 r/min摇床培养48 h,每隔8 h取样一次,每次取1 mL土悬液在固体LB培养基稀释涂布平板计数(分别稀释105、106、107倍),计算降解菌微球的释放菌量(CFU/mL),考察土壤类型的影响;(2)土壤类型为黄壤土,摇床培养温度分别为10、20、30、40、50℃,其余同(1)组试验,考察温度的影响;(3)土壤类型为黄壤土,调节土悬液pH至5.0、6.0、7.0、8.0、9.0,其余与(1)组试验相同,考察pH的影响。
1.7 环境因素对降解菌微球制剂降解效果的影响
在50 mL灭菌摇瓶培养基(pH 7.0,含20 mg·L-1茚虫威)中,加入3 g降解菌微球制剂,分别在10、20、30、40、50、60℃条件160 r/min恒温摇床培养7 d,测定茚虫威降解率,考察温度对制剂降解效果的影响。将pH分别设置为4.0、5.0、6.0、7.0、8.0、9.0、10.0,培养温度固定为30℃,其余与温度试验条件相同,考察pH对降解菌制剂降解效果的影响。
1.8 降解菌微球制剂的稳定性
设计3组试验:(1)在pH 7.0的PBS加入降解菌微球制剂,分别于10、20、30、40、50、60℃放置24 h。分别取3 g处理后的微球制剂,加至50 mL摇瓶培养基中(pH 7.0,含20 mg·L-1茚虫威),于160 r/min、30℃恒温摇床培养7 d,测定茚虫威降解率,评价温度稳定性;(2)将PBS的pH分别调至4.0、5.0、6.0、7.0、8.0、9.0、10.0,处理温度固定为30℃,其余同(1)组试验,评价pH稳定性;(3)在50 mL灭菌摇瓶培养基中(pH 7.0,含20 mg·L-1茚虫威),分别加入3 g已30℃储存1、2、3、4、5、6、7、8周的降解菌微球制剂,摇床培养条件同(1)试验,评价储存稳定性。
1.9 降解菌微球制剂的田间降解作用
试验地点为华南农业大学教学农场,选取未施用农药半年以上的试验田,划定小区,每小区面积10 m2,各小区间隔0.5 m,对照和处理相间排列,设计两项田间试验:(1)确定降解菌微球制剂田间用量。供试药剂150 g·L-1茚虫威EC按用水量750 L·hm-2兑水稀释至有效成分20 mg·L-1均匀喷雾后2 d,设置6个处理:均匀撒施降解菌微球制剂量90、450、900 kg·hm-2,降解菌液组(原液1×109CFU/mL用量10 L·hm-2,用水量750 L·hm-2),海藻酸钠微球组(不含降解菌,用量450 kg·hm-2),清水对照组(用水量750 L·hm-2)。施用后0、1、3、5、7、14、21、28 d,采集0—10 cm表层土壤,以HPLC法检测茚虫威残留量计算半衰期(T1/2);(2)确定微球制剂推荐剂量对茚虫威不同残留量的降解作用。供试150 g·L-1茚虫威EC清水750 L·hm-2稀释至有效成分5、20、50 mg·L-1田间喷施后2 d,均匀撒施降解菌微球制剂450 kg·hm-2,茚虫威残留检测和半衰期计算方法同试验(1)。
1.10 数据统计与分析
各项试验于2019—2021年完成,各处理及对照均设3个重复。降解率(%)=(1-At/A0)×100,其中,At表示反应时间t时降解菌制剂处理组茚虫威浓度,A0为空白对照组茚虫威浓度。降解动力学符合一级动力学模型:Ct=C0×e-k t,其中,Ct为在反应时间t时的茚虫威残留浓度(mg·kg-1),C0为茚虫威起始浓度,为降解速率常数(d-1),半衰期T1/2=ln2/(d)。数据和图表采用SPSS25软件处理,差异显著性采用DMRT法(=0.05)。
2 结果
2.1 降解菌微球制剂配方的确定
通过检验不同用量海藻酸钠、CaCl2及包埋菌量对微球形态、结构及降解活性的影响,明确降解菌微球制剂配方。当海藻酸钠用量为3.0%时,微球形态完整,机械强度好,传质性能佳,其他用量出现不同程度造粒难、机械强度差、传质效率低等问题(表1)。
恒温摇床培养7 d后,当CaCl2浓度为2.0%时,降解菌微球制剂对茚虫威降解率最高,为96.73%,浓度超过2.0%后,可能因CaCl2与海藻酸钠交联形成的微球密度过大,阻碍降解菌释放或生长,导致茚虫威降解率下降(图1-A)。包埋菌量为80 g·L-1时,降解菌微球制剂对茚虫威降解率最高,为95.51%(图1-B)。综上确定茚虫威降解菌微球制剂配方为3.0%海藻酸钠、2.0% CaCl2及80 g·L-1降解菌。随机测量1 000粒微球直径,表明微球粒径为(3.0±0.5)mm,其中95.1%微球粒径介于2.8—3.2 mm(图1-D),说明制备所得的降解菌微球粒径均匀。
通过扫描电镜观察发现,降解菌群在海藻酸钠微球里分布均匀,菌体形态正常,结构稳定,表明降解菌与海藻酸钠形成稳定的固定化复合物(图2-A、2-B),可进一步检测降解特性。
2.2 降解菌微球制剂的降解特性
由图3-A可知,在10—40℃范围内降解菌微球制剂释放的菌量差异不显著,温度升至50℃时释放菌量显著下降,说明在常温范围内降解菌微球制剂保持稳定的释放能力;其次,在10—30℃范围内降解菌微球制剂对茚虫威降解效果好,处理48 h后降解率95%以上,但50—60℃时,降解率显著下降(图3-B),说明50℃以上时影响降解菌剂的降解活性,菌量释放与降解效率趋势一致。
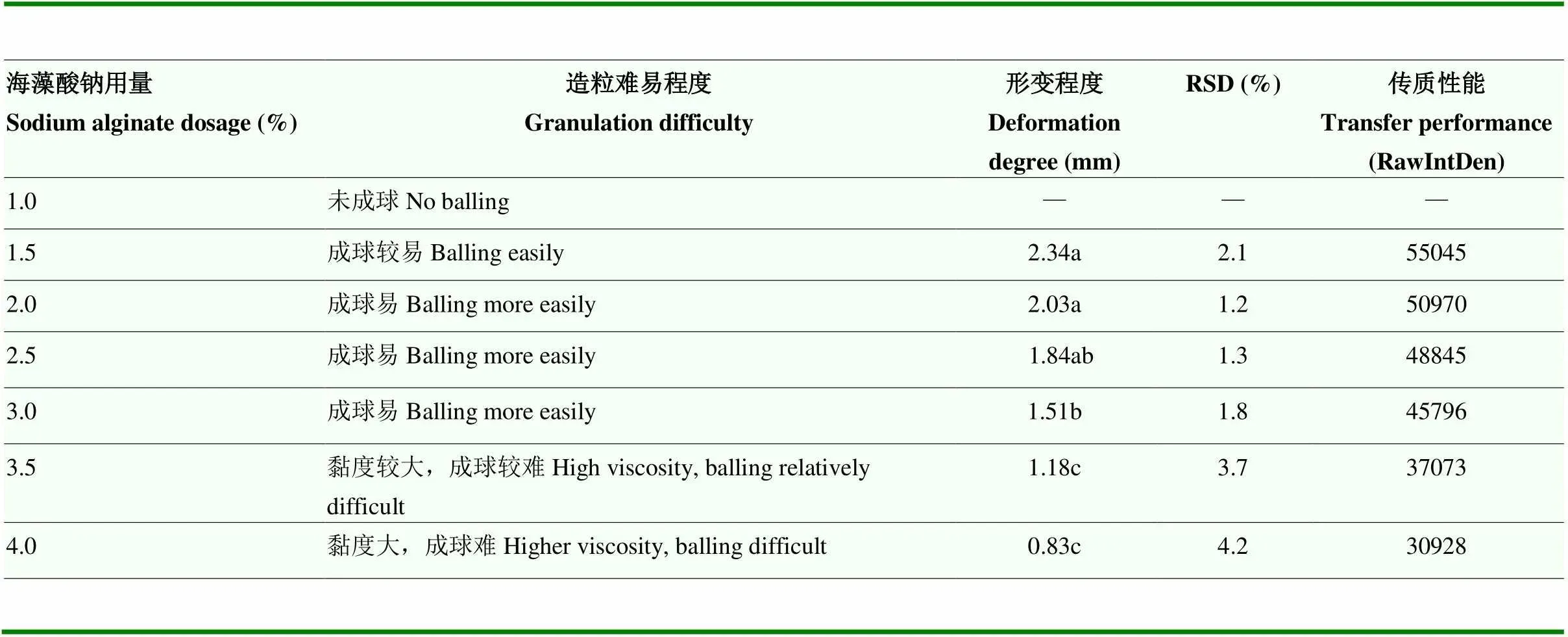
表1 海藻酸钠用量对降解菌微球性能的影响
同列数据后小写字母相同表示差异不显著(DMRT法,=0.05)
The same lowercase letters after the data in the same column indicate no significant difference (DMRT method,=0.05)
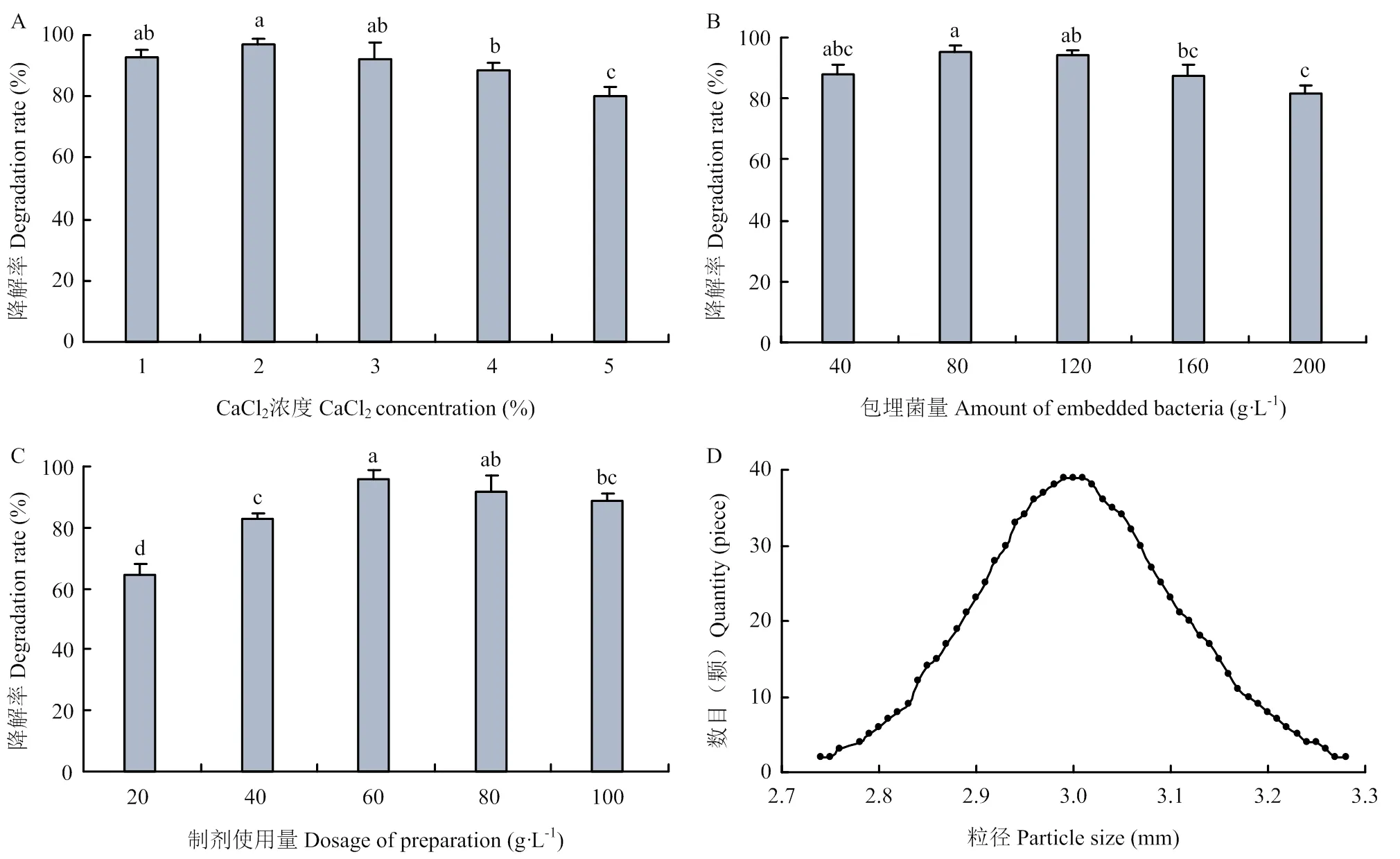
CaCl2浓度(A)、包埋菌量(B)、制剂使用量(C)对微球制剂降解率的影响 Effects of CaCl2 concentration (A), amount of embedded bacteria (B), and preparation dosage (c) on microspheres degradation rate;D:降解菌微球制剂的粒径分布图(n=1000) Particle size distribution of microspheres of degrading bacteria (n=1000)。柱上小写字母相同表示差异不显著(DMRT法,P=0.05)The same lowercase letters on the bars indicate no significant difference (DMRT method, P=0.05)。下同The same as below

A:未添加降解菌Without degrading bacteria;B:固定降解菌Immobilization of degrading bacteria
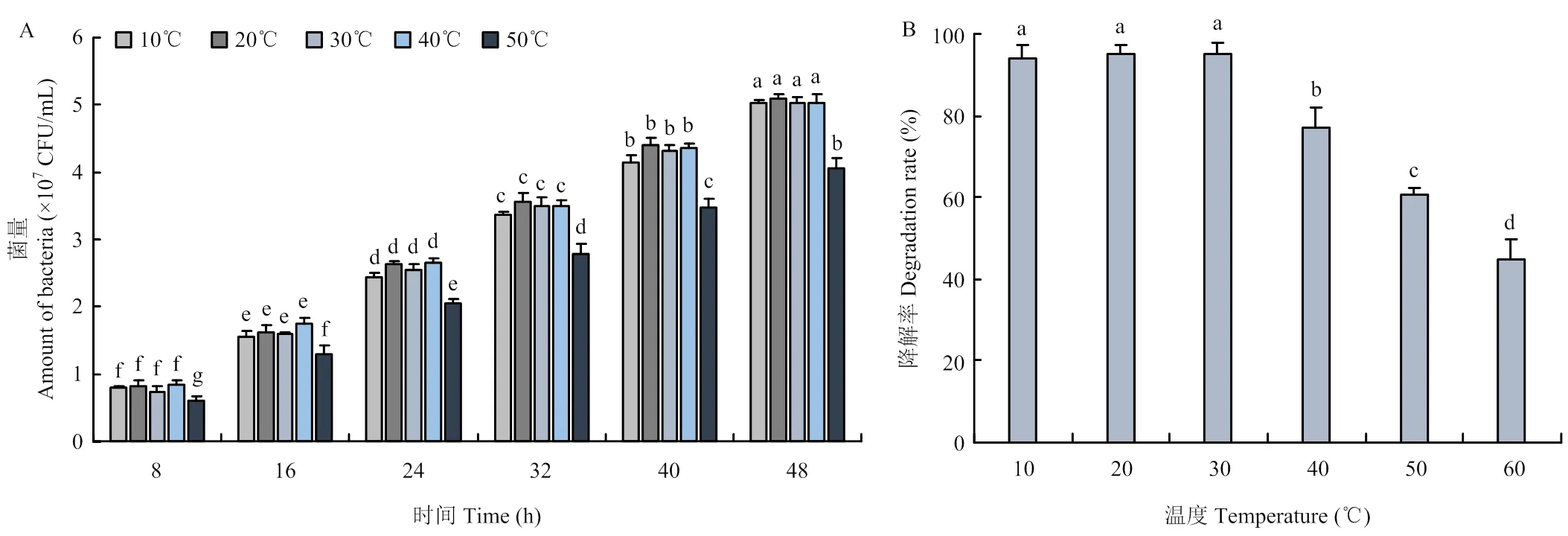
A:微球释放能力Release capacity of microspheres;B:制剂降解效果Degradation effect of bacteria preparation
不同pH显著影响降解菌制剂释放性能,pH为6.0—9.0时菌量释放稳定,在pH 5.0条件下释放菌量明显下降,说明中性偏碱环境有利于降解菌释放(图4-A);pH为6.0—8.0时,茚虫威降解率保持在85%以上,稳定性较好,但pH为4.0、5.0、10.0时,降解率降至60%以下,说明过于酸性或碱性环境均不利于发挥降解效果(图4-B),与菌量释放的趋势相似。
供试黄壤土和红壤土水悬液中投放降解菌微球制剂8—48 h,随时间延长,茚虫威降解菌量均增加,但相同时间内两种土壤水悬液释放菌量差异均不显著(图5),说明土壤类型对降解菌微球制剂的释放能力影响不明显。降解菌微球制剂在30℃保存3周内对茚虫威降解率90%以上,保存8周内对茚虫威降解率81%以上,随着保存时间的延长降解率略有降低(图6)。
2.3 降解菌微球制剂的田间应用效果
田间喷施150 g·L-1茚虫威EC有效成分20 mg·L-1后2 d,均匀撒施降解菌微球制剂90、450、900 kg·hm-2或喷施降解菌菌液处理后28 d,均能显著降低土壤茚虫威残留水平(图7),空白对照(CK)和仅撒施等量微球时半衰期T1/2分别为7.53 d和6.30 d,喷施降解菌菌液处理T1/2为4.20 d,降解菌微球制剂处理T1/2缩短至2.49—3.32 d(表2),说明制剂处理可显著提高茚虫威在土壤中的降解速率。基于制剂成本考量,降解菌微球制剂田间应用推荐用量为450 kg·hm-2。
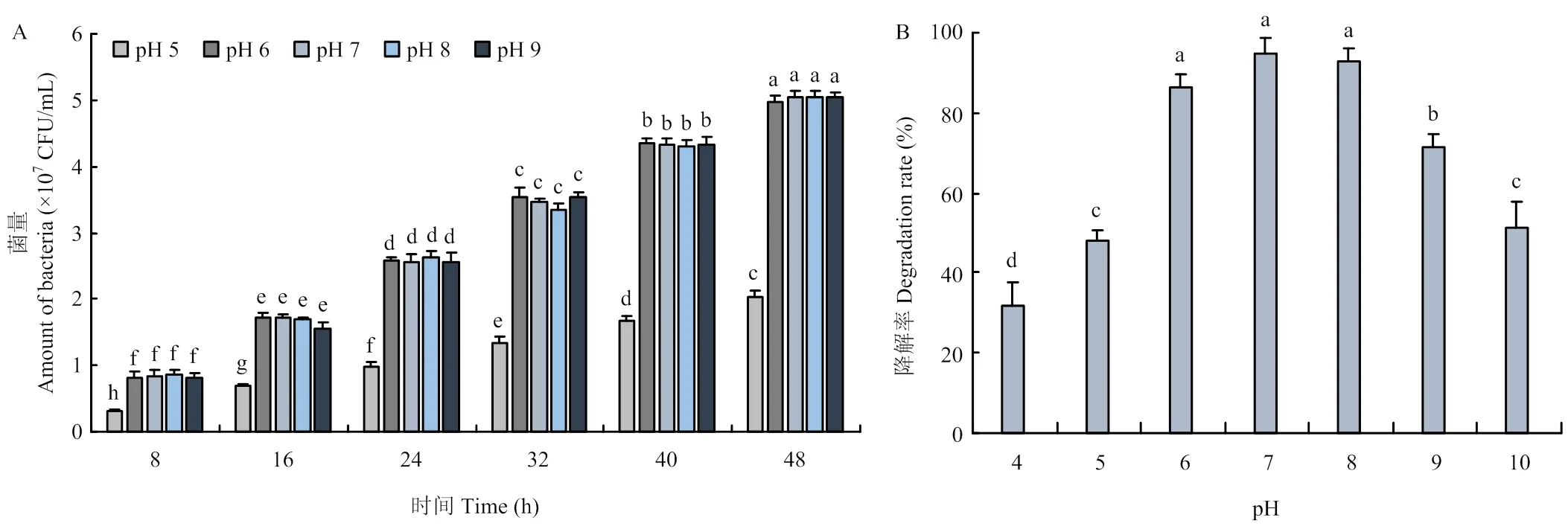
图4 pH对降解菌微球制剂释放能力(A)和降解率(B)的影响
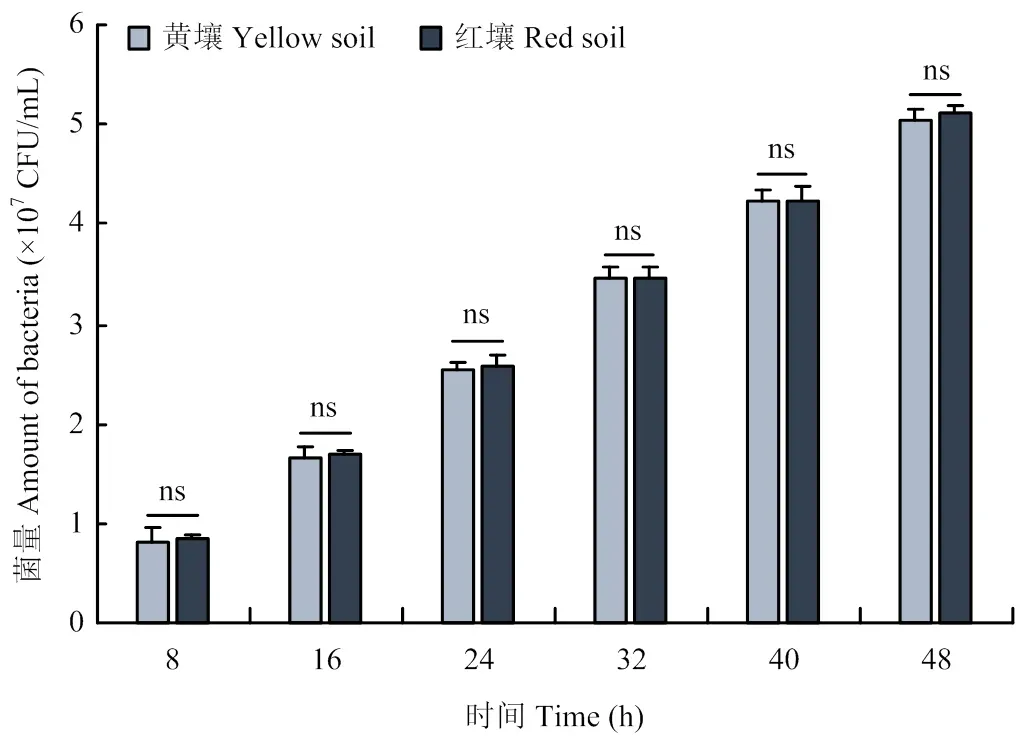
图5 土壤类型对降解菌微球制剂释放能力的影响

图6 降解菌微球制剂的储存稳定性
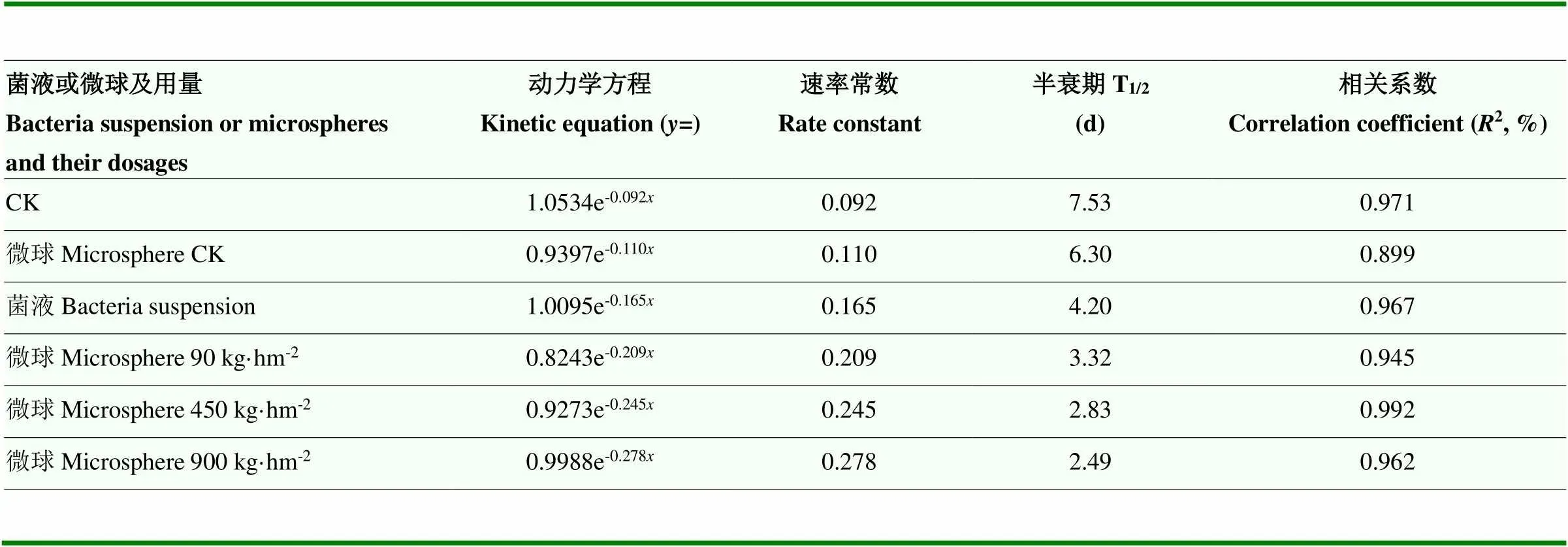
表2 降解菌微球制剂对田间土壤茚虫威半衰期的影响
:农药残留量pesticide residue (mg·kg-1);:降解时间degradation time (d)。表3同 The same as Table 3
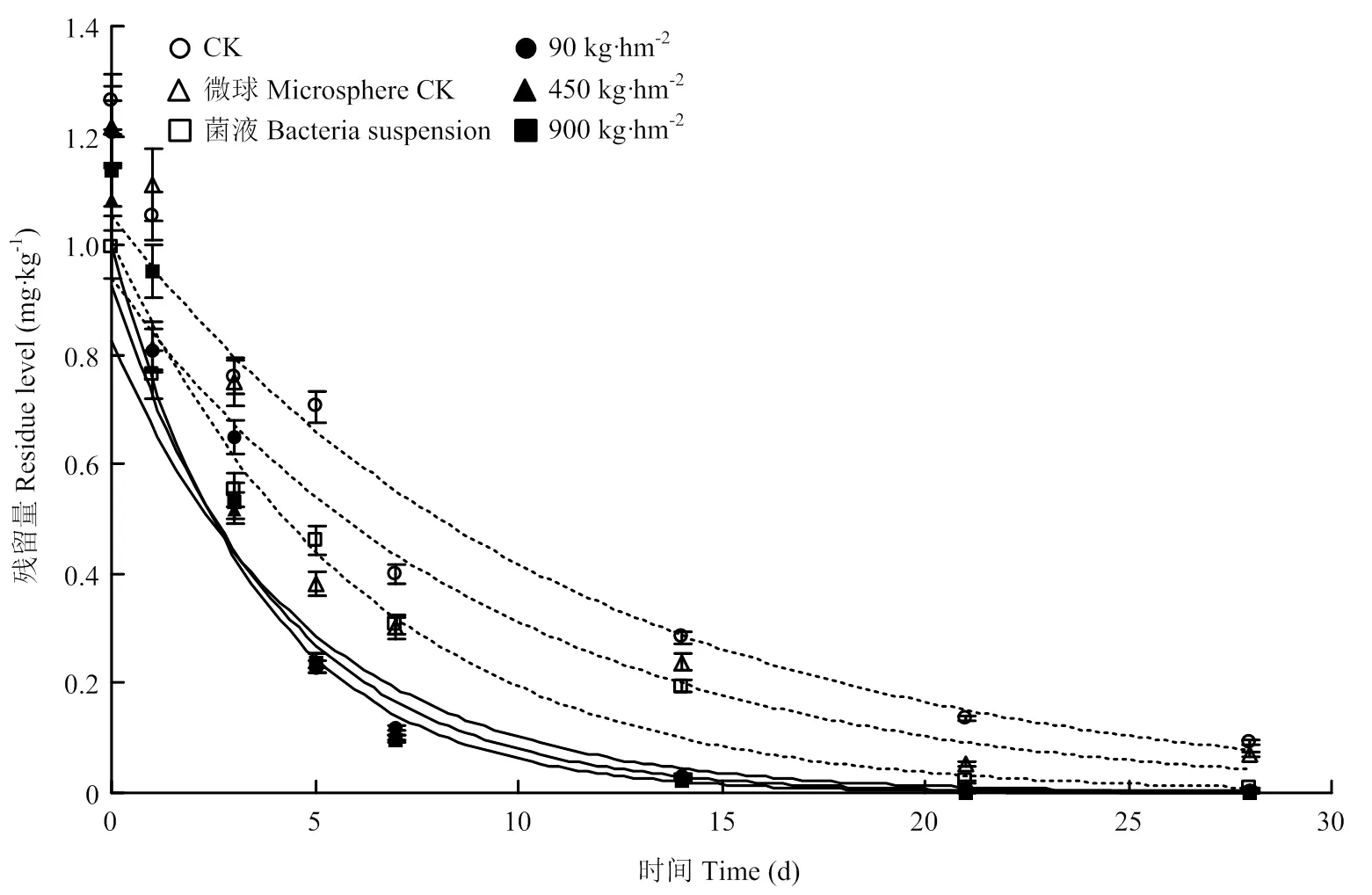
图7 降解菌微球制剂对田间土壤茚虫威的降解效果
供试150 g·L-1茚虫威EC以有效成分5、20、50 mg·L-1田间喷施后2 d,均匀撒施降解菌微球制剂量450 kg·hm-2,28 d后对土壤茚虫威残留降解率分别达到93.5%、92.7%、91.2%(图8),其T1/2缩短至2.34—3.59 d(表3),分别比未撒施降解菌微球制剂同剂量处理的T1/2缩短52%—61%,说明所制备的降解菌微球制剂能显著提高土壤中茚虫威的降解速率,缩短半衰期,生物修复效果良好,具有应用潜力。
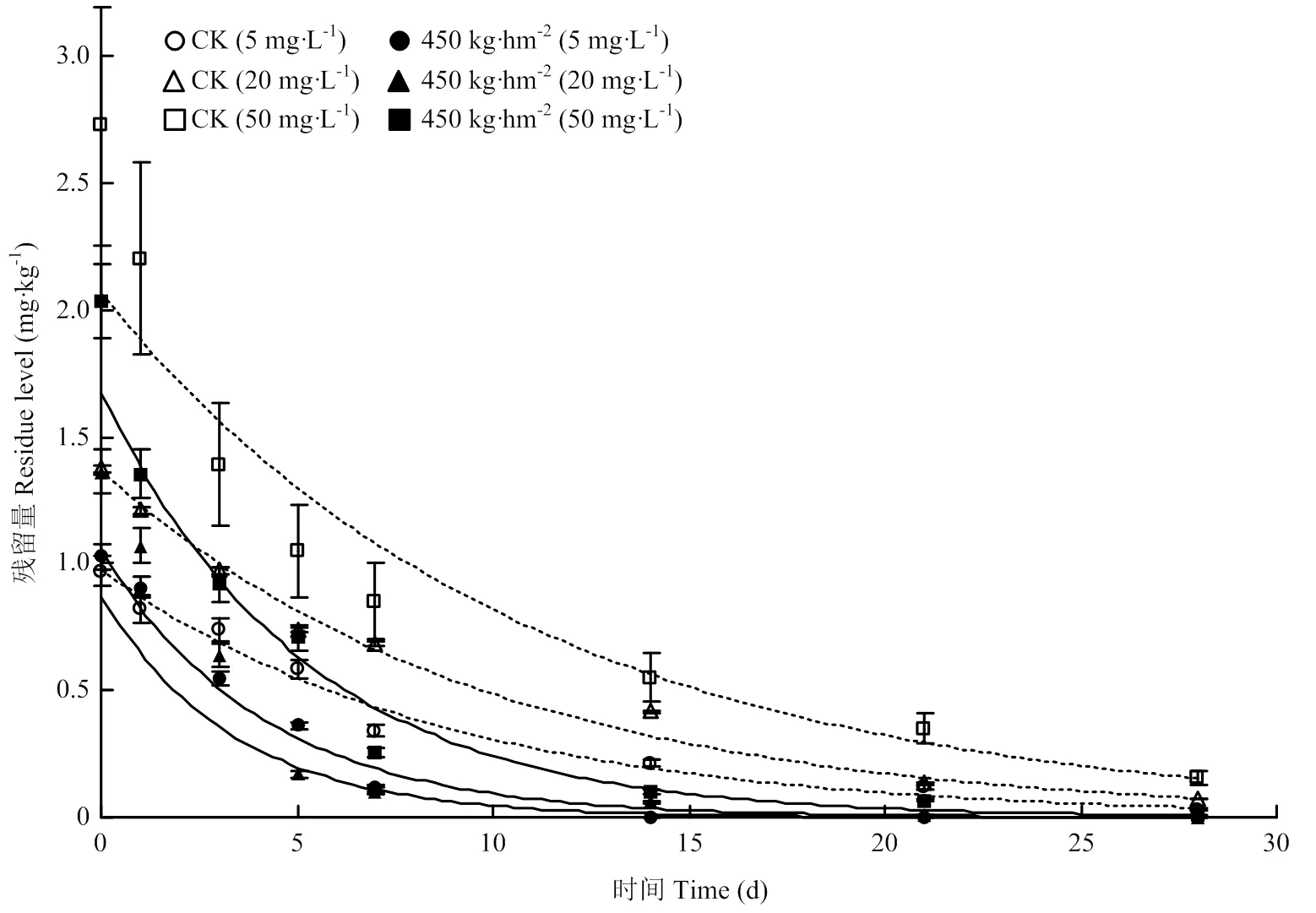
图8 降解菌微球制剂对土壤中不同初始含量茚虫威的降解效果
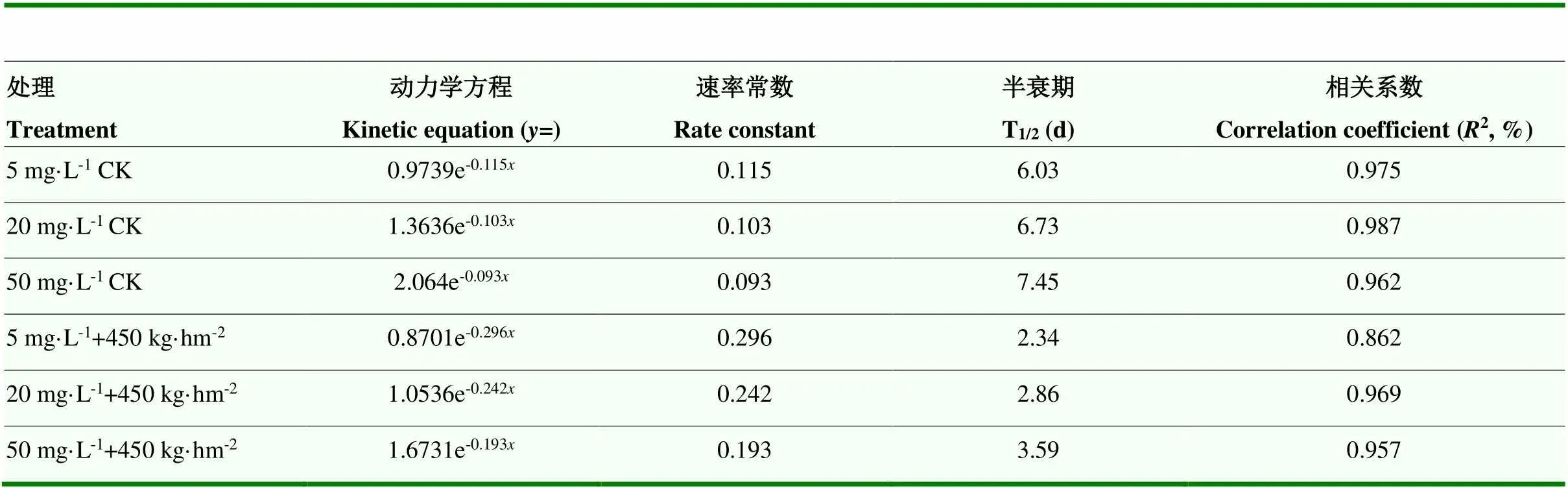
表3 降解菌制剂450 kg·hm-2处理对土壤茚虫威半衰期的影响
3 讨论
3.1 海藻酸钠包埋法适用于农药降解菌固定化
农药残留微生物降解本质上是降解菌与外源农药的酶促代谢反应,由于该过程易受环境因素影响,因此如何使目标微生物固定、定殖、增殖并保持降解活性成为实践应用中需要突破的关键。目前微生物固定化方法主要有吸附法、交联法、结合法和包埋法,不同的固定方法和载体材料制成的降解菌制剂差别很大,这是影响制剂中功能微生物释放性能的重要原因[28]。如使用海藻酸钠作为载体,以葡萄糖为辅助材料固定化降解菌,制备降解菌制剂,能显著提高对甲基对硫磷和杀虫畏两种农药的降解率[29];以玉米秆、麦秆、花生壳等作为载体分别固定化处理降解菌白腐真菌sp.、,5 d内对土壤中克百威和毒死蜱降解率分别为69.83%、74.69%,稳定性和降解效果增强[30];利用生物炭固定化处理菌株湛江芽孢杆菌()TJTB48、假坚强芽孢杆菌()TJTB58和金氏海洋杆菌()TJTB66,制备降解菌制剂,在40 d内土壤中氯氰菊酯降解率82.18%,半衰期缩短了6.4 d,降解效果优于单菌株对氯氰菊酯的降解[31]。采用包埋法制备农药降解菌制剂具有成本低廉、操作简单等特点,有利于提高制剂中降解菌种群密度,增强代谢稳定性和环境抗逆性,从而提高环境存活率和降解活性[32-34]。选用易于获取、易于操作、对活性菌株无毒害作用的固定化载体是提高包埋效率的关键[35]。本研究采用环境友好、生物相容性高的天然多糖海藻酸钠为降解菌载体的主要组分,通过与CaCl2交联形成匀质、多孔且具备一定机械抗压能力的微球状载体,通过微滴包埋法固定活菌细胞,制成茚虫威降解菌海藻酸钠微球制剂。结果表明,固定后降解菌均匀、广泛附着于微球的孔隙内,其存活率、降解活性不受影响,且菌株对外部环境的抗逆性显著提高,说明海藻酸钠包埋法适用于农药降解菌固定化。然而,高温灭菌在一定程度可能破坏海藻酸钠结构,影响与CaCl2的交联反应,导致黏性降低,在后续研究中应进一步优化海藻酸钠载体配置,提高耐热性等结构稳定性,或采用其他灭菌方式以满足无菌制备的需求。
3.2 农药降解菌制剂应用中有待解决的重点问题
本文研制的降解菌微球制剂,降解菌在微球中附着良好,分布广泛,明确了温度、pH、土壤类型、菌剂使用量、贮存时间、土壤农药用量等因素对微球制剂降解茚虫威残留的影响,但成本还较高,降解对象特异性较高,离实践应用还有一定差距,需要进一步完善。由于降解菌制剂在土壤中的释放性能不稳定、土壤中降解菌的存活率不高、降解活性低、制备成本高、载体材料二次污染问题等原因,大部分微生物固定化的技术还难以推广应用到田间。农药降解菌要从理论走向实践,应解决的关键问题包括:(1)高效广谱的菌株,尤以降解谱较宽、环境适合度高、安全性能好的菌种至关重要;(2)合适的载体材料和固定方法,为了避免载体材料的二次污染问题,可以通过使用天然有机材料来解决,如琼脂、海藻酸钠、壳聚糖等,或者应用甘蔗渣、蚕沙、植物纤维等生物质材料,这些材料均生物相容性强、对环境友好[19,36-37];(3)制剂田间应用条件,包括菌剂剂型(如制成液态制剂还是固体制剂)、菌剂使用量、使用方法(如喷雾还是撒施)等,重视目标残留农药污染程度、土壤类型、pH、温度、湿度、作物环境对菌剂发挥效果的影响,要解决降解菌制剂生产和使用成本的“瓶颈”,提高效益,才能真正推广应用。
4 结论
以海藻酸钠为载体制备降解菌(斯氏假单胞菌)微球制剂,当海藻酸钠浓度为3.0%、CaCl2浓度为2.0%、包埋菌量为80 g·L-1时,所得降解菌微球粒径大小均匀,机械强度适中、传质性能良好;降解菌在海藻酸钠微球中分布均匀,菌体形态正常;制剂的释放能力及稳定性良好,受环境条件影响小,贮藏稳定性较好;田间试验表明,按制剂用量450 kg·hm-2处理,田间土壤茚虫威半衰期显著缩短至2.34—3.59 d,为土壤茚虫威残留污染生物修复提供了技术基础和产品支撑,具有进一步优化的潜力和应用的前景。
[1] 刘长令.新型高效杀虫剂茚虫威.农药, 2003, 42(2): 42-44.
LIU C L.New high effective insecticide indoxacarb.Agrochemicals, 2003, 42(2): 42-44.(in Chinese)
[2] 李富根, 艾国民, 李友顺, 朱春雨, 高希武.茚虫威的作用机制与抗性研究进展.农药, 2013, 52(8): 558-560, 572.
LI F G, AI G M, LI Y S, ZHU C Y, GAO X W.Progress on mechanism of action and insecticide resistance of the oxadiazine indoxacarb in insects.Agrochemicals, 2013, 52(8): 558-560, 572.(in Chinese)
[3] ZHANG S Z, ZHANG X L, SHEN J, LI D Y, WAN H, YOU H, LI J H.Cross-resistance and biochemical mechanisms of resistance to indoxacarb in the diamondback moth,.Pesticide Biochemistry and Physiology, 2017, 140: 85-89.
[4] 董丰收, 郑永权, 沙宪英, 李硕, 姚建仁.茚虫威15%悬浮剂在棉花和土壤中的残留动态研究.农业环境科学学报, 2005, 24(5): 1027-1031.
DONG F S, ZHENG Y Q, SHA X Y, LI S, YAO J R.Residue dynamics of indoxacarb 15% SC in cotton and soil.Journal of agro-environment science, 2005, 24(5): 1027-1031.(in Chinese)
[5] 李畅方, 何强, 徐伟松, 杨群华, 江燕玲, 李桂英.茚虫威在甘蓝和土壤中的残留量及消解动态研究.农药科学与管理, 2005, 26(12): 8-11.
LI C F, HE Q, XU W S, YANG Q H, JIANG Y L, LI G Y.Residue and dynamic degradation studies of indoxacarb in cabbage and soil.Pesticide Science and Administration, 2005, 26(12): 8-11.(in Chinese)
[6] 彭筱, 龚道新.茚虫威在水稻田中的消解动态.农药, 2013, 52(4): 284-286.
PENG X, GONG D X.Residual dynamics of indoxacarb in paddy field.Agrochemicals, 2013, 52(4): 284-286.(in Chinese)
[7] 陈坚峰, 胡勃, 张丽娜, 胡楚源, 胡雄飞.茚虫威对大鼠的亚慢性毒性.中国工业医学杂志, 2014, 27(1): 44-45, 47.
CHEN J F, HU B, ZHANG L N, HU C Y, HU X F.Subchronic toxicity of indoxacarb in rats.Chinese Journal of Industrial Medicine, 2014, 27(1): 44-45, 47.(in Chinese)
[8] 俞瑞鲜, 赵学平, 吴长兴, 吴声敢, 苍涛, 陈丽萍, 王强.茚虫威对环境生物的安全性评价.农药, 2009, 48(1): 47-49.
YU R X, ZHAO X P, WU C X, WU S G, CANG T, CHEN L P, WANG Q.Evaluation of indoxacarb to environmental organisms.Agrochemicals, 2009, 48(1): 47-49.(in Chinese)
[9] 冯青, 赖柯华, 黄伟康, 刘禹杉, 李江, 章程辉, 范咏梅.茚虫威对斑马鱼的急性毒性及遗传毒性.生态毒理学报, 2015, 10(4): 226-234.
FENG Q, LAI K H, HUANG W K, LIU Y S, LI J, ZHANG C H, FAN Y M.Acute and genetic toxicity of indoxacarb to zebrafish ().Asian Journal of Ecotoxicology, 2015, 10(4): 226-234.(in Chinese)
[10] Monteiro H R, Pestana J L, Novais S C, Soares A M, Lemos M F.Toxicity of the insecticides spinosad and indoxacarb to the non-target aquatic midge.Science of the Total Environment, 2019, 666: 1283-1291.
[11] 徐汉虹.植物化学保护学.5版.北京: 中国农业出版社, 2018: 239-240.
XU H H.Plant Chemical Protection.5th ed.Beijing: China Agriculture Press, 2018: 239-240.(in Chinese)
[12] MORILLO E, VILLAVERDE J.Advanced technologies for the remediation of pesticide-contaminated soils.Science of the Total Environment, 2017, 586: 576-597.
[13] ALEXANDRINO D A M, MUCHA A P, ALMEIDA C M R, CARVALHO M F.Microbial degradation of two highly persistent fluorinated fungicides - epoxiconazole and fludioxonil.Journal of Hazardous Materials, 2020, 394: 122545.
[14] VALDIVIA-RIVERA S, AYORA-TALAVERA T, LIZARDI- JIMÉNEZ M A, GARCÍA-CRUZ U, CUEVAS-BERNARDINO J C, PACHECO N.Encapsulation of microorganisms for bioremediation: Techniques and carriers.Reviews in Environmental Science and Bio/
Technology, 2021, 20: 815-838.
[15] BASTIDA F, JEHMLICH N, LIMA K, MORRIS B, RICHNOW H, HERNANDEZ T, BERGEN M, GARCIA C.The ecological and physiological responses of the microbial community from a semiarid soil to hydrocarbon contamination and its bioremediation using compost amendment.Journal of Proteomics, 2016, 135: 162-169.
[16] CHEN M, XU P, ZENG G M, YANG C P, HUANG D L, ZHANG J C.Bioremediation of soils contaminated with polycyclic aromatic hydrocarbons, petroleum, pesticides, chlorophenols and heavy metals by composting: Applications, microbes and future research needs.Biotechnology Advances, 2015, 33(6): 745-755.
[17] 杨宗政, 许文帅, 吴志国, 曹井国, 武莉娅, 王春虎, 赵晓宇.微生物固定化及其在环境污染治理中的应用研究进展.微生物学通报, 2020, 47(12): 4278-4292.
YANG Z Z, XU W S, WU Z G, CAO J G, WU L Y, WANG C H, ZHAO X Y.microbial immobilization in environmental pollution treatment: A review.Microbiology China, 2020, 47(12): 4278-4292.(in Chinese)
[18] YUAN Y, ZHOU L H, HOU R, WANG Y, ZHOU S G.Centimeter- long microbial electron transport for bioremediation applications.Trends in Biotechnology, 2021, 39(2): 181-193.
[19] 李海玲, 陈丽华, 肖朝虎, 哈斯其美格.微生物固定化载体材料的研究进展.现代化工, 2020, 40(8): 58-61, 66.
LI H L, CHEN L H, XIAO C H, HA S Q M G.Research progress in microorganisms immobilized carrier materials.Modern Chemical Industry, 2020, 40(8): 58-61, 66.(in Chinese)
[20] BOUABIDI Z B, EL-NAAS M H, ZHANG Z E.Immobilization of microbial cells for the biotreatment of wastewater: A review.Environmental Chemistry Letters, 2019, 17: 241-257.
[21] 张晶晶, 杨孟然, 刘婕, 蒋刚彪, 钟国华.硝磺草酮降解菌HZ-2制剂固定化载体材料性能的比较.华南农业大学学报, 2016, 37(3): 86-89.
ZHANG J J, YANG M R, LIU J, JIANG G B, ZHONG G H.Pexformance comparison of different carrier materials for immobilization of mesotrione-degrading strain HZ-2.Journal of South China Agricultural University, 2016, 37(3): 86-89.(in Chinese)
[22] 肖烜, 蔡天明, 陈立伟, 姜灿烂, 李辉信.一株醚苯磺隆降解菌的分离、鉴定及固定化应用研究.环境工程, 2015, 33(12): 24-28, 68.
XIAO X, CAI T M, CHEN L W, JIANG C L, LI H X.Isolation, identification and immobilization application of a triasulfuron degrading strain.Environmental Engineering, 2015, 33(12): 24-28, 68.(in Chinese)
[23] 李琦, 杨晓玫, 张建贵, 冯影, 杨琰珊, 白洁, 姚拓.农用微生物菌剂固定化技术研究进展.农业生物技术学报, 2019, 27(10): 1849-1857.
LI Q, YANG X M, ZHANG J G, FENG Y, YANG Y S, BAI J, YAO T.Research progress on immobilization technology of agricultural microbial agents.Journal of Agricultural Biotechnology, 2019, 27(10): 1849-1857.(in Chinese)
[24] 刘炉英, 刘锦辉, 胡小刚.基于核酸适配体修饰复合纳米纤维的分散固相萃取技术在赭曲霉毒素A检测中的应用.分析化学, 2021, 49(12): 2096-2105.
LIU L Y, LIU J H, HU X G.Dispersive solid-phase extraction technology based on aptamer modified composite nanofibers and its application in detection of ochratoxin A.Chinese Journal of Analytical Chemistry, 2021, 49(12): 2096-2105.(in Chinese)
[25] SANCHEZ-BALLESTER N M, BATAILLE B, SOULAIROL I.Sodium alginate and alginic acid as pharmaceutical excipients for tablet formulation: Structure-function relationship.Carbohydrate Polymers, 2021, 270: 118399.
[26] OUYANG X F, YIN H, YU X L, GUO Z Y, ZHU M H, LU G N, DANG Z.Enhanced bioremediation of 2,3′,4,4′,5-pentachlorodiphenyl by consortium GYB1 immobilized on sodium alginate-biochar.Science of the Total Environment, 2021, 788: 147774.
[27] BHATT P, RENE E R, KUMAR A J, GANGOLA S, KUMAR G, SHARMA A, ZHANG W P, CHEN S H.Fipronil degradation kinetics and resource recovery potential ofsp.strain FA4 isolated from a contaminated agricultural field in Uttarakhand, India.Chemosphere, 2021, 276: 130156.
[28] ZDARTA J, MEYER A S, JESIONOWSKI T,PINELO M.Developments in support materials for immobilization of oxidoreductases: A comprehensive review.Advances in Colloid and Interface Science, 2018,258:1-20.
[29] YAÑEZ-OCAMPO G, SANCHEZ-SALINAS E, JIMENEZ-TOBON G A,PENNINCKX M, ORTIZ-HERNÁNDEZ M L.Removal of two organophosphate pesticides by a bacterial consortium immobilized in alginate or tezontle.Journal of Hazardous Materials, 2009,168(2/3):1554-1561.
[30] 吴贺军.固定化白腐真菌对农药污染土壤的原位修复[D].沈阳: 沈阳工业大学, 2016.
WU H J.remediation of pesticide contaminated soil by immobilized white rot fungi[D].Shenyang: Shenyang University of Technology, 2016.(in Chinese)
[31] LIU J, DING Y, MA L,GAO G H, WANG Y Y.Combination of biochar and immobilized bacteria in cypermethrin-contaminated soil remediation.International Biodeterioration and Biodegradation, 2017,120:15-20.
[32] 侯连刚, 李军, 陈光辉, 梁东博.微生物菌体包埋固定化技术在废水处理中的应用.水处理技术, 2019, 45(1): 1-5.
HOU L G, LI J, CHEN G H, LIANG D B.Application of microorganism immobilization in wastewater treatment.Technology of Water Treatment, 2019, 45(1): 1-5.(in Chinese)
[33] Thakur S, Sharma B, Verma A, Chaudhary J, Tamulevicius S, Thakur V K.Recent progress in sodium alginate based sustainable hydrogels for environmental applications.Journal of Cleaner Production, 2018, 198: 143-159.
[34] HECHT H, SREBNIK S.Structural characterization of sodium alginate and calcium alginate.Biomacromolecules, 2016, 17(6): 2160-2167.
[35] DOU R N, SUN J T, LU J, DENG F C, YANG C, LU G N, DANG Z.Bacterial communities and functional genes stimulated during phenanthrene degradation in soil by bio-microcapsules.Ecotoxicology and Environmental Safety, 2021, 212: 111970.
[36] LIU J, MORALES-NARVÁEZ E, VICENT T, MERKOÇI A, ZHONG G H.Microorganism-decorated nanocellulose for efficient diuron removal.Chemical Engineering Journal, 2018, 354: 1083-1091.
[37] LIU J, CHEN S H, DING J, XIAO Y, HAN H T, ZHONG G H.Sugarcane bagasse as support for immobilization ofHZ-2 and its use in bioremediation of mesotrione-contaminated soils.Applied Microbiology and Biotechnology, 2015, 99(24): 10839-10851.
Preparation and Application of Indoxacarb degrading Bacteria immobilized Sodium Alginate Microspheres
WANG Yutai, XU Zhifan, LIU Jie, ZHONG Guohua*
College of Plant Protection, South China Agricultural University, Guangzhou 510642
【Objective】The objective of this study is to prepare microsphere of degrading bacterium(ACCC 02521) with sodium alginate as carrier, and to establish the application conditions for degrading indoxacarb in farmland.【Method】Through the micro drop embedding ball forming method, bacteria were suspended and added into sodium alginate solution.After mixing, it was dropped into CaCl2for granulation.It was washed with 0.9% NaCl after fixing at low temperature.The mass transfer performance and mechanical strength of degrading bacteria microspheres were measured to determine the optimal concentration of sodium alginate.The best formulation was obtained by single factor optimization.1.0%-5.0% CaCl2, 40-200 g·L-1bacteria or 20-100 g·L-1preparation were dropped into 3.0% sodium alginate, respectively.The CaCl2concentration, embedded bacteria and preparation dosage in the degrading bacteria microspheres were determined according to the degradation rate of indoxacarb.The morphology of microspheres, cell morphology and distribution of degrading bacteria were observed by scanning electron microscope.Quantitative degrading bacteria microspheres were put into different types of soil suspension, temperature, pH or treatment time.The effects of environmental factors on the release capacity, degradation effect and stability of degrading bacteria microspheres were evaluated by calculating the amount of released bacteria (CFU/mL) or the degradation rate of indoxacarb.Two days after the routine application of pesticides, the degrading bacteria microsphere preparation was applied.Topsoil was collected to detect the residue of indoxacarb, the field application of dose was determined, and the field application conditions of the preparation were determined.The residual concentrations of indoxacarb were detected and tracked by HPLC.【Result】The preparation was composed of 3.0% sodium alginate, 2.0% CaCl2and 80 g·L-1degrading bacteria.The particle size was about 3.0 mm.The degrading bacteria microspheres had uniform particle size, moderate mechanical strength, good mass transfer performance, degradation activity and storage stability.Scanning electron microscopy showed that the degrading bacteria were evenly distributed in sodium alginate microspheres and their morphology was normal.In the soil with 10-30℃ and pH of 6.0-8.0, the degrading bacteria were released stably, and the degradation rate of indoxacarb was more than 85%.The release performance was not affected by soil type, the stability was good, and was less affected by environmental conditions.When 90-900 kg·hm-2of degrading bacteria microspheres were applied 2 d after field spraying of 150 g·L-1of EC active ingredient 20 mg·L-1, the residual half-life (T1/2) of indoxacarb in soil was shortened to 2.49-3.32 d (7.53 d for blank control area); furthermore when 450 kg·hm-2of degrading bacteria microspheres were applied 2 d after spraying indoxacarb with 5, 20 and 50 mg·L-1, the values of T1/2was shortened from 6.03-7.45 d to 2.34-3.59 d.【Conclusion】The preparation of degrading bacteriamicrospheres with sodium alginate as carrier has stable performance, can significantly degrade indoxacarb residues in farmland and shorten T1/2time, provides technical and product support for bioremediation of soil pesticide residue pollution, and has the potential for further optimization and application.
indoxacarb residue; bioremediation; sodium alginate;; degrading bacteria preparation
2021-05-15;
2021-06-16
国家自然科学基金(31871988)、广东省重点领域研发计划(2018B20205003)
汪育泰,E-mail:578554241@qq.com。许智帆,E-mail:seekfunmeso@163.com。汪育泰和许智帆为同等贡献作者。通信作者钟国华,E-mail:guohuazhong@scau.edu.cn
(责任编辑 岳梅)

