小麦抗赤霉病育种回顾与展望
马鸿翔,王永刚,高玉姣,何漪,姜朋,吴磊,张旭*
小麦抗赤霉病育种回顾与展望
马鸿翔1*,王永刚1,高玉姣1,何漪2,姜朋2,吴磊2,张旭2*
1扬州大学农学院/江苏省粮食作物现代产业技术协同创新中心/江苏省作物基因组学与分子育种重点实验室,江苏扬州 225009;2江苏省农业科学院/CIMMYT-JAAS小麦病害联合研究中心/现代作物生产省部共建协同创新中心,南京 210014
由禾谷镰刀菌复合种引起的赤霉病是全世界最重要的小麦病害之一,严重影响小麦的产量和品质,受病原菌侵染的籽粒还会产生脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)为主的毒素,进一步威胁人畜健康。抗赤霉病品种选育与应用是解决小麦赤霉病及毒素危害的有效途径,中国自20世纪50年代开始抗赤霉病育种研究,70年代成立全国协作组,建立的人工接种鉴定方法被广泛用于赤霉病抗性评价,筛选出的苏麦3号、望水白等抗源被国内外广泛用于抗赤霉病研究,育成的农艺性状优良且中抗赤霉病的扬麦158号和宁麦9号等品种是抗赤霉病育种的重要突破,不仅在生产上得到大面积应用,而且作为亲本分别育成了20多个小麦品种。除常规育种外,还利用染色体工程技术将外源种质赤霉病抗性导入小麦栽培品种中,基于细胞工程技术的体细胞无性系变异和加倍单倍体创制在小麦赤霉病遗传改良中拓宽了遗传变异背景,提高了育种效率。20世纪90年代赤霉病在北美洲的流行促使欧美重视小麦赤霉病研究。国际合作促进了小麦赤霉病育种的资源、技术和信息交流,赤霉病抗性类型、鉴定技术和评价指标研究、抗赤霉病种质发掘、QTL定位、关键基因克隆、标记辅助选择及抗病品种培育等方面均取得了明显进展,利用双亲连锁作图和全基因组关联分析定位了600多个赤霉病抗性相关QTL,涉及小麦所有21条染色体,定名了—7个赤霉病抗性基因/QTL。针对苏麦3号和望水白等中国抗源的主效QTL(),克隆了其关键基因并进行了功能验证,开发了基因的功能标记,并成功应用于标记辅助选择,培育出赤霉病抗性显著改良的小麦新品种。来自长穗偃麦草的候选基因也被克隆,并用于提高栽培小麦品种赤霉病抗性。在精细定位的基础上,开发了紧密连锁分子标记,利用标记辅助选择将不同位点抗性QTL聚合,进一步提高了小麦赤霉病抗性。展望未来,应研究建立精准的赤霉病抗性表型评价体系、加强抗赤霉病新种质和新基因发掘、克隆主效抗病QTL的关键基因并明确其分子机制,将标记辅助选择或基因组选择与常规育种相结合,不断提升小麦抗赤霉病育种效率和水平,培育赤霉病抗性显著提高、综合性状优良的小麦品种。
小麦;遗传;育种;赤霉病;毒素
0 引言
小麦是世界上总产量仅次于玉米的粮食作物,2019年种植面积为2.16亿hm2,全球43个国家,约40%的人口以小麦为主粮(http://www.fao.org/faostat)。中国是世界上最大的小麦生产国和消费国,2020年种植面积为2 338万hm2,总产1.34亿t,基本满足中国小麦消费需求。小麦生产经常受病虫害的影响,小麦赤霉病是影响小麦产量和品质最重要的世界性病害之一,造成的小麦产量损失在全球病害中居第二位[1]。培育和应用抗赤霉病品种是控制赤霉病危害的根本途径[2]。中国是最早开展抗小麦赤霉病育种的国家,自20世纪50年代以来,中国科技工作者从种质资源的筛选、抗性遗传及机制研究、抗病品种培育、染色体工程和细胞工程技术在抗赤霉病育种中的应用等方面都取得了重要进展[3-4]。20世纪80年代以前,国外各地小麦赤霉病仅零星发生,因此,赤霉病研究一直未受重视,1982年国际玉米小麦改良中心(CIMMYT)开始与中国合作,将抗小麦赤霉病列为育种目标之一[5]。20世纪90年代赤霉病在北美洲暴发,推动了欧美各国对小麦赤霉病研究的重视,2003年起,美国国会设立专项经费持续资助美国小麦和大麦赤霉病,倡议组织防控赤霉病及其毒素研究[6],欧美国家的赤霉病研究促进了该领域的国际交流与合作,近年来,小麦赤霉病及毒素积累抗性基因发掘、QTL定位、关键基因克隆及抗性分子机制等方面取得了重要进展,并在抗病育种中得到了应用。
1 小麦赤霉病及其危害
小麦赤霉病由禾谷镰刀菌复合种(complex)引起,主要发生于气候湿润的温带地区[7]。自1936年小麦赤霉病在安徽、江苏大面积发生以来[3],中国南方冬麦区和东北春麦区一直受赤霉病的严重影响[8-9]。20世纪50年代以来,小麦赤霉病在中国南方普遍发生,随着福建、广东、广西、湖南和江西等省小麦种植面积的不断减少,赤霉病集中发生于中国长江中下游地区,1960—1989年有7年严重流行和15年中度流行,1990年以来,长江中下游麦区小麦品种抗病性的提高及化学农药的使用,使该区域的严重危害频率有所降低,1990—2000年只有1年严重流行和4年中度流行[10]。21世纪以来,受气候变暖、雾霾雨水增多、水稻玉米与小麦轮作面积增大、秸秆全量还田深埋不到位及病原菌对多菌灵抗药性的提高等因素影响[11-16],赤霉病频繁流行,发病区域由长江中下游北扩西移,成为黄淮麦区的常发病害[6]。根据全国农业技术推广服务中心的统计,2012—2018年,每年平均超过400万hm2的小麦发生赤霉病,约占小麦产区总面积的23%,2012、2014、2015、2016和2018年为严重流行年份,对小麦生产安全构成了严重威胁[17-18]。其中,赤霉病发生最严重的是2012年,发病面积为995万hm2,产量直接损失达208万t[19]。除中国外,南美洲自20世纪70年代起,小麦赤霉病频发,1970—2010年,巴西有17次赤霉病流行,阿根廷、巴拉圭、乌拉圭分别有11、13和15次流行[20]。美国于20世纪90年代初赤霉病开始流行,1993—2014年,硬质小麦、软质小麦和硬粒小麦产量损失分别达7 300万、2 100万和200万t,经济损失达170亿美元[21]。在欧洲,赤霉病多为区域性流行,匈牙利于1970—1997年有9次大流行,在1998年导致经济损失达1亿欧元[22]。
小麦赤霉病除了导致小麦产量和品质下降外,致病菌还产生脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和玉米赤霉烯酮(zearalenone,ZEN)等镰刀菌毒素污染小麦籽粒,进一步威胁着人畜健康和安全[23]。DON毒素可引起人头晕、头痛、恶心、呕吐、腹痛、腹泻、发烧和嗜睡,还导致家畜拒食和腹泻[24]。ZEN则导致怀孕的雌畜不育和流产,对人具有潜在的致癌作用[25]。自2010年以来通过对小麦生产监测,发现在2010、2012、2015和2016年中国多个小麦主产省小麦籽粒DON毒素严重超标[26]。2012年长江中下游和黄淮麦区采集的84份样品中,DON检出率为95%[27],2017年山东市场采集的100份面包和饼干样品中,DON检出率为95%[28]。国外小麦和制品中也同样受DON毒素污染,西班牙市场抽检的谷物制品中,38%携带DON毒素[29],德国抽检的小麦制品中均可检测出DON[30],波兰抽检的小麦制品中,83%含有DON毒素[31]。
2 小麦赤霉病抗性鉴定技术及评价指标
可靠的抗性鉴定技术及评价指标是区分抗感品种的基础。20世纪60年代,Schroeder等[32]将赤霉病抗性分为2种类型:一类是抗初始侵入,称为TypeⅠ;另一类是抗单穗上的病症扩展,为TypeⅡ。80年代提出了小麦对DON为主的单端孢霉烯毒素的抗性(TypeⅢ)[33-34],90年代提出了籽粒对赤霉病的抗性(TypeⅣ)和耐病性(TypeⅤ)[35]。据此,小麦赤霉病抗性至少分为5种不同类型的抗性,但在品种抗性鉴定中,这5种抗性的鉴定技术和评价指标存在着交叉。除自然发病外,小麦赤霉病抗性鉴定通常采用单花滴注、孢子喷雾或者土表接种等人工接种方法,并通过保湿以保证小麦赤霉病的发生。单花滴注接种是鉴定抗扩展性的方法,即在麦穗中部小穗选取单花接种,发病后观察病症在该穗上的发展,评价指标以最终可分辨病症时的病小穗数(number of scabbed spikelets)、病小穗率(proportion of scabbed spikelets)表示[36],或者以病小穗率确定相应的反应级或严重度(disease rating或severity)为指标[37-38]、还可以按发病后不同时期发病率折算成病程曲线面积(area under disease progress curve,AUDPC)[39]。抗侵入则采用孢子喷雾、土表接种或自然发病方法,Schroeder等[32]在提出两类抗性时分别以单花滴注和孢子喷雾的方法接种,以病情指数(disease index)和病麦粒(fusarium damaged kernels,FDK)作为评价指标,以病情指数为指标时,2种接种方法数值相近,以病麦粒率作评价指标时,两者差别显著,因而认为以不同接种方法产生的病麦粒作为区分TypeⅠ和TypeⅡ的评价指标[34]。实质上,孢子喷雾的病麦粒率指标同样包括了抗扩展性,后来发展成以孢子喷雾或土表接种方法,以同期开花感染赤霉病的病穗率(一定区域中病穗占总调查穗数的比例,proportion of scabbed spikes)为评价指标[40],或者以孢子喷雾后短期内病症尚未从病小穗扩展时的病小穗率作为评价指标[41],图1是孢子喷雾和单花滴注7 d后的赤霉病发病症状,此时单花滴注仅在接种小穗发病,而孢子喷雾可见多个小穗发病。孢子喷雾易受病菌接种时间和孢子浓度、小麦开花时期及发病时的生态条件等影响。以抗感差异大的5个品种为材料,以10 000个/mL孢子喷洒接种穗时,所有接种穗上的小穗都被感染,无法区分抗感品种[42]。赤霉病孢子最易入侵时期是小麦花药伸出小花,过早或过迟都会降低其侵染性。为了比较2种接种方法的差异,用致病力不同的病菌采用单花滴注和孢子喷雾对12个不同抗性品种接种鉴定,发现2种接种方法在接种后第7天病小穗率存在显著差异,而第21天的病小穗率几乎无差异。致病力不同的菌株接种小麦病穗率也有差异,但在抗感品种间表现一致[43]。从育种角度考虑,小麦赤霉病田间病症是抗初侵入和抗扩展综合表现,赤霉病菌自花期侵入至小麦成熟至少1个月时间,由于没有对赤霉病免疫的品种,因此,在条件适宜时,赤霉病菌总能入侵部分小穗,如果品种不抗扩展,病症会从侵入小穗扩展至整穗,加之抗扩展性相对稳定,因而育种者在评价品种抗性时较多采用此方法[37]。
第三类抗性(TypeⅢ)是毒素的抗性,以病穗或籽粒中DON含量表示,一般来说,DON毒素的抗性与抗侵入和抗扩展相关,尤其与赤霉病严重度指标密切相关[43],受污染籽粒较少的谷物样本中往往DON含量较低。但是,有时DON积累的抗性与赤霉病严重度不一致,如果感染发生在开花期间,受感染的子房可能不会发育成籽粒,或发育成瘪粒,小且轻不完善的籽粒在收获和脱粒时被吹走,剩余的未感染籽粒DON含量较低[41]。收获后处理试验表明,2 000 t籽粒(DON含量6.1 mg·kg-1)通过重量筛选,去除不完善粒,产量损失40%时可将DON含量降至1.6 mg·kg-1[44]。相反,一些中抗品种受侵染后,籽粒能正常发育,在收获的籽粒中可能有更高的DON含量。在灌浆期,如果遭遇高温多湿天气,籽粒也可受赤霉病菌感染,尽管赤霉病症状不明显,但收获的籽粒中DON含量却很高,这些被污染的籽粒在收获过程中不会随颖壳或不完善籽粒一起吹出[41]。此外,籽粒DON含量还与小麦降解毒素相关酶的活性有关,例如,小麦中的UDP葡萄糖基转移酶可将UDP-葡萄糖添加到DON分子C3位的羟基上,将DON转化为DON-3-O-glucoside(D3G),从而降低DON含量[45]。第四类抗性(TypeⅣ)是小麦籽粒对赤霉病的抗性,评价指标以病麦粒(FDK)表示,其抗性评价往往与抗扩展性鉴定结果表现一致[35],因此,以FDK指标并不能代表小麦籽粒对赤霉病的抗性,以相同病小穗率(抗扩展性相同)品种比较接种和未接种籽粒之间的千粒重变化差异作为籽粒抗性指标可能更能代表籽粒的抗性[46]。第五类抗性(TypeⅤ)是耐病性,指的是品种受赤霉病危害后的产量损失,必须以未受赤霉病危害的小麦作为对照,评价费时费力,未被广泛应用[41]。
对小麦生产来说,最关注的是收获时产量损失和毒素积累,是赤霉病抗性的综合表现。为了明确不同品种的赤霉病抗性,中国制定了小麦抗赤霉病评价技术规范(NY/T 1443.4-2007),此后又发布了小麦区域试验品种抗赤霉病鉴定技术程序(NY/T 2954-2016)。这两项规程内容相似,以单花滴注接种评价严重度,以土表接种自然发病评价病情指数,再与抗感对照比较,确定小麦品种对赤霉病的抗性。规程以综合评价为基础,同时突出了抗扩展性,是目前评价小麦品种抗赤霉病的有效方法[47]。

图1 孢子喷雾(左)和单花滴注(右)接种后第7天发病症状
3 抗赤霉病QTL/基因定位
小麦赤霉病在抽穗期至开花期发生,抗性表型鉴定易受环境条件影响,分子标记可直接对基因型进行选择,不受环境影响,因此,自20世纪90年代末以来,通过连锁作图对小麦赤霉病抗性QTL定位,已经定位了600个抗赤霉病相关QTL,涉及小麦的21条染色体[48-49]。
3.1 中国起源小麦品种抗赤霉病QTL定位
起源于中国的多个小麦抗源均进行了赤霉病抗性的分子定位,苏麦3号和望水白及其衍生系抗赤霉病QTL研究最早、最多,利用不同作图群体和抗性评价指标,在不同染色体上定位了多个主效抗病QTL,较明确的是位于3BS、6BS、4B和5AS染色体的、、和,其中和与抗扩展性相关,而和与抗侵入相关[40, 50-54]。其他抗病地方品种或抗病品系(如黄方柱、海盐种、白三月黄、黄蚕豆、Ning894037、Huapei57-2等)的QTL分析表明,除、、和之外,在3BS染色体近着丝粒位置,以及1A、1B、2A、2D、3A、3D、4D、6D、7A、7D等染色体上均具有主效抗性QTL[55-60]。近年来,抗赤霉病较好的大面积栽培品种也被用于QTL定位,长江中下游的宁麦9号和扬麦158都具有较好的赤霉病抗性,曾在生产上大面积种植。宁麦9号携带,是目前栽培品种中的主要供体[61],其作为亲本已经育成了27个通过审定的小麦新品种(表1)。扬麦158没有、、和[62],以郑麦9023/扬麦158重组自交系群体进行赤霉病抗性QTL定位,发现扬麦158在3AL和2DS染色体上存在抗性QTL[63],以扬麦158分别与安农8455和Veery配置的重组自交系群体,在2D和2A染色体上定位到与抗侵入和扩展相关的QTL[64]。在宁麦9号/扬麦158遗传群体QTL定位中,扬麦158的5AL染色体上存在1个主效抗性QTL,等位变异来源于意大利品种阿夫[65]。扬麦16是5年前江苏小麦生产上应用面积较大的品种,以来自扬麦16/中麦895的DH群体进行抗赤霉病QTL定位,单花滴注接种鉴定,扬麦16的4DS和6AS染色体上存在与抗扩展性相关QTL[66],以田间自然发病或孢子喷雾鉴定,扬麦16的3BL、4DS、6AL和6BS均有抗性QTL,中麦895在4AS、4BS和5AL染色体上存在抗性QTL[67]。长江中游品种荆州66的2DS、3AL、4DS和5DL存在稳定的抗赤霉病QTL[68]。黄淮南片主栽品种郑麦9023的抗赤霉病QTL定位在4AS和7D染色体上[63]。
3.2 国外起源小麦品种抗赤霉病QTL定位
国外小麦品种中,韩国品种Chokwang的3BS、4BL和5DL染色体携带抗赤霉病QTL[69]。日本品种NyuBai的3BS和5AS染色体存在抗赤霉病QTL[70]。品种Frontana的3AL染色体定位了抗侵入主效QTL[71]。罗马尼亚品种Sincron的1D染色体含有抗扩展QTL[72],Fundulea 201R的1B、3A和5A染色体含有抗性QTL[73]。法国品种Renan/Recital遗传群体的QTL定位表明,2A、2BS和5AL染色体上存在抗性QTL,其中,2BS和5AL的QTL与株高和花期连锁[74]。瑞士品种Arina/Forno为组合的遗传群体QTL定位表明,Arina的4AL和6DL染色体含有抗性QTL,Forno的5BL染色体含有抗性QTL,5BL和6DL的QTL与株高或抽穗期相关[75]。在Arina/NK93604群体定位中,Arina的1BL和6BS上存在抗性QTL,NK93604的1AL和7AL染色体上也有抗性QTL[76]。Arina/Riband的遗传群体定位了10个与赤霉病抗性相关的QTL[77]。在德国品种Dream/Lynx的遗传群体定位中,3个抗性QTL来源于Dream的6AL、2AL和7BS染色体,另4个QTL来源于Lynx,并与1BL.1RS易位染色体相关[78]。Ritmo/Cansas遗传群体在1BS、1DS、3B、3DL、5BL、7BS和7AL的7个染色体区段定位了与田间抗性相关的QTL,其中,5BL和7AL的QTL与株高和抽穗期的QTL重叠[79]。以G16-92/Hussar遗传群体进行研究,Hussar的1A染色体和G16-92的2BL染色体存在抗性QTL,1A的QTL与株高相关[80]。在美国品种Ernie的2B、3B、4BL和5A染色体上定位到了稳定的抗扩展性QTL[81],在Truman品种中也定位了6个抗性QTL[82]。
3.3 小麦近缘种抗赤霉病QTL定位
栽培小麦近缘种也用于赤霉病抗性QTL定位,品系FA-15-3的3AS染色体接近附近定位了1个抗扩展QTL[83],在品系PI478742的7AL染色体上也定位了1个主效抗赤霉病QTL[84]。4A染色体存在抗扩展性QTL[85],以作为抗性亲本建立高代回交群体进行QTL定位,发现效应最大的QTL在5A染色体上,与Q基因重叠,等位位点有助于提高赤霉病抗性[86]。衍生系TC67的5A和6A上存在抗性QTL[87]。小麦外源种质抗赤霉病基因也通过异染色体系的培育结合分子细胞遗传学进行定位,小麦-大赖草()易位系7AL·7Lr#1S具有较好的赤霉病抗性,抗病位点位于7Lr#1S染色体末端,命名为[88]。同样,小麦-日本披碱草()易位系T1AL‧1AS-1Ets#1S也具有较好的赤霉病抗性,抗赤霉病基因来源于1ES位点,命名为[89]。长穗偃麦草()的7el2染色体上存在抗赤霉病主效QTL,命名为[90]。
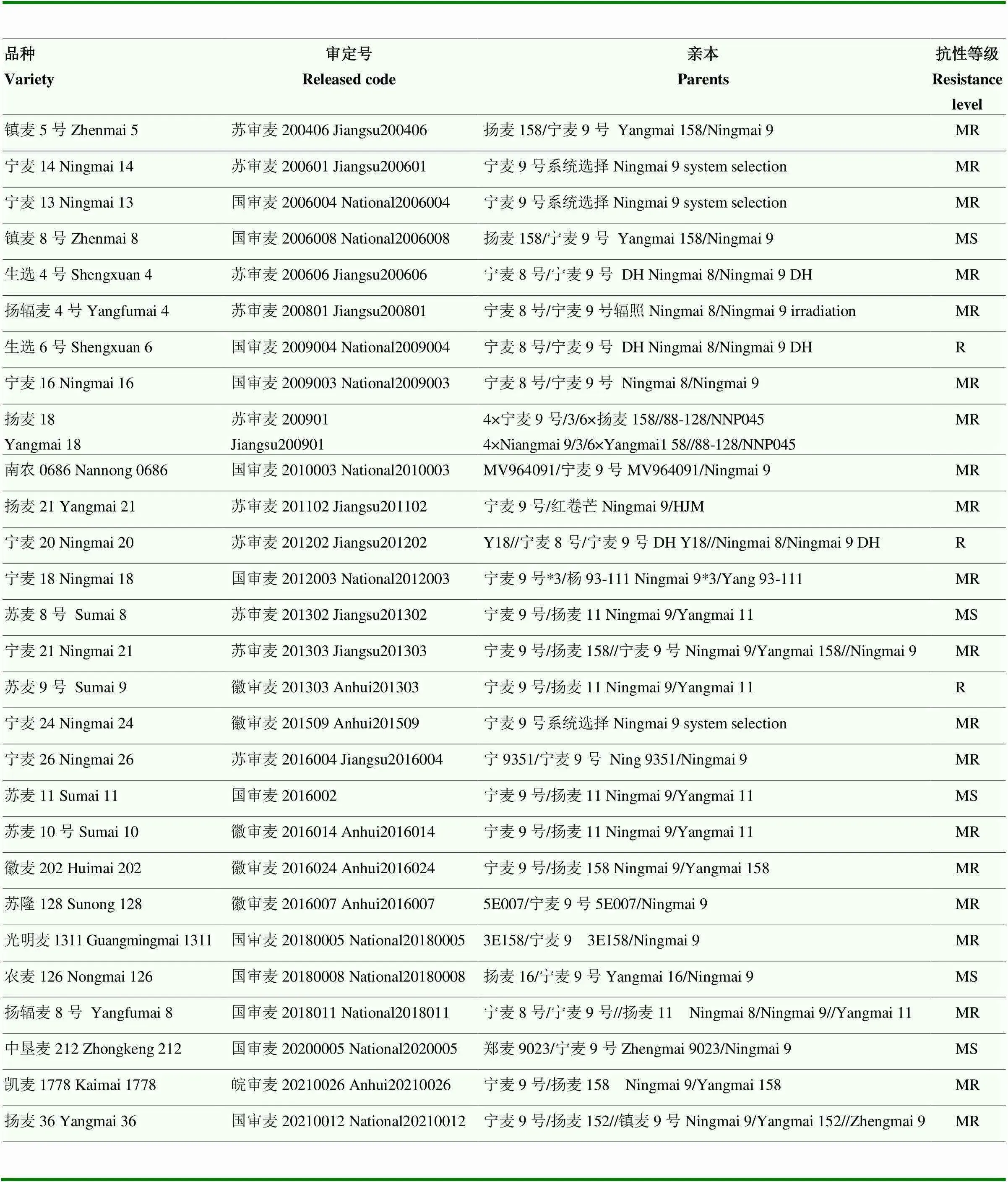
表1 宁麦9号为亲本育成的小麦品种及其赤霉病抗性
R:抗;MR:中抗;MS:中感。下同 R: resistance; MR: Moderate resistance; MS: Moderate susceptible.The same as below
3.4 抗赤霉病QTL的关联分析
关联分析是基于连锁不平衡的QTL定位方法,以地方品种、育成品种或育种品系组成的自然群体为材料,可以同时分析同一基因座的多个等位基因及其效应,且比双亲连锁作图群体具有更高的精度,近年来,在小麦抗赤霉病QTL定位中得到了应用。利用美国春小麦亲本衍生的800个系进行关联分析,在2A、2B、3B和7A染色体上定位了抗赤霉病QTL[91]。以美国中西部和东部冬小麦品种为亲本的衍生系关联分析,定位了15个赤霉病抗性相关QTL,包括、、和[92]。利用中国和日本起源的育成品种和地方品种,采用364个SSR标记进行全基因组关联分析(genome wide association study,GWAS)分析,定位了11个相关QTL,但其中10个已有报道[93]。以240个中国小麦品种(系)进行GWAS分析,在1AS、2DL、5AS、5AL、7DS染色体上定位了抗赤霉病QTL[94]。以171个小麦品种组成的遗传群体进行GWAS分析,在4AL和5DL定位了2个新的抗赤霉病QTL[95]。以213个中国核心小麦种质进行GWAS分析,在2BL和3A染色体上定位了与赤霉病和DON毒素积累抗性相关的QTL[96]。
3.5 Fhb1和Fhb7的克隆
是最早发现且在栽培小麦品种中赤霉病抗性效应最大的QTL,国内外一直致力于克隆该基因。Liu等[97]利用精细定位获得的分子标记筛选BAC文库,序列分析获得了7个候选基因,但将这7个基因过表达转入感病品种,并未提高赤霉病抗性。在此基础上,Rawat等[98]通过在这7个基因的外围序列分析,自苏麦3号中克隆了一个类成孔毒素基因(pore-forming toxin-like gene,),通过TILLING突变体、RNAi沉默、转基因过表达、单倍型分析验证,证实其具有抗赤霉病功能。但后续对基因的特征研究表明该基因可能并非真正的[99]。Su等[100]以苏麦3号衍生系宁7840为材料,通过精细定位和表达分析,在位点克隆了一个富含组氨酸的钙结合蛋白基因(histidine-rich calcium-binding-protein gene,),抗感材料中结构存在较大差异,抗病材料在第二个内含子和第三个外显子交界处存在大片段缺失,导致mRNA剪切位点、起始密码子以及ORF中的一段22 bp序列缺失,因而认为编码赤霉病感病蛋白,抗病材料因序列缺失导致感病性下降,系统发育和单倍型分析表明等位基因可能起源于携带大红袍单倍型的品系。同时,Li等[101]自望水白中克隆了该基因(),小麦和拟南芥转化过表达均导致植株赤霉病抗性提高,认为的部分序列缺失导致基因发生功能获得性突变,造成了对赤霉病的抗性。Lagudah等[102]认为两者的功能差异可能由于基因显性负效应或基因簇作用引起,其作用机制仍有待揭示。
是来自长穗偃麦草的抗赤霉病基因,此QTL被精细定位于7E染色体和之间,遗传距离为1.7 cM[103]。Wang等104]通过筛选BAC文库和物理图谱构建,将该基因锁定在245 kb的物理区间内,并获得唯一表达的候选基因,为谷胱甘肽转移酶(gluthanione S-transferase,GST),通过BMSV诱导基因沉默、TILLING突变体、转基因研究等验证了的功能,通过打开DON毒素的环氧基团,催化形成谷胱甘肽加合物,通过解毒效应提高赤霉病抗性。该基因可能来自于禾本科植物与内生真菌形成共生体,通过基因水平转移整合到长穗偃麦草基因组。
4 抗赤霉病育种技术及育种成就
戴松恩等[3]认为,在严格接种条件下,中国品种中具有抗赤霉病材料,提出选育抗赤霉病品种的可能性。20世纪50年代,中国南方即以抗小麦赤霉病为重要目标开展了小麦品种选育工作。
4.1 系统选择
最早采用的育种技术是从田间自然变异或品种剩余变异中进行系统选择。20世纪50年代,小麦育种者从赤霉病频繁发生田间的南大2419中选出中抗赤霉病品种万年2号(万年农业局,1958)和望麦15(江苏太湖地区农业科学研究所,1959),江苏里下河地区农业科学研究所1967年从阿夫(Funo)中选出了扬麦1号,随后又从扬麦1号中选出了扬麦3号,武进农业科学研究所于1968年从阿夫中选出武麦1号[44-45]。直至21世纪,系统选择仍然有所应用,江苏省农业科学院从宁麦9号中通过系统选育的方法育成了2个生产上大面积种植的品种——宁麦13和宁麦14[105-106],扬州长富种业从镇麦4号中选育了中抗赤霉病的扬富麦101[107]。
4.2 杂交育种
杂交育种是小麦遗传改良的主要手段。赤霉病抗源中研究最多的苏麦3号是从Funo(感病)和台湾小麦(中感)杂交培育出的小麦赤霉病抗性优于双亲的超亲品种,将杂交组合后代每个世代均种植在发病较重的田块,每一代都选择赤霉病严重度最低的材料,至1974年育成[108]。苏麦3号育成后作为抗赤霉病的重要亲本加以利用,赤霉病抗性较好的宁7840、扬89-110和扬92-617都是苏麦3号的后代[109],对中国南方803个小麦品种和育种材料的赤霉病抗性鉴定,发现27个品种抗赤霉病,其中,20个是苏麦3号或其衍生系的后代[110],但这些抗病品种伴有苏麦3号的植株偏高、穗密度稀、产量低等不良农艺性状,难以在生产中得到应用。针对后代选择中难以打破抗赤霉病和不良农艺性状连锁的问题,程顺和等[111]建议从农艺性状优良和中度感赤霉病的品种之间杂交,在后代中选择赤霉病抗性提高的后代,而不是直接使用苏麦3号作为亲本来改善现有品种的赤霉病抗性,基于这一策略育成了中抗赤霉病农艺性状优良的扬麦158,亲本系谱中的南大2419、胜利麦、Funo和St1473/506等品种都是感或中感赤霉病品种,而扬麦158的赤霉病抗性稳定超过任何一个亲本。江苏省农业科学院育成的农艺性状优良且中抗赤霉病的品种宁麦9号也是基于同样思路,其系谱中的南大2419、江东门、西风、早熟5号和诺夫林129等都中感或感赤霉病[112]。扬麦158和宁麦9号都在长江中下游麦区的小麦生产中得到了广泛应用,且作为亲本分别育成了20多个小麦品种[47]。以扬麦158为亲本,与PH82-2-2杂交,育成了赤霉病抗性达“抗”级的华麦5号。最近通过审定赤霉病抗性达“抗”级的扬麦33,系谱中苏麦6号、97G59和扬麦19的赤霉病抗性仅为中抗或中感水平。研究表明,小麦品种中可能同时存在多个抗赤霉病基因或者感病QTL/基因,杂交后基因交换重组,后代材料通过基因加性效应和上位效应可能出现超亲的后代,在育种实践中,采用中感或中抗品种间杂交,超亲分离的比例将有所提高[108]。
4.3 轮回选择
2个品种之间杂交,很难同时改良包括农艺性状和抗病性在内的多个性状,利用太谷核不育显性不育基因(或)为基础,开展多亲本聚合杂交、表型混合选择、后代测定与选择相结合的轮回选择计划构建小麦抗赤霉病基因库,可同时不断将新种质导入,继续改进基因库遗传组成,从基因库中选择优良的可育系,通过自交培育新品种[113]。为了有利于轮回选择体系的应用,通过杂交将矮秆基因与不育基因结合,创造了与在4DS染色体上紧密连锁的矮败(dwarfing- sterile,DS)小麦,根据株高即可在轮回选择群体中区分不育株和可育株[114]。利用轮回选择技术,从改良群体中选育出了中抗赤霉病的鄂麦11,育成了中抗赤霉病的皖麦26和赤霉病抗性优于扬麦158的皖麦606。2017年通过审定的淮核12013,是从轮回选择群体中选育并通过审定的为数不多的淮北麦区中抗小麦赤霉病品种。
4.4 外源种质利用
尽管在全国小麦赤霉病协作组的种质评价中未鉴定出抗赤霉病突出的小麦外源种质,但此后科研人员通过不懈的努力发现了不少抗赤霉病的外源种质[115],通过对18个属93个物种的1 507个系的赤霉病抗性鉴定,发现31个系抗侵入,151个系抗扩展性,这些主要来源于生长于温暖潮湿气候的热带亚热带地区的鹅观草属()、披碱草属()、仲彬草属()、冰草属()等[116]。小麦外源种质不可避免地携带不良的农艺性状,将外源种质的单个染色体或染色体片段引入栽培小麦,可克服不良农艺性状的影响,南京农业大学通过染色体工程创制小片段染色体易位系,将大赖草(syn.)、鹅观草(syn.)、纤毛鹅观草()等外源种质导入栽培小麦品种,不仅保持了栽培小麦的优良农艺性状,还提高了赤霉病的抗性[117-119],山东农业大学等单位将长穗偃麦草(、)的抗赤霉病片段通过染色体工程技术导入栽培品种,提高了小麦赤霉病的抗性[104]。
4.5 植物细胞工程技术
植物体外培养过程中的组织脱分化和再分化过程中可产生能稳定遗传的变异,细胞学和分子标记揭示了体细胞无性系变异体与供体之间存在遗传差异。为了筛选出抗赤霉病变异的突变株,在培养基中加入DON或赤霉病毒素粗提物进行筛选,有助于获得抗赤霉病的突变体[120]。以宁麦3号为供体,通过幼胚培养,对再生植株进行人工接种赤霉病抗性鉴定,选出中抗赤霉病的生抗1号小麦品种,分别于1996年和1999年通过江苏和上海品种审定[121]。以同样的方法,自扬麦158的体细胞无性系变异中选出生选3号,不仅具有扬麦158较好的农艺性状,而且赤霉病抗性显著优于扬麦158,于2001年通过江苏省品种审定[122]。
加倍单倍体技术可加快杂交后代基因型纯合,因而在抗赤霉病育种中同样得到了应用。花药培养是经典的加倍单倍体育种技术,通过对培养基和培养条件的优化,建立较成熟的花药培养诱导加倍单倍体的技术体系,并利用此技术育成了生抗2号和生选6号等赤霉病抗性改良的小麦新品种,分别于1999年和2008年通过品种审定,其中,以宁麦8号/宁麦9号为组合育成的生选6号,在2005—2009年连续5年国家区试鉴定的421个参试品种中,是唯一一个连续2年赤霉病抗性鉴定结果均为“抗”的品种[123]。玉米/小麦杂交后,玉米染色体消失法是近年来利用较多的诱导加倍单倍体技术,在对技术优化的基础上育成了宁麦20,赤霉病抗性同样达到“抗”级,2012年通过江苏省品种审定[124]。
4.6 标记辅助选择
QTL定位的目的是利用标记辅助选择开展分子育种。育种中应用最广泛的是,该基因与小麦赤霉病抗扩展性连锁的QTL,可解释30.2%—42.5%的表型变异,利用缺失系将其定位在3BS-8的bin区段,位于染色体相对区段的0.78—0.87[125]。进一步基于精细定位标记筛选BAC序列,通过构建区域的物理图谱,开发出诊断标记,使该QTL更好地在标记辅助选择中得到应用[97]。Pumphrey等[126]以苏麦3号为抗源育成了的近等基因系,赤霉病严重度平均降低了23%,病粒率平均降低了27%。Bernardo等[127]将从宁7840转移到美国硬冬小麦,所获得的4个含的近等基因系的赤霉病抗性均显著提高,毒素含量显著降低。先锋公司利用分子标记辅助选择转移育成了25R18、25R51和25R42等软质小麦品种。目前,美国新育成的春小麦品种50%携带,法国冬小麦品种Jaceo和阿根廷硬红冬小麦品种MS INTA 416都以标记辅助育种育成[49]。中国许多单位都通过标记辅助选择技术将用于改良当地品种[4]。
利用分子标记聚合多个QTL也得到了应用,Miedaner等[128]将和同时导入性状优良的德国春小麦中,与原有品种相比,QTL聚合可以使籽粒DON毒素含量降低78%,赤霉病病情等级降低55%。陆成彬等[129]通过回交转育将和导入扬麦13,获得农艺性状与扬麦13一致的抗赤霉病小麦品系。Salameh等[130]将和通过分子标记辅助选择导入9个欧洲冬小麦品种,结果表明,的赤霉病抗性效应比大,和聚合在一起的赤霉病抗性比单独更强,但也存在多个赤霉病抗性QTL聚合后抗性效果没有提高的情况。南京农业大学利用标记辅助育种已经将望水白中的、、和分别或共同转移入40个不同地区种植的小麦品种中,70多个后代材料携带不同组合的抗性QTL,同时携带4个QTL的材料赤霉病抗性与望水白和苏麦3号类似[131]。
4.7 中国抗小麦赤霉病育种成就
中国20世纪50年代开展抗赤霉病育种工作,1974年成立了全国小麦赤霉病研究协作组,此后10年间鉴定小麦种质34 571份,除在地方品种中发现了望水白、翻山小麦、菜子黄、海盐种等优异抗源外,还鉴定出一批人工培育的抗赤霉病品种,如系统选育品种万年2号、杂交育成品种苏麦3号和宁7840等[115],但这些抗病品种在生产上应用面积不大。扬麦158是首个在生产上大面积推广农艺性状优良且中抗赤霉病的品种,此后,全国以长江中下游麦区为主育成了多个赤霉病在中抗以上的小麦品种通过国家或省审定。表2统计了2001年至2015年全国审定小麦品种中的赤霉病抗性较好品种,在国审品种中,中抗或抗赤霉病品种多数出自江苏育种单位。
2012年,全国小麦赤霉病大发生后,长江中下游麦区更加重视小麦抗赤霉病育种,江苏省提出在品种审定中淮南麦区小麦赤霉病抗性达到中抗以上,淮北麦区赤霉病抗性不能低于感病对照,黄淮麦区及北方麦区育种单位也以抗小麦赤霉病为重点开展育种工作。经各育种单位努力,目前,长江中下游麦区育成品种以中抗赤霉病品种为主,黄淮及其他麦区赤霉病抗性达到中感的小麦品种也逐渐增多,改变了黄淮麦区和其他麦区小麦品种几乎完全感赤霉病的状况(表3)。根据审定公告,在育成并通过国审或省审的品种中,至少有5个品种赤霉病抗性达到“抗”的水平,分别是生选6号(2009年国审)、华麦5号(2010年江苏省审定)、宁麦20(2012年江苏省审定)、苏麦11(2016年安徽省审定)和扬麦33(2021年国审)。
5 结语与展望
随着气候和种植制度的变化,中国小麦赤霉病已经由传统发病区的长江中下游麦区北移西扩,黄淮麦区已经成为小麦赤霉病常发区,是全球小麦赤霉病发生最严重的地区。近年来,抗赤霉病育种逐步得到重视,2016年和2018年在河南郑州召开了2次以小麦赤霉病防控为主题的黄河论坛,大家认为抗赤霉病将是未来20年小麦育种最重要的目标之一[4],至2030年,长江中下游审定的品种中20%品种在保持农艺性状优良的同时赤霉病抗性接近或达到苏麦3号水平,黄淮麦区20%品种赤霉病抗性与扬麦158相当。可喜的是,近年来,长江中下游和黄淮麦区通过审定的品种中赤霉病抗性在不断提升[114],为了进一步提高品种抗性,仍应在多方面加强抗赤霉病育种研究。
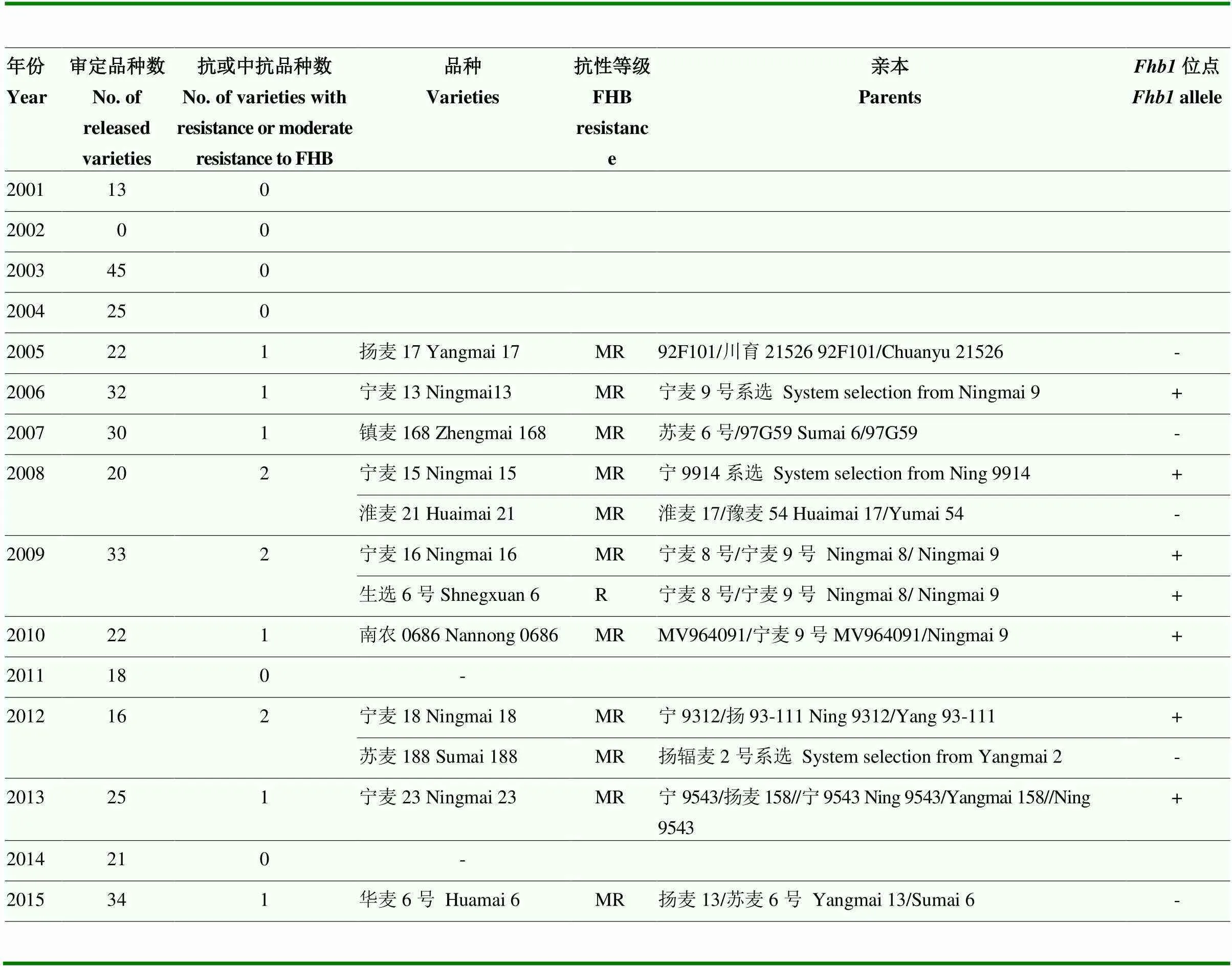
表2 国家审定中抗(抗)赤霉病小麦品种
+:抗病等位位点;-:感病等位位点 +:resistance allele; -:susceptible allele
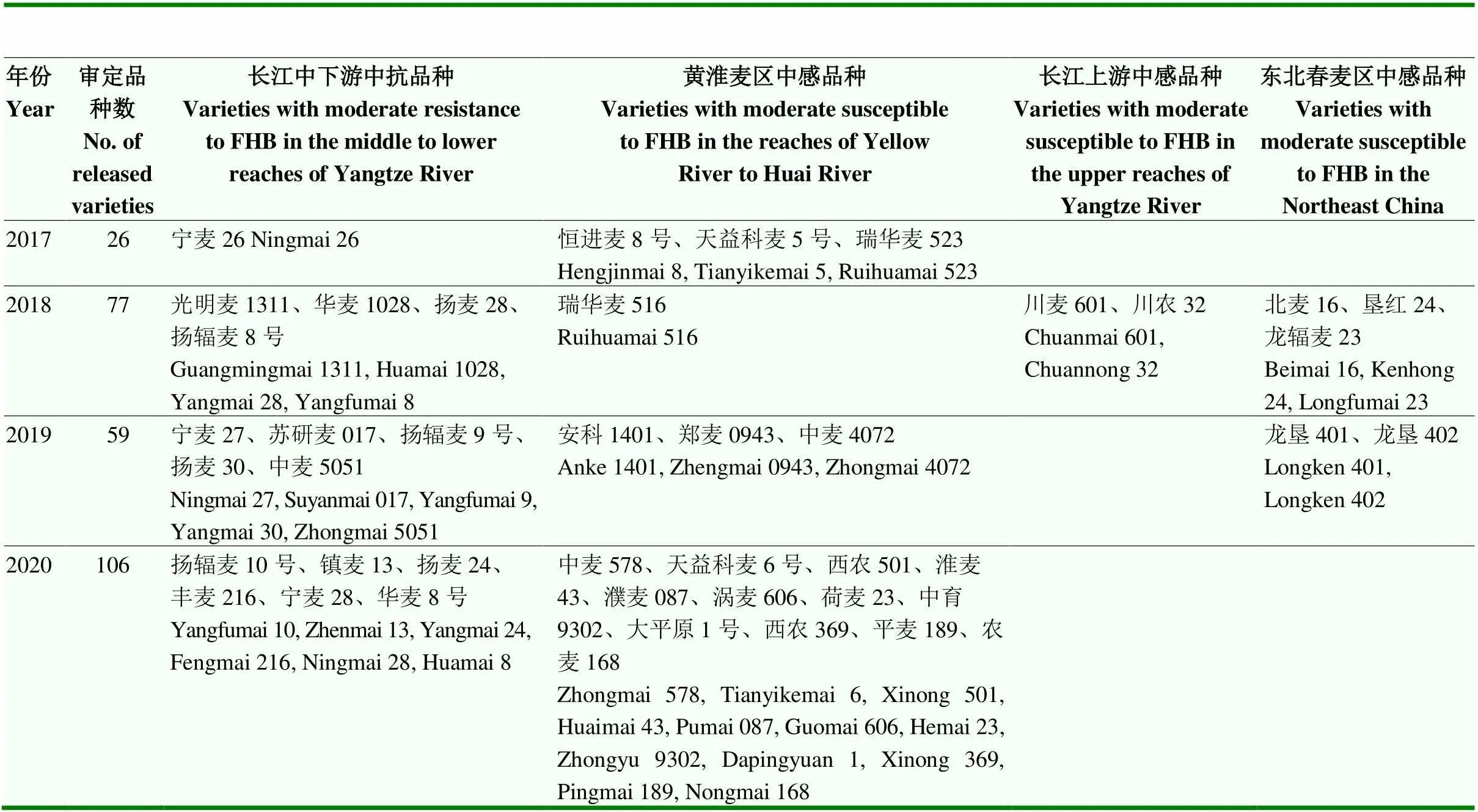
表3 2017—2020年通过国家审定赤霉病抗性较好的小麦品种
抗赤霉病表型鉴定是评价小麦品种赤霉病抗性的基本手段,关键是提高抗性鉴定稳定性。目前,中国制订的小麦抗赤霉病评价技术规范(NY/T 1443.4-2007)和小麦区域试验品种抗赤霉病鉴定技术程序(NY/T 2954-2016)有效地规范了小麦赤霉病抗性鉴定技术和评价指标。由于赤霉病接种与发病受多因素影响,不同菌株接种影响着赤霉病严重度和病情指数,应在接种前对接种菌的致病性进行鉴定,尽量选择当地致病性强的菌株,接种后保持适宜的温湿度,以确保正常发病[41]。在鉴定中还应确定统一的对照品种对评价结果加以校正,目前,江苏小麦品种试验中采用苏麦3号、扬麦158、淮麦20号和矮抗58分别作为抗、中抗、中感和感的对照品种,能较好地区分品种的抗感性。国家小麦良种联合攻关协作组在南阳、合肥和扬州建立了3个小麦赤霉病综合鉴定圃,江苏省农业科学院与国际玉米小麦改良中心合作建立了CIMMYT总部外的唯一评价国际小麦资源的赤霉病抗性的鉴定圃,对这些平台充分利用,多点多年鉴定,有助于品种筛选和抗病稳定性评价。表型鉴定在抗赤霉病育种中花费大量时间和人力物力,如何利用田间表型组学快速鉴定技术提高赤霉病抗性表型鉴定效率将是今后的重要研究方向[132]。此外,随着人们对食品安全的关注,对赤霉病发生后DON等镰刀菌毒素的积累越来越受到重视,抗DON毒素积累的鉴定应早日列入赤霉病抗性评价技术规程中。
种质资源是抗病育种的基础,小麦赤霉病是典型的多基因控制性状,不同抗性资源中的抗性位点聚合可提高小麦赤霉病抗性[126]。马鸿翔等[120]曾以7个小麦赤霉病抗源为亲本复合杂交,通过加倍单倍体技术获得赤霉病抗性强而稳定的7P1和7P2等抗病材料。在小麦抗赤霉病种质发掘利用上,一方面应继续收集、保存、评价和筛选新的抗源。近年来,江苏省农业科学院对收集的国内外小麦种质进行赤霉病抗性评价,以、、和位点多个相关标记筛选,发现40%赤霉病中抗或抗的材料没有这些明确的抗性基因,可能携带其他新的抗性位点,说明新的抗性种质中可能存在不同的抗性位点,可对这些材料继续定位新的抗病QTL,拓宽现有赤霉病抗源的遗传背景。另一方面,应加强已有抗赤霉病材料的应用。中国自20世纪70年代以来筛选出了数百份赤霉病抗性较好的抗源,包括地方品种、育种品系以及小麦近缘物种[115],国外也鉴定出多份抗病材料,50多个品种通过连锁作图进行了QTL定位[49],但多数材料尚未作为亲本在抗赤霉病育种中得到有效利用。
长期以来,人们一直致力于小麦赤霉病抗性相关基因克隆和功能及其作用机制解析,探明赤霉病抗性的遗传与分子机制可为小麦抗病育种提供重要理论依据。小麦抗赤霉病遗传研究中定位了多个抗病QTL,但由于小麦基因组的复杂性和赤霉病抗性的复杂性,目前,除和外,多数抗病QTL的基因未被克隆,随着小麦基因组测序数据的增加和泛基因组研究的推进[133],小麦抗病基因克隆将会取得较快进展。根据关键基因序列的SNP差异,通过基因组编辑技术改良小麦赤霉病抗性将会成为现实。对于已经克隆的和2个关键基因,尽管其抗病功能得到了验证,但目前育种中广泛利用的的抗病作用分子机制仍需进一步研究,而对于水平转移机制的探讨,将会促进对病原菌和寄主之间互作机制的了解,进一步推动其在作物育种及其他领域中的广泛应用[134]。
分子标记辅助选择为小麦抗赤霉病育种提供了有效的工具,过去20多年里,人们利用连锁作图和关联分析进行了大量的抗赤霉病QTL定位研究,已发现600多个相关QTL,通过元分析得到77个高置信度的QTL[135],定名了、、、、和等抗病基因,并利用标记辅助选择向栽培品种转移抗性QTL,但成功育成的品种仍有限。究其原因,一方面多数QTL效应较小,单一QTL的转入未必获得理想效果;二是用于抗病QTL定位的地方品种或高抗材料往往农艺性状或生态适应性不符合育种要求,难以直接用作亲本;三是除和外,缺乏功能型标记,连锁标记位点在感病品种与抗病品种间存在等位,或不同抗病品种间存在差异;四是分子标记辅助选择与常规育种的结合仍需完善。因此,应对已有稳定的QTL位点进行精细定位,开发诊断型分子标记,将抗性QTL从农艺性状较差的抗源中导入农艺性状优良适于本地生态条件的大面积栽培品种中,获得农艺性状较好抗性改良的材料进一步用于小麦育种,研究标记辅助选择或基因组选择与常规育种中结合的效率,确定标记选择世代和群体大小,完善高通量标记筛选技术,有针对性地通过抗性QTL/基因聚合培育赤霉病抗性改良且农艺性状优良适应性广的新品种,并在生产上大面积推广应用。
[1] FIGUEROA M, HAMMOND-KOSACK K E, SOLOMON P S.A review of wheat disease-a field perspective.Molecular Plant Pathology, 2018, 19(6): 1523-1536.
[2] DWEBA C C, FIGLAN S, SHIMELIS H A, MOTAUNG T E, SYDENHAM S, MWADZINGENI L, TSILO T J.Fusarium head blight of wheat: pathogenesis and control strategies.Crop Protection, 2017, 91: 114-122.
[3] 戴松恩,姜秉权, 王焕如.小麦品种抗赤霉病之育种问题.农报, 1941, 6: 616-625.
DAI S E, JIANG B Q, WANG H R.Problems related to breeding for scab resistance of wheat varieties.Agricultural Reports, 1941, 6: 616-625.(in Chinese)
[4] 张爱民, 阳文龙, 李欣, 孙家柱.小麦抗赤霉病研究现状与展望.遗传, 2018, 40(10): 858-873.
ZHANG A M, YANG W L, LI X, SUN J Z.Current status and perspective on research against Fusarium head blight in wheat.Hereditas, 2018, 40(10): 858-873.(in Chinese)
[5] LIU D J.Breeding wheat for scab resistance-a worldwide hard nut to crack//LI Z S.Proceedings of International Conference on Wheat Genetics and Breeding-Perspectives of the 21st Century for Wheat Genetics and Breeding.Beijing: Agriculture Publisher, 2021: 4-7.
[6] 马忠华, 陈云, 尹燕妮.小麦赤霉病流行成灾原因分析及对策防控探讨.中国科学基金, 2020, 34(4): 464-469.
MA Z H, CHEN Y, YIN Y N.Epidemiological analysis and management strategies of Fusarium head blight of wheat.Science Foundation in China, 2020, 34(4): 464-469.(in Chinese)
[7] BECHTEL D, KALEIKAU L, GAINES R, SEITZ L.The effects ofinfection on wheat kernels.Cereal Chemistry, 1985, 62: 191-197.
[8] 徐闰成,陈洁明.小麦赤霉病流行预测初步研究.植物保护学报, 1964, 3(4):405-412.
XU R C, CHEN J M.A preliminary study on the forecasting of epiphytotics of head blight of wheat.Acta Phytophylactics Sinica, 1964, 3(4): 405-412.(in Chinese)
[9] 李汉卿,傅纯彦.黑龙江省小麦赤霉病的初步研究.植物保护学报, 1964, 3(3): 225-232.
Li H Q, Fu C Y.A preliminary study of wheat scab in heilongjiang province.Acta Phytophylactics Sinica, 1964, 3(3): 225-232.(in Chinese)
[10] 程顺和, 张勇, 张伯桥, 高德荣, 吴宏亚, 陆成彬, 吕国锋, 范金萍.控制小麦赤霉病流行的主要因素分析.江苏农业学报, 2008, 19(1): 55-58.
CHENG S H, ZHANG Y, ZHANG B Q, GAO D R, WU H Y, LU C B, Lü G F, FAN J P.Analysis of main factors for control wheat scab epidemic.Jiangsu Journal of Agricultural Sciences, 2008, 19(1): 55-58.(in Chinese)
[11] 赵圣菊, 姚彩文.厄尼诺与小麦赤霉病大流行关系的研究.气象科学研究院院刊, 1989, 4(2): 214-218.
ZHAO S J, YAO C W.A study on the relationship between the El Nino and the great prevailence of the wheat scab.Journal of Academy of Meteorological Science, 1989, 4(2): 214-218.(in Chinese)
[12] 居为民, 高苹, 武金岗.太湖地区小麦赤霉病与ENSO事件之关系及其预报.科技通报, 2001, 17(3): 22-26.
JU W M, GAO P, WU J G.Relationship of ENSO to wheat gibberellin in the area of Taihu lake and its prediction.Bulletin of Science and Technology, 2001, 17(3): 22-26.(in Chinese)
[13] DILL-MACKY R, JONES R K.Effects of previous crop and tillage on Fusarium head blight of wheat.Phytopathology, 1999, 89: S21.
[14] 乔玉强, 曹承富, 赵竹, 杜世州, 张耀兰, 刘永华, 张四华.秸秆还田与施氮量对小麦产量和品质及赤霉病发生的影响.麦类作物学报, 2013, 33(4): 758-764.
QIAO Y Q, CAO C F, ZHAO Z, DU S Z, ZHANG Y L, LIU Y H, ZHANG S H.Effect of straw-returning and N-fertilizer application on yield, quality and occurrence of Fusarium head blight of wheat.Journal of Triticeae Crops, 2013, 33(4): 758-764.(in Chinese)
[15] 周明国, 叶钟音, 刘经芬.杀菌剂抗性研究进展.南京农业大学学报, 1994, 17(3): 33-41.
ZHOU M G, YE Z Y, LIU J F.Progress of fungicide resistance research.Journal of Nanjing Agricultural University, 1994, 17(3): 33-41.(in Chinese)
[16] 叶钟音, 周明国.江淮地区小麦赤霉病菌对多菌灵耐药性的测定.植物保护学报, 1985, 12: 188-189.
YE Z Y, ZHOU M G.Determination of tolerance to methyl-2- benzimidazole carbamate in wheat scab in Jiang Huai area.Journal of Plant Protection, 1985, 12: 188-189.(in Chinese)
[17] 黄冲, 姜玉英, 吴佳文, 邱坤, 杨俊杰.2018年我国小麦赤霉病重发特点及原因分析.植物保护, 2019, 45(2): 160-163.
HUANG C, JIANG Y Y, WU J W, QIU K, YANG J J.Occurrence characteristics and reason analysis of wheat head blight in 2018 in China.Plant Protection, 2019, 45(2): 160-163.(in Chinese)
[18] CHEN Y, KIRSTIE H C, MA Z.trichothecene mycotoxins, regulation and management.Annual Review of Phytopathology, 2019, 57: 15-39.
[19] 陈云, 王建强, 杨荣明, 马忠华.小麦赤霉病发生危害形势及防控对策.植物保护, 2017, 43(5): 11-17.
CHEN Y, WANG J Q, YANG R M, MA Z H.Current situation and management strategies of Fusarium head blight in China.Plant Protection, 2017, 43(5): 11-17.(in Chinese)
[20] KOHLI M M, DE ACKERMANN M D.Resistance to Fusarium head blight in South American wheat germplasm//Alconada M T M, Chulze S N.Fusarium head blight in Latin America.Dordrecht: Springer Press, 2013: 263-297.
[21] WILSON W W, MCKEE G, NGANJE W, DAHL B, BANGSUND D.Economic impact of USWBSI’s Scab Initiative to reduce FHB.Agribusiness and Applied Economics Report, 2017, 26: 774.
[22] APONYI I, NAGY G, PRINCZINGER G, KAJATI I.Fusarium infection of wheat seeds in Hungary between 1970 and 1997.Cereal Research Communications, 1998, 26: 253-258.
[23] SCUDAMORE K.Fate of Fusarium mycotoxins in the cereal industry: recent UK studies.World Mycotoxin Journal, 2008, 1(3): 315-323.
[24] WEGULO S N.Factors influencing deoxynivalenol accumulation in small grain cereals.Toxins, 2012, 4: 1157-1180.
[25] EDWARDS S.Zearalenone risk in European wheat.World Mycotoxin Journal, 2011, 4(4): 433-438.
[26] QIU J, XU J, SHI J.Fusarium toxins in Chinese wheat since the 1980s.Toxins, 2019, 11(5): e248.
[27] SELVARAJ J, ZHAO Y, SANGARE L, XING, FG, ZHOU, L, WANG, Y, XUE, XF, LI, Y, LIU, Y.Limited survey of deoxynivalenol in wheat from different crop rotation fields in Yangtze-Huaihe river basin region of China.Food Control, 2015, 53: 151-155.
[28] JIANG D F, CHEN J D, LI F H, LI W, YU L L, ZHENG F J, WANG X L.Deoxynivalenol and its acetyl derivatives in bread and biscuits in Shandong province of China.Food Additives & Contaminants Part B-Surveillance, 2018, 11(1): 43-48.
[29] MONTES R, SEGARRA R, CASTILLO M A.Trichothecenes in breakfast cereals from the Spanish retail market.Journal of Food Composition and Analysis, 2012, 27: 38-44.
[30] GOTTSCHALK C, BARTHEL J, ENGELHARDT G, BAUER J, MEYER K.Simultaneous determination of type A, B and D trichothecenes and their occurrence in cereals and cereal products.Food Additives and Contaminants, 2009, 26(9): 1273-1289.
[31] MARCIN B, RENATA J, KRYSTYNA S, MAREK R, MIECZYSŁAW W O.An LC-IT-MS/MS-based method to determine trichothecenes in grain.Products Food Analytical Methods, 2014, 7: 1056-1065.
[32] SCHROEDER H W, CHRISTENSEN J J.Factors affecting resistance of wheat to scab caused by.Phytopathology, 1963, 53: 831-838.
[33] MILLER J D, YOUNG J C, SAMPSON D R.Deoxynivalenol and Fusarium head blight resistance in spring cereals.Journal of Phytopathology, 1985, 113: 359-367.
[34] SNIJDERS C H A, PERKOWSKI J.Effect of head blight caused byon toxin content and weight of wheat kernels.Phytopathology, 1990, 80: 566-570.
[35] MESTERHAZY A.Types and components of resistance to Fusarium head blight of wheat.Plant Breeding, 1995, 114: 377-386.
[36] BAI G H, PLATTNER R, DESJARDINS A, KOLB F L.Resistance to Fusarium head blight and deoxynivalenol accumulation in wheat.Plant Breeding, 2001, 120(1): 1-6.
[37] 程顺和, 杨士敏, 张伯桥, 季开祯, 赵步洪, 高德荣.小麦对赤霉病抗扩展性鉴定方法的研究.中国农业科学,1994, 27(2): 45-49.
CHENG S H, YANG S M, ZHANG B Q, JI K Z, ZHAO B H, GAO D R.Preliminary study on the identification method of wheat scab resistance to spread.Scientia Agricultura Sinica, 1994, 27(2): 45-49.(in Chinese)
[38] 王裕中,杨新宁, 肖庆璞.小麦赤霉病抗性鉴定技术的改进及其抗源的开拓.中国农业科学, 1982, 15(5): 67-77.
WANG Y Z, YANG X N, XIAO Q P.The improvement of identification technique of scab resistance of wheat and the development of resistant sources.Scientia Agricultura Sinica, 1982, 15(5): 67-77.(in Chinese)
[39] LEMMENS M, BUERSTMAYR H, KRSKA R, SCHUHMACHER R, GRAUSGRUBER H, RUCKENBAUER P.The effect of inoculation treatment and long-term application of moisture on Fusarium head blight symptoms and deoxynivalenol contamination in wheat grains.European Journal of Plant Pathology, 2004, 110: 299-308.
[40] BUERSTMAYR H, STEINER B, HARTL L, GRIESSER M, ANGERER N, LENGAUER D, MIEDANER T, SCHNEIDER B, LEMMENS M.Molecular mapping of QTLs for Fusarium head blight resistance in spring wheat: II.Resistance to fungal penetration and spread.Theoretical and Applied Genetics, 2003, 107: 503-508.
[41] MESTERHAZY A.Updating the breeding philosophy of wheat to Fusarium head blight: resistance components, QTL identification and phenotyping-a review.Plants, 2020, 9: 1702.
[42] BAI G H, SHANER G.Management and resistance in wheat and barley to Fusarium head blight.Annual Review of Phytopathology, 2004, 42: 135-161.
[43] 张凯鸣, 马鸿翔, 陆维忠, 蔡志祥, 陈怀谷, 袁生.小麦赤霉病与DON积累抗性及其相关SSR位点差异.作物学报, 2006, 32(12): 1788-1795.
ZHANG K M, MA H X, LU W Z, CAI Z X, CHEN H G, YUAN S.Resistance to Fusarium head blight and deoxynivalenol accumulation and allele variation of related SSR markers in wheat.Acta Agronomica Sinica, 2006, 32(12): 1788-1795.(in Chinese)
[44] MESTERHAZY A.How to avoid toxigenic problems in animal husbandry? Journal of Veterinary Science and Research, 2020, 5(2): 197.
[45] HE Y, AHMAD D, ZHANG X, ZHANG Y, WU L, JIANG P, MA H.Genome-wide analysis of family-1 UDP glycosyltransferases (UGT) and identification of UGT genes for FHB resistance in wheat.BMC Plant Biology, 2018, 18: 67.
[46] GONG X, HE X, ZHANG Y, LI L, SUN Z, BAI G, SINGH P K, LI T.Development of an evaluation system for Fusarium resistance in wheat grains and its application in assessment of the corresponding effects of Fhb1.Plant Disease, 2020, 104: 2210-2216.
[47] MA H, ZHANG X, YAO J, CHENG S.Breeding for the resistance to Fusarium head blight of wheat in China.Frontiers of Agricultural Science and Engineering, 2019, 6(3): 251-264.
[48] BUERSTMAYR H, BAN T, ANDERSON J A.QTL mapping and marker assisted selection for Fusarium head blight resistance in wheat: a review.Plant Breeding, 2009, 128: 1-26.
[49] BUERSTMAYR M, STEINER B, BUERSTMAYR H.Breeding for Fusarium head blight resistance in wheat-Progress and challenges.Plant Breeding, 2020, 139(3): 429-454.
[50] WALDRON B L, MORENO-SEVILL B J, ANDERSON A R, STACK W, FROHBERG R C.RFLP mapping of QTL for fusarium head blight resistance in wheat.Crop Science, 1999, 39: 805-811.
[51] BAI G H, KOLB F, SHANER L G, DOMIER L L.Amplified fragment length polymorphism markers linked to a major quantitative trait locus controlling scab resistance in wheat.Phytopathology, 1999, 89: 343-348.
[52] ANDERSON J A, STACK R W, LIU S, WALDRON B L, FJELD A D, COYNE C, MORENO-SEVILLA B, FETCH J M, SONG Q J, CREGAN P B, FROHBERG R C.DNA markers for Fusarium head blight resistance QTLs its two wheat populations.Theoretical and Applied Genetics, 2001, 102: 1164-1168.
[53] ZHANG X, ZHOU M P, REN L J, BAI G H, MA H X, SCHOLTEN O E, GUO P G, LU W Z.Molecular characterization of Fusarium head blight resistance from wheat variety Wangshuibai.Euphytica, 2004, 139: 59-64.
[54] LIN F, XUE S L, ZHANG Z Z, ZHANG C Q, KONG Z X, YAO G Q, TIAN D G, ZHU H L, LI C J, CAO Y, WEI J B, LUO Q Y, MA Z Q.Mapping QTL associated with resistance to Fusarium head blight in the Nanda2419·Wangshuibai population: II Type I resistance.Theoretical and Applied Genetics, 2006, 112: 528-535.
[55] LI T, BAI G H, WU S Y, GU S L.Quantitative trait loci for resistance to Fusarium head blight in the Chinese wheat landrace Huangfangzhu.Euphytica, 2012, 185(1): 93-102.
[56] LI T, BAI G H, WU S Y, GU S L.Quantitative trait loci for resistance to Fusarium head blight in a Chinese wheat landrace Haiyanzhong.Theoretical and Applied Genetics, 2011, 122(8): 1497-1502.
[57] ZHANG X H, PAN H Y, BAI G H.Quantitative trait loci responsible for Fusarium head blight resistance in Chinese landrace Baishanyuehuang.Theoretical and Applied Genetics, 2012, 125(3): 495-502.
[58] CAI J, BAI G H.Quantitative trait loci for Fusarium head blight resistance in Huangcandou× ‘Jagger’ wheat population.Crop Science, 2014, 54(6): 2520-2528.
[59] SHEN X, ZHOU M, LU W, OHM H.Detection of Fusariumhead blight resistance QTL in a wheat population using bulked segregant analysis.Theoretical and Applied Genetics, 2003, 106(6): 1041-1047.
[60] BOURDONCLE W, OHM H W.Quantitative trait loci for resistance to Fusarium head blight in recombinant inbred wheat lines from the cross Huapei 57-2/Patterson.Euphytica, 2003, 131(1): 131-136.
[61] 朱展望, 徐登安, 程顺和, 高春保, 夏先春, 郝元峰, 何中虎.中国小麦品种抗赤霉病基因Fhb1的鉴定与溯源.作物学报, 2018, 44(4): 473-482.
ZHU Z W, XU D A, CHENG S H, GAO C B, XIA X C, HAO Y F, HE Z H.Characterization of Fusarium head blight resistance gene Fhb1 and its putative ancestor in Chinese wheat germplasm.Acta Agronomica Sinica, 2018, 44(4): 473-482.(in Chinese)
[62] 胡文静,张春梅,吴迪,陆成彬, 董亚超, 程晓明, 张勇, 高德荣.长江中下游小麦抗赤霉病品种的筛选与部分农艺性状分析.中国农业科学,2020, 53(21): 4313-4321.
HU W J, ZHANG C M, WU D, LU C B, DONG Y C, CHENG X M, ZHANG Y, GAO D R.Screening for resistance to Fusarium head blight and agronomic traits of wheat germplasms from Yangtze River region.Scientia Agricultura Sinica, 2020, 53(21): 4313-4321.(in Chinese)
[63] ZHANG P, GUO C, LIU Z, BERNARDO A, MA H, JIANG P, SONG G, BAI G.Quantitative trait loci for Fusarium head blight resistance in wheat cultivars Yangmai 158 and Zhengmai 9023.The Crop Journal, 2021, 9(1): 143-153.
[64] YAN H S, LI G Q, SHI J X, TIAN S S, ZHANG X Q, CHENG R, WANG X, YUAN Y, CAO S Y, ZHOU J Y, KONG Z X, JIA H Y, MA Z Q.Genetic control of Fusarium head blight resistance in two Yangmai 158-derived recombinant inbred line populations.Theoretical and Applied Genetics, 2021, 134: 3037-3049,
[65] JIANG P, ZHANG X, WU L, HE Y, ZUANG W, CHENG X, GE W, MA H, KONG L.A novel QTL on chromosome 5AL of Yangmai 158 increases resistance to Fusarium head blight in wheat.Plant Pathology, 2020, 69: 249-258.
[66] 胡文静, 张勇, 陆成彬, 王凤菊, 刘金栋, 蒋正宁, 王金平, 朱展望, 徐小婷, 郝元峰, 何中虎, 高德荣.小麦品种扬麦16赤霉病抗扩展QTL定位及分析.作物学报, 2020, 46(2): 157-165.
HU W J, ZHANG Y, LU C B, WANG F J, LIU J D, JIANG Z N, WANG J P, ZHU Z W, XU X T, HAO Y F, HE Z H, GAO D R.Mapping and genetic analysis of QTLs for Fusarium head blight resistance to disease spread in Yangmai 16.Acta Agronomica Sinica, 2020, 46(2): 157-165.(in Chinese)
[67] ZHU Z, XU X, FU L, WANG F, DONG Y, FANG Z, WANG W, CHEN Y, GAO C B, HE Z, XIA X, HAO Y.Molecular mapping of quantitative trait loci for fusarium head blight resistance in a doubled haploid population of chinese bread wheat.Plant Disease, 2021, 105(5): 1339-1345.
[68] XU Q, XU F, QIN D, LI M, Fedak G, CAO W, YANG L J, DONG J.Molecular mapping of QTLs conferring Fusarium head blight resistance in Chinese wheat cultivar Jingzhou 66.Plants, 2020, 9: 1021,
[69] YANG J, BAI G H, SHANER G E.Novel quantitative trait loci (QTL) for Fusarium head blight resistance in wheat cultivar Chokwang.Theoretical and Applied Genetics, 2005, 111(8): 1571-1579.
[70] SOMERS D J, FEDAK G, SAVARD M.Molecular mapping of novel genes controlling Fusarium head blight resistance and deoxynivalenol accumulation in spring wheat.Genome, 2003, 46(4): 555-564.
[71] MARDI M, PAZOUKI L, DELAVAR H, KAZEMI M B, GHAREYAZIE B, STEINER B, NOLZ R, LEMMENS M, BUERSTMAYR H.QTL analysis of resistance to Fusarium head blight in wheat using a Frontana-derived population.Plant Breeding, 2006, 125(4): 313-317.
[72] ITTU M, SAULESCU N N, HAGIMA I, ITTU G, MUSTATEA P.Association of fusarium head blight resistance with gliadin loci in a winter wheat cross.Crop Science, 2000, 40: 62-67.
[73] SHEN X R, ITTU M, OHM H W.Quantitative trait loci conditioning resistance to Fusarium head blight in wheat line F201R.Crop Science, 2003, 43: 850-857.
[74] GERVAIS L, DEDRYVER F, MORLAIS J Y, BODUSSEAU V, NEGRE S, BILOUS M, GROOS C, TROTTET M.Mapping of quantitative trait loci for field resistance to Fusarium head blight in an European winter wheat.Theoretical and Applied Genetics, 2003, 106: 961-970.
[75] PAILLARD S, SCHNURBUSCH T, TIWARI R, MESSMER M, WINZELER M, KELLER B, SCHACHERMAYR G.QTL analysis of resistance to Fusarium head blight in Swiss winter wheat (L.).Theoretical and Applied Genetics, 2004, 109: 323-332.
[76] SEMAGN K, SKINNES H, BJORNSTAD A A, MAROY G, TARKEGNE Y.Quantitative trait loci controlling Fusarium head blight resistance and low deoxynivalenol content in hexaploid wheat population from Arina and NK93604.Crop Scince, 2007, 47: 294-303.
[77] DRAEGER R, GOSMAN N, STEED A, CHANDLER E, THOMSETT M, SRINIVASACHARY, SCHONDELMAIER J, BUERSTMAYR H, LEMMENS M, SCHMOLKE M, MESTERHAZY A, NOCHOLSOM P.Identification of QTLs for resistance to Fusarium head blight, DON accumulation and associated traits in the winter wheat variety Arina.Theoretical and Applied Genetics, 2007, 115(5): 617-625.
[78] SCHMOLKE M, ZIMMERMANN G, BUERSTMAYR H, SCHWEIZER G, MIEDANER T, KORZUN V, EBMEYER E, HARTL L.Molecular mapping of Fusarium head blight resistance in the winter wheat population Dream/Lynx.Theoretical and Applied Genetics, 2005, 111: 747-756.
[79] KLAHR A, ZIMMERMANN G, WENZEL G, MOHLER V.Effects of environment, disease progress, plant height and heading date on the detection of QTLs for resistance to Fusarium head blight in an European winter wheat cross.Euphytica, 2007, 154: 17-28.
[80] SCHMOLKE M, ZIMMERMANN G, SCHWEIZER G, MIEDANER T, KORZUN V, EBMEYER E, HARTL L.Molecular mapping of quantitative trait loci for field resistance to Fusarium head blight in a European winter wheat population.Plant Breeding, 2008, 127: 459-446.
[81] LIU S, ABATE Z A, LU H, MUSKET T, DAVIS G L, MCKENDRY A L.QTL associated with Fusarium head blight resistance in the soft red winter wheat Ernie.Theoretical and Applied Genetics, 2007, 115(3): 417-427.
[82] ISLAM M S, BROWN-GUEDIRA G, VAN SANFORD D, OHM H, DONG Y H, MCKENDRY A L.Novel QTL associated with the Fusarium head blight resistance in Truman soft red winter wheat.Theoretical and Applied Genetics, 2016, 207(3): 571-592.
[83] OTTO C D, KIANIAN S F, ELIAS E M, STACK R W, JOPPA L R.Genetic dissection of a major Fusarium head blight QTL in tetraploid wheat.Plant Molecular Biology, 2002, 48: 625-632.
[84] KUMAR S, STACK R W, FRIESEN T L, FARIS J D.Identification of a novel Fusarium head blight resistance quantitative trait locus on chromosome 7A in tetraploid wheat.Phytopathology, 2007, 97: 592-597.
[85] STEED A, CHANDLER E, THOMSETT M, GOSMAN N, FAURE S, NICHOLSON P.Identification of type I resistance to Fusarium head blight controlled by a major gene located on chromosome 4A of.Theoretical and Applied Genetics, 2005, 111: 521-529.
[86] BUERSTMAYR M, LEMMENS M, STEINER B, BUERSTMAYR H.Advanced backcross QTL mapping of resistance to Fusarium head blight and plant morphological traits in aXpopulation.Theoretical and Applied Genetics, 2011, 123(2): 293-306.
[87] MALIHIPOUR A, GILBERT J, FEDAK G, BRULE-BABEL A, CAO W G.Mapping the A genome for QTL conditioning resistance to Fusarium head blight in a wheat population withbackground.Plant Disease, 2017, 101(1): 11-19.
[88] QI L L, PUMPHREY M Q, FRIEBE B, CHEN P D, GILL B S.Molecular cytogenetic characterization of alien introgressions with genefor resistance to Fusarium head blight disease of wheat.Theoretical and Applied Genetics, 2008, 117(7): 1155-1166.
[89] CAINONG J C, BOCKUS W W, FENG Y, CHEN P, QI L, SEHGAL S K, DANILOVA T V, KOO D H, FRIEBE B, GILL B S.Chromosome engineering, mapping, and transferring of resistance to Fusarium head blight disease fromto wheat.Theoretical and Applied Genetics, 2015, 128: 1019-1027.
[90] SHEN X, KONG L, OHM H.Fusarium head blight resistance in hexaploid wheat ()-genetic lines and tagging of the alien chromatin by PCR markers.Theoretical and Applied Genetics, 2004, 108(5): 808-813.
[91] ECKARD J T, GLOVER K D, MERGOUM M, ANDERSON J A, GONZALEZHERNANDEZ J L.Multiple Fusarium head blight resistance loci mapped and pyramided onto elite spring wheatbackgrounds using an IBD-based linkage approach.Euphytica, 2015, 204(1): 63-79.
[92] ECKARD J T, GONZALEZ-HERNANDEZ J L, CAFFE M, BERZONSKY W, BOCKUS W W, MARAIS G F, BAENZIGER P S.Native Fusarium head blight resistance from winter wheat cultivars ‘Lyman’, ‘Overland’, ‘Ernie’, and ‘Freedom’ mapped and pyramided onto ‘Wesley’-Fhb1backgrounds.Molecular Breeding, 2015, 35(1): 6.
[93] LI T, ZHANG D D, ZHOU X L, BAI G H, LI L, GU S L.Fusarium head blight resistance loci in a stratified population of wheat landraces and varieties.Euphytica, 2016, 207(3): 551-561.
[94] ZHU Z, CHEN L, ZHANG W, YANG L, ZHU W, LI J, LIU Y, TONG H, FU L, LIU J, RASHEED A, XIA X, HE Z, HAO Y, GAO C.Genome-wide association analysis of Fusarium head blight resistance in Chinese elite wheat lines.Frontiers in Plant Science, 2020, 11: 206.
[95] HU W, GAO D, WU H, LIU J, ZHANG C, WANG J, JIANG Z, LIU Y, LI D, ZHANG Y, LU C.Genome-wide association mapping revealed syntenic loci QFhb-4AL and QFhb-5DL for Fusarium head blight resistance in common wheat.BMC Plant Biology, 2020, 20: 29.
[96] WU L, ZHANG Y, HE Y, JIANG P, ZHANG X, MA H.Genome-wide association mapping of resistance to Fusarium head blight spread and deoxynivalenol accumulation in Chinese elite wheat germplasm.Phytopathology, 2019, 109: 1208-1216.
[97] LIU S, PUMPHREY, GILL B S, TRICK H N, ZHANG J X, DOLEZEL J, CHALHOUB B, ANDERSON J A.Toward positional cloning of Fhb1, a major QTL for Fusarium head blight resistance in wheat.Cereal Research Communications, 2008, 36 (suppl B): 195-201.
[98] RAWAT N, PUMPHREY M O, LIU S, ZHANG X, TIWARI V K, ANDO K, TRICK H N, BOCKUS W W, AKHUNOV E, ANDERSON J A, GILL B S.Wheat Fhb1 encodes a chimeric lectin with agglutinin domains and a pore-forming toxin-like domain conferring resistance to Fusarium head blight.Nature Genetics, 2016, 48: 1576-1580.
[99] HE Y, ZHANG X, ZHANG Y, DAWOOD A, WU L, JIANG P, MA H.Molecular characterization and expression of PFT, a FHB resistance gene at the Fhb1 QTL in wheat.Phytopathology, 2018, 108: 730-736.
[100] SU Z Q, BERNARDO A, TIAN B, CHEN H, WANG S, MA H X, CAI S B, LIU D T, ZHANG D D, LI T, TRICK H, ST A P, YU J M, ZHANG Z Y, BAI G H.A deletion mutation inconfers Fhb1 resistance to Fusarium head blight in wheat.Nature Genetics, 2019, 51(7): 1099-1105.
[101] LI G, ZHOU J, JIA H, GAO Z, FAN M, LUO Y, ZHOU P, XUE S, LI N, YUAN Y, MA S, KONG Z, JIA L, AN X, JIANG G, LIU W, CAO W, ZHANG R, FAN J, XU X, LIU Y, KONG Q, ZHENG S, WANG Y, QIN B, CAO S, DING Y, SHI J, YAN H, WANG X, RAN C, MA Z.Mutation of a histidine-rich calcium-binding-protein gene in wheat confers resistance to Fusarium head blight.Nature Genetics, 2019, 51(7): 1106-1112.
[102] LAGUDAH E S, KRATTINGER S G.A new player contributing to durable Fusarium resistance.Nature Genetics, 2019, 51: 1070-1071.
[103] GUO J, ZHANG X, HOU Y, CAI J, SHEN X, ZHOU T, XU H, OHM H W, WANG H, LI A, HAN F, WANG H, KONG L.High-density mapping of the major FHB resistance gene Fhb7 derived fromand its pyramiding withby marker-assisted selection.Theoretical and Applied Genetics, 2015, 128: 2301-2316.
[104] WANG H W, SUN S L, GE W Y, ZHAO L F, HOU B Q, WANG K, LYU ZF, CHEN L Y, XU S S, GOU J, LI M, SU P S, LI X F, WANG G P, BO C Y, FANG X J, ZHUANG W W, CHENG X X, WU J W, DONG L H, CHEN W Y, LI W, XIAO G L, ZHAO J X, HAO Y C, XU Y, GAO Y, LIU W J, Liu, Y H, Yin H Y, Li J Z, Li X, Zhao Y, Wang X Q, Ni F, Ma X, Li A F, Xu S S,Bai G H, Nevo E, Gao C X, Ohm H, Kong L R.Horizontal gene transfer offrom fungus underlies Fusarium head blight resistance in wheat.Science, 2020, 368: eaba5435.
[105] 钱存鸣, 杨学明, 姚国才, 姚金保, 周朝飞, 王利明.优质高产小麦新品种宁麦13的选育与应用.江苏农业科学, 2006(5): 36-37.
QIAN C M, YANG X M, YAO G C, YAO J B, ZHOU C F, WANG L M.Breeding and application of superior quality and high yield wheat cultivar Ningmai 13.Jiangsu Agricultural Sciences, 2006(5): 36-37.(in Chinese)
[106] 钱存鸣, 姚金保, 姚国才, 杨学明, 马鸿翔, 周朝飞.优质高产小麦新品种宁麦14的选育与应用.江苏农业科学, 2008(3): 89-90.
QIAN C M, YAO J B, YAO G C, YANG X M, MA H X, ZHOU C F.Breeding and application of superior quality and high yield wheat cultivar Ningmai 14.Jiangsu Agricultural Sciences, 2008(3): 89-90.(in Chinese)
[107] 殷琴,朱晓燕,刘晓霞, 黄奇.不同播种期对扬富麦101生长发育与产量的影响分析.农业科技通讯, 2017(9): 110-113.
YIN Q, ZHU X Y, LIU X X, HUANG Q.The analysis of growth and yield affected by sowing time in Yangfumai 101.Bulletin of Agricultural Science and Technology, 2017(9): 110-113.(in Chinese)
[108] 刘思衡,巫升鑫, 李始明, 方毅敏, 许文真.小麦对赤霉病超亲抗性的选育研究.中国农业科学, 1996, 29(3): 93-95.
LIU S H, WU S X, LI S M, FANG Y M, XU W Z.Studies on the breeding of transgressive resistance to scab in wheat.1996, Scientia Agricultura Sinica, 1996, 29(3): 93-95.
[109] 周朝飞, 夏穗生, 钱存鸣, 姚国才, 沈建新.关于小麦赤霉病育种问题的探讨.中国农业科学, 1987, 20(2): 19-25.
ZHOU C F, XIA S S, QIAN C M, YAO G C, SHEN J X.On the problem of wheat breeding for scab resistance.Scientia Agricultura Sinica, 1987, 20(2): 19-25.(in Chinese)
[110] 柏贵华, 周朝飞, 钱存鸣, 葛永福.小麦新品种(系)抗赤霉病研究.江苏农业科学, 1989(7): 20-22.
Bai G H, Zhou C F, Qian C M, Ge Y F.A study of scab-resistance in new wheat cultivars and advanced lines.Jiangsu Agricultural Sciences, 1989(7): 20-22.(in Chinese)
[111] 程顺和, 张勇, 张伯桥, 高德荣, 吴宏亚, 陆成彬, 吕国锋, 王朝顺.小麦抗赤霉病育种2 条技术路线的探讨.扬州大学学报(农业与生命科学版), 2003, 24(1): 59-62.
CHENG S H, ZHANG Y, ZHANG B Q, GAO D R, WU H Y, LU C B, LÜ G F, WANG C S.Discussion of two ways of breeding scab resistance in wheat.Journal of Yangzhou University (Agricultural and Life Science Edition), 2003, 24(1): 59-62.(in Chinese)
[112] 钱存鸣, 周朝飞, 姚国才, 姚金保, 盛培英, 杨学明.小麦新品种宁麦9号选育与应用.江苏农业科学, 1999(3): 19-20.
Qian C M, Zhou C F, Yao G C, Yao J B, ShenG P Y, Yang X M.Breeding and application of novel wheat cultivar Ningmai 9.Jiangsu Agricultural Sciences, 1999(3): 19-20.(in Chinese)
[113] 蒋国樑,吴兆苏, 陈兆夏, 黄德崇, 肖庆璞, 陈怀谷, 朱涵, 方毅敏.小麦抗赤霉病基因库建拓研究.中国农业科学, 1992, 25(6): 30-37.
JIANG G L, WU Z S, CHEN Z X, HUANG D C, XIAO Q P, CHEN H G, ZHU H, FANG Y M.Studies on the development of scab-resistance gene pool in wheat.Scientia Agricultura Sinica, 1992, 25(6): 30-37.(in Chinese)
[114] 翟虎渠, 刘秉华.矮败小麦创制与应用.中国农业科学, 2009, 42(12): 4127-4131.
ZHAI H Q, LIU B H.The innovation of dwarf male sterile wheat and its application in wheat breeding.Scientia Agriculture Sinica, 2009, 42(12): 4127-4131.(in Chinese)
[115] 刘宗镇, 汪志远, 黄德崇, 赵文俊, 黄晓敏, 姚泉洪, 孙锡娟, 杨银妹.小麦赤霉病抗性及抗性资源利用.作物学报, 1991, 7(增刊.): 65-70.
Liu Z Z, Wang Z Y, Huang D C, Zhao W J, Huang X M, Yao Q H, Sun X J, Yang Y M.Generality of scab-resistance transgression in wheat and utilization of scab-resistance genetic resources.Acta Agriculturae Shanghai, 1991, 7(suppl.): 65-70.(in Chinese)
[116] WAN Y F, YEN C, YANG J L, QUAN L F.Evaluation offor resistance to head scab caused bySchwabe.Genetic Resources and Crop Evolution, 1997, 44: 211-215.
[117] 陈佩度, 王兆悌, 王苏玲, 黄丽, 王裕中, 刘大钧.将大赖草种质转移给普通小麦的研究-抗赤霉病异附加系选育.遗传学报, 1995, 22: 380-386.
CHEN P D, WANG Z T, WANG S L, HUANG L, WANG Y Z, LIU D J.Transfer of useful germplasm forLam.to common wheat.Development of addition lines with wheat scab resistance.Acta Genetica Sinica,1995, 22: 380-386.(in Chinese)
[118] 翁益群,刘大钧.鹅观草与普通小麦属间杂种F1的形态、赤霉病抗性和细胞遗传学研究.中国农业科学, 1989, 22(5): 1-7.
WENG Y Q, LIU D J.Morphology, scab resistance and cytogenetics of intergeneric hybrids ofL.withC.Koch species.Scientia Agricultura Sinica, 1989, 22(5): 1-7.(in Chinese)
[119] CAI X, CHEN P D, XU S S, OLIVER R E, CHEN X.Utilization of alien genes to enhance Fusarium head blight resistance in wheat-a review.Euphytica, 2005, 142: 309-318.
[120] 马鸿翔, 陆维忠.小麦赤霉病抗性改良研究进展.江苏农业学报, 2010, 26(1): 197-203.
Ma H X, Lu W Z.Progress on genetic improvement for resistance to Fusarium head blight in wheat.Jiangsu Journal of Agricultural Sciences, 2010, 26(1): 197-203.(in Chinese)
[121] 陆维忠, 程顺和, 沈晓蓉, 周朝飞, 章静娟, 王裕中.细胞工程在小麦抗赤霉病育种中的利用.江苏农业学报, 1998, 14(1): 9-14.
LU W Z, CHENG S H, SHEN X R, ZHOU C F, ZHANG J J, WANG Y Z.Study on utilization of cell engineering in breeding wheat for scab resistance.Jiangsu Journal of Agricultural Sciences, 1998,14(1): 9-14.(in Chinese)
[122] 陆维忠, 程顺和, 马鸿翔, 马谈斌, 周淼平, 张伯桥, 李浩兵, 张旭.优质高产抗赤霉病小麦新品种生选3号.江苏农业学报, 2003(2): 69.
LU W Z, CHENG S H, MA H X, MA T B, ZHOU M P, ZHANG B Q, LI H B, ZHANG X.A new wheat variety with high quality, high yield and resistance to wheat scab-Shengxuan 3.Jiangsu Journal of Agricultural Sciences, 2003(2): 69.(in Chinese)
[123] 陆维忠, 马鸿翔.高产抗赤霉病小麦新品种生选6号的选育.江苏农业科学, 2010(5): 153-154.
LU W Z, MA H X.Breeding for new variety Shengxuan 6 with high yield and resistance to FHB.Jiangsu Agricultural Sciences, 2010(5): 153-154.(in Chinese)
[124] 陆维忠, 姚金保, 马鸿翔.抗赤霉病小麦新品种宁麦20的选育.江苏农业科学, 2013(7): 86-87.
LU W Z, YAO J B, MA H X.Breeding for new variety Ningmai 20 with resistance to FHB.Jiangsu Agricultural Sciences, 2013(7): 86-87.(in Chinese)
[125] ZHOU W, KOLB F L, YU J, BAI G, BOZE L K, DOMIER L L.Molecular characterization of Fusarium head blight resistance in Wangshuibai with simple sequence repeat and amplified fragment length polymorphism markers.Genome, 2004, 47(6): 1137-1143.
[126] PUMPHREY M O, BERNARDO R, ANDERSON J A.Validating the QTL for Fusarium head blight resistance in near-isogenic wheat lines developed from breeding populations.Crop Science, 2007, 47: 200-206.
[127] BERNARDO A, BAI G H, YU J B, KOLB F, BOCKUS W, DONG Y H.Registration of near-isogenic winter wheat germplasm contrasting in for Fusarium head blight resistance.Journal of Plant Registration, 2014, 8(1): 106-108.
[128] MIEDANER T, WILDE F, STEINER B, BUERSTMAYR H, KORZUN V, EBMEYER E.Stacking quantitative trait loci (QTL) for Fusarium head blight resistance from non-adapted sources in a European elite spring wheat background and assessing their effects on deoxynivalenol (DON) content and disease severity.Theoretical and Applied Genetics, 2006, 112: 562-569.
[129] 陆成彬, 程顺和, 吴荣林, 胡云花, 范金萍, 王朝顺, 张伯桥.扬麦13抗赤霉病品系的分子标记辅助选育.麦类作物学报, 2010, 30(6): 1058-1064.
LU C B, CHENG S H, WU R L, HU Y H, FAN J P, WANG C S, ZHANG B Q.Breeding the lines with resistance to fusarium head blight of wheat cultivar Yangmai 13 by molecular marker assisted selection.Journal of Triticeae Crops, 2010, 30(6): 1058-1064.(in Chinese)
[130] SALAMEH A, BUERSTMAYR M, STEINER B, NEUMAYER A, LEMMENS M, BUERSTMAYR H.Effects of introgression of two QTL for Fusarium head blight resistance from Asian spring wheat by marker-assisted backcrossing into European winter wheat on Fusarium head blight resistance, yield and quality traits.Molecular Breeding, 2011, 28(4): 485-494.
[131] MA Z, XIE W, LI G, JIA H, ZHOU J, KONG Z, LI N, YUAN Y.Germplasms, genetics and genomics for better control of disastrous wheat Fusarium head blight.Theoretical and Applied Genetics, 2020, 133(5): 1541-1568.
[132] SHAKOOR N, LEE S, MOCKLER T C.High throughput phenotyping to accelerate crop breeding and monitoring of diseases in the field.Current Opinion in Plant Biology, 2017, 38: 184-192.
[133] CHEN Y, SONG W, XIE X, WANG Z, GUAN P, PENG H, JIAO Y, NI Z, SUN Q, GUO W.A collinearity-incorporating homology inference strategy for connecting emerging assemblies inTribe as a pilot practice in the plant pan-genomic era.Molecular Plant, 2020, 13(12): 1694-1708.
[134] 葛文扬, 孙思龙, 王宏伟, 孔令让.天然“转基因”使小麦获得赤霉病抗性.自然杂志, 2020, 42(4): 340-346.
GE W Y, SUN S L, WANG H W, KONG L R.Natural “transgenic” conferring Fusarium head blight resistance in wheat.Chinese Journal of Nature, 2021, 42(4): 340-346.(in Chinese)
[135] ZHENG T, HUA C, LI L, SUN Z, YUAN M, BAI G, HUMPHREYS G, LI T.Integration of meta-QTL discovery with omics: Towards a molecular breeding platform for improving wheat resistance to Fusarium head blight.The Crop Journal, 2021, 9(4): 739-749.
Review and Prospect on the Breeding for the Resistance to Fusarium Head Blight in Wheat
MA HongXiang1*, WANG YongGang1, Gao YuJiao1, HE Yi2, JIANG Peng2, WU Lei2, ZHANG Xu2*
1Agricultural College of Yangzhou University/Jiangsu Co-innovation Center of Modern Production Technology of Grain Crops/Jiangsu Key Lab of Crop Genome & Molecular Breeding, Yangzhou 225009, Jiangsu;2Jiangsu Academy of Agricultural Sciences/CIMMYT-JAAS joint research center for wheat disease/Collaborative Innovation Center for Modern Crop Production co-sponsored by Province and Ministry, Nanjing 210014
Fusarium head blight (FHB) caused bycomplex, is one of the most disastrous diseases seriously affecting yield and quality in wheat.Wheat kernels infected by Fusarium pathogen produce Fusarium mycotoxin, especially deoxynivalenol (DON), which may threaten the health of human beings and livestock.Breeding and application FHB resistant varieties is effective to control the disease and mycotoxin.Breeding for the resistance to FHB in wheat was commenced in 1950s in China.A national network on FHB research in wheat was established in 1970s.Inoculation methods were established and widely used for evaluating FHB resistance.Sumai 3, Wangshuibai and other resources with high resistance to FHB were selected and applied worldwide.Release of Yangmai 158 and Ningmai 9 with desirable agronomic traits and moderate resistance to FHB was a breakthrough in wheat breeding for FHB resistance.Such varieties have not only been widely applied in wheat production, but also produced more than 20 wheat varieties as parents of each variety.In addition to conventional breeding, chromosome engineering was used for transfer alien germplasm into wheat cultivated varieties, somaclonal variation and double haplotype produced by cell engineering techniques broadened genetic background and improved breeding efficiency in wheat genetic improvement for FHB resistance.The outbreak of FHB in North America in 1990s initiated the attention to FHB research in the United States and Europe.International cooperation prompted the exchange on material, technology and information in wheat breeding for FHB resistance.As results, significant progress in the research of FHB resistance type, inoculation techniques and evaluation index, germplasm development, QTL mapping, gene cloning, marker assisted selection and breeding for FHB resistance has been made.More than 600 QTL associated with FHB resistance were identified and located on all 21 chromosomes of wheat by using bi-parents linkage mapping and whole genome association analysis.Seven major genes/QTL were named as-.For the major QTL,, associated with FHB resistance derived from sumai 3 and Wangshuibai, the key candidate gene was cloned and validated, functional markers were developed and effectively used for marker assisted selection and new varieties possessingwere released.Thegene fromhas also been isolated and used to improve FHB resistance in wheat.Pyramiding multiple QTL by marker assisted selection enhanced the resistance to FHB in wheat base on QTL fine mapping and close linked marker development.In the future, we should establish accurate phenotypic evaluation systems for evaluating the resistance to Fusarium head blight, strengthen the discovery of novel resistance germplasms and genes, isolate key genes related to FHB resistance and uncover their molecular mechanism, combine marker-assisted selection or genome selection with conventional breeding to continuously improve FHB resistance, breed wheat varieties with FHB resistance significantly improved and excellent agronomic traits.
wheat; genetics; breeding; Fusarium head blight; mycotoxin
2021-07-23;
2021-08-27
江苏省重点研发项目(BE2021335)、国家重点研发计划(2016YFD0101802,2017YFD0100806)、国家现代农业产业技术体系建设专项(CARS-03)
通信作者马鸿翔,E-mail:mahx@yzu.edu.cn。通信作者张旭,E-mail:xuzhang@jaas.ac.cn
(责任编辑 李莉)

