大肠杆菌离体重组系统转运FhaB突变体
黄丕英,蔡 锟,韦良婉,王星媛,王 哲,储引娣, 范恩国
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原生物学系 医学分子生物学国家重点实验室,北京 100005)
革兰阴性菌V型分泌系统分为Va-Ve亚型,由乘客结构域或蛋白质(passenger domains or proteins)和β-桶状结构域组成[1],因其结构简单而被广泛应用在生物工程领域。其中Vb亚型的乘客蛋白与β-桶状结构域是分离的,通常称为双组分转运系统(two-partner secretion, TPS)[2]。其乘客结构域习惯被称为TpsA(two-partner secretion protein A),桶状部分称为TpsB[3]。
目前研究较多的是百日咳杆菌(Bordetellapertussis)的TPS系统[4]。其胞外蛋白丝状血凝素(filamentous hemagglutinin, FHA)[5]的前体FhaB,分子质量367 ku,由FhaC转运至细菌表面,经加工形成230 ku的成熟蛋白[6]。对于FhaB如何由FhaC转运至细胞表面的机制,目前还知之甚少。
为了解TPS系统的机制,需建立便捷的体外研究体系。前期研究发现,FhaC在体外能转运37 ku的FhaB截短底物[7]。而FhaB的分子质量为367 ku,体外重组系统是否能转运大分子质量的底物?利用已建立的离体重组系统,检测其在体外是否能转运更大分子质量的底物,探讨该系统用于TPS机制研究的可行性。
1 材料与方法
1.1 材料
EscherichiacoliTrans5α感受态、BL21(DE3)感受态(北京全式金生物技术有限公司);pTrc99a质粒、FhaC的表达载体(德国弗莱堡大学Matthias Mueller教授馈赠);FhaB*37、FhaB*60和FhaB*80的上下游引物[生工生物工程(上海)股份有限公司];EasyTagTMEXPRESS 35S Protein Labeling Mix(PerkinElmer)(中国同福公司)。
1.2 方法
1.2.1 溶液配制:10×柠檬酸盐缓冲液:20 mg/mL一水柠檬酸、131 mg/mL三水合磷酸氢二钾、35 mg/mL四水合磷酸氢铵钠、1 mg/mL七水合硫酸镁。E1培养基:1×柠檬酸盐缓冲液、除Met/Cys外浓度为100 μmol/L的18种氨基酸、0.4%葡萄糖。E2培养基:1×柠檬酸盐缓冲液、除Met/Cys外浓度为100 μmol/L的18种氨基酸、2%甘油、0.25 mol/L蔗糖。
1.2.2 载体的构建:以载体pFJD12[8]为模板,扩增FhaB*37、FhaB*60和FhaB*80的DNA片段。FhaB*37的上游引物:5′-CCCTCATGAAAAAGAC AGCTATCGCGATTGCAGTGG-3′,FhaB*37的下游引物:5′-CGGCTCGAGCATCATCATCATCATGTCGAC CCGTCGCGTCGCCGACAGC-3′;FhaB*60的上游引物:5′-CCCCGCTCAGCCTCAAGGGC-3′,FhaB*60的下游引物:5′-GCCTTGTCGATCGATAGCATGATGAT GATGATGATGCTCGAGGGGG-3′;FhaB*80的上游引物:5′-CCCCGCTCAGCCTCAAGGGC-3′,FhaB*80的下游引物:5′-TGCGCGGCGGATCCATGATGATGAT GATGCTCGAGGGGG-3′。利用BspHⅠ和XhoⅠ酶切位点,连接至pTrc99a载体,转化入E.coliTrans5α感受态,测序验证正确后转化入E.coliBL21(DE3)感受态。
1.2.3 外膜的制备:FhaC的表达载体转化E.coliBL21(DE3),表达菌株接种至LB培养基,培养至A600=0.8左右,加入1 mmol/L IPTG诱导,37 ℃诱导2~3 h,收集细胞。具体的纯化步骤见参考文献[9]:裂解细胞后获得含膜的组分,进行蔗糖密度梯度(0.77、1.44和2.02 mol/L 蔗糖)于4 ℃,25 000 r/min离心16 h。外膜是一层淡黄色的圆环,位于1.44 mol/L和2.02 mol/L之间的界面,使用缓冲液 (50 mmol/L三乙醇胺醋酸盐缓冲液, pH 7.5,250 mmol/L蔗糖,1 mmol/L DTT) 溶解外膜。
1.2.4 原生质球的制备:5 mL含FhaB*37、FhaB*60和FhaB*80的表达菌株在E1培养基(加100 μg/mL的氨苄青霉素和1 mmol/L 的甲硫氨酸和半胱氨酸)过夜培养后,8 000 r/min、离心2 min,弃去上清。沉淀用T/S缓冲液(100 mmol/L Tris/HCl, pH 7.5, 0.5 mol/L蔗糖)重悬成A580为4的溶液。分别加入等体积的L/E溶液(0.1 mg/mL lysozyme,8 mmol/L EDTA,pH 8.0)于上述离心管中,用移液枪轻缓吹打以形成均一的溶液,后立即置于冰上15 min。10 000 r/min离心10 min,弃去上清,加入等体积的E2培养基并重悬均匀,然后置于冰上备用。
1.2.5 FhaB转运的检测:向制备好的原生质球中加入[35S]标记的甲硫氨酸/半胱氨酸、 ITPG诱导蛋白的表达,37 ℃,2 min。离心,上清加至含FhaC的蛋白质脂质体,37 ℃孵育15 min。反应体系分成两份,一份直接加入TCA进行沉淀,另一份加入蛋白酶K,25 ℃孵育25 min后,加入TCA进行沉淀。SDS-PAGE后,用磷屏检测同位素信号。
2 结果
2.1 FhaB突变体的构建
周质中全长的FhaB的分子质量为367 ku(图1),由N端TPSD(N-terminal two-partner secretion domain)、长的重复的β-螺旋组成的长轴、成熟的C端结构域MCD(mature C-terminal domain)和前体结构域(prodomain)组成。前体结构域分子质量为147 ku,在周质空间被切除。在FhaB的DNA片段的上游将其自身信号肽的N端延长区替换成大肠杆菌OmpA的信号肽,在C端额外加入5个连续的甲硫氨酸以增强同位素信号,加入组氨酸标签以作后续纯化使用(图1)。成功构建了分子质量为37、60和80 ku的FhaB截短突变体。
2.2 原生质球检测FhaB*37分泌
FhaB*37的原生质球被同位素标记后,在3、10、30、90和120 min不同时间点取出相同量的原生质球。离心后的沉淀在图2A中1~5泳道,检测原生质球内的FhaB的情况,上清在6~10泳道,检测从原生质球释放的FhaB的情况。第1泳道中,在35~40 ku有3个主要的条带。最大的条带(分子质量约39 ku)在120 min的时候几乎完全消失(泳道5)。随着最大条带逐渐消失,中间38 ku左右的条带的强度在逐渐增加(图2A1~5泳道)。37 ku的条带在原生质球中含量较稳定,是上清中唯一的主带(图2A 6~10泳道),上清中该条带的量在逐渐增加。
2.3 FhaC转运FhaB*80
FhaB*37转运试验中,加入蛋白酶K处理后,仍能在37 ku处检测到FhaB*37条带(图3A泳道2),但当加入1% Trition X-100处理后,再用蛋白酶K 处理,则该37 ku条带完全消失,故FhaB*37被FhaC蛋白成功转运至脂质体内。设定转运效率(transport efficiency)为蛋白酶K处理后条带的强度与原生质球分泌的FhaB*37条带强度的比值。经计算,FhaB*37的转运效率在58%左右。

The OmpA signal peptide (SP) was directly followed by the native FhaB SP that lacks its N-terminal extension; the N-terminal fragment of FhaB ends with a methionine repeat for an optimized radioactive labeling and a C-terminal His-tag for Western blot analysis and purification
图1 FhaB结构示意图
Fig 1 Schematic representation of the FhaB-truncations and modifications

A:expression of FhaB*37 in spheroplasts, 1-5 represent 3, 10, 30, 90, and 120 min time point, respectively, 6-10 are samples of supernatant from lanes 1-5; B:schematic diagram of FhaB release from spheroplasts, the solid circle represents the spheroplasts 1) harboring the cytosolic precursor of FhaB,2) upon secretion the signal peptide is cleaved off and FhaB remains associated to the periplasmic side of the inner membrane before 3)it is finally released into the periplasm
同理检测FhaB*60的转运。构建FhaB*60和FhaB*37带组氨酸标签的载体,用抗组氨酸标签的抗体进行Western blot检测(图3B),发现FhaB*37和FhaB*60电泳迁移率与理论一致(图3A)。加入含FhaC的蛋白质脂质体后看见有不被蛋白酶K降解的FhaB*60条带(图3A泳道5),而且加入1% Triton X-100后,FhaB*60的条带经蛋白酶处理消失,故FhaB*60被FhaC成功转运至脂质体内(图3A泳道4~6)。计算FhaB*60的转运效率为30%左右。
IPTG诱导原生质球表达FhaB*80突变体后,在70~100 ku观察到FhaB*80条带(图3C,泳道1)。加入蛋白酶K后,含有FhaC 的蛋白脂质体体系中检测到FhaB*80能被成功转运(图3C,比较泳道3和6)。
3 讨论
双组分系统广泛存在于革兰阴性菌,在细菌与环境的相互作用中有重要功能。TpsB 蛋白属于Omp85超家族,该家族包括来源于细菌的BAM复合物中的BamA、线粒体的Tob55/Sam50、叶绿体的Toc75[10]。TpsA蛋白通常分子质量大,其如何由TpsB转运出细胞的机制目前仍不清楚,亟需建立简单有效的体系来研究该转运机制。
目前研究比较多的TPS系统是Bordetellapertussis来源的FhaC和FhaB。本研究通过构建不同大小的FhaB突变体,使用含FhaC的蛋白脂质体离体重组系统检测转运不同大小FhaB的能力,从而探讨该系统用于研究TPS转运机制的可能性。在使用FhaB*37原生质球分泌蛋白时发现,存在3条主带。在图2中120 min几乎完全消失的条带,推测是被信号肽切除的前体蛋白pre FhaB*37。而中间强度逐渐增加的条带,推测是由于只切除了OmpA的信号肽形成。而在37 ku处的条带为释放的成熟FhaB*37,说明原生质球成功分泌出了FhaB*37(图2B)。从实验结果可以看出,构建的体外重组系统可转运分子质量80 ku大小的底物蛋白。因而,该系统有望用于对FhaB分泌、加工机制的深入研究,并为其他TPS系统机制研究提供可行性。
双组份系统中TpsA蛋白独立于TpsB蛋白合成,因而在周质空间中需要有TpsA和TpsB的识别机制,同时需要TpsB的重复使用以转运多个拷贝的底物[11]。TpsB蛋白的插膜需要BAM复合物,本体系中TpsA蛋白的转运可以仅仅由TpsB蛋白完成。有假说认为BAM蛋白复合体(β-barrel assembly machinery)除了参与β-桶状蛋白的折叠和插入外[12],还参与了乘客结构域的跨外膜转运[13]。体系中将TpsB制备成蛋白脂质体后, 可能因缺少BAM复合物的某些功能,或缺少足够分子伴侣维持大分子质量TpsA蛋白的稳定,因而该体系转运大分子质量底物明显低于小分子质量底物。将来在体系中会考虑优化这些方面。
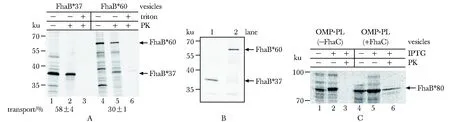
A:in vitro translocation experiment of FhaB*37, and FhaB*60, 1-3.represent translocation of FhaB*37 without PK, with PK, with PK and Triton X-100, respectively, 4-6.represent translocation of FhaB*60 without PK, with PK, with PK and Triton X-100, respectively; B:metal-affinity isolation of C-terminally His-tagged and radioactively labeled FhaB*37 (lane 1) and FhaB*60 (lane 2) using magnetic beads; C:in vitro translocation experiment of FhaB*80. FhaB*80 translocation without FhaC (lanes 1-3) or with FhaC (lanes 4-6), without IPTG (Lanes 1 and 4), with IPTG (Lanes 2 and 5), with IPTG and PK (Lanes 3 and 6)

