羧胺三唑乳清酸盐抑制人胰腺癌吉西他滨耐药细胞株增殖及线粒体能量代谢
陈秋霞,杨黎星,马 瑞,赵永晶,王钰铖,鞠 瑞,郭 磊
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005)
胰腺癌(pancreatic cancer)是一种高度致命的恶性肿瘤,被诊断后患者5年内的生存率在10%左右[1]。由于患者在癌早期阶段症状表现不明显,因此胰腺癌的早期诊断非常困难,即使通过手术治疗后,预后情况也比较差。目前,胰腺癌的治疗手段包括手术切除、辅助化学治疗及免疫治疗等[2]。吉西他滨则是术后辅助化学治疗的标准一线化学治疗药物,但是吉西他滨耐药问题日益成为胰腺癌辅助化学治疗的突出问题。因此,探索克服胰腺癌吉西他滨耐药的方法和策略对人类的生命健康具有重要意义[3]。
羧胺三唑乳清酸盐(carboxyamidotriazole-oro-tate,CTO)是小分子抗肿瘤药物羧胺三唑的乳清酸盐形式。羧胺三唑是一种非电压性钙通道和钙通道介导的信号通路的细胞抑制剂,具有抗癌,抗感染活性和抗血管生成作用[4]。研究表明羧胺三唑能够抑制线粒体复合物I活性,降低肿瘤细胞氧化磷酸化水平从而抑制肿瘤细胞增殖[5]。产生化学耐药性的胰腺癌细胞的代谢方式则发生明显重编程现象,较对细胞毒类药物敏感的胰腺癌细胞,产生化学耐药性的胰腺癌细胞则有更高的糖酵解水平,而先天性耐药的胰腺癌肿瘤干细胞则有更高的氧化磷酸化水平[6]。目前,CTO对胰腺癌吉西他滨耐药细胞的影响尚不明确。本研究旨在探索胰腺癌耐药株和敏感株在能量代谢上的差异以及CTO对胰腺癌耐药细胞增殖和凋亡的影响,初步探究CTO在干扰胰腺癌耐药株能量代谢上的作用机制,为进一步优化胰腺癌耐药问题的解决方案提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞株:人胰腺癌吉西他滨耐药细胞株ASPC-1-GEM(哈灵生物,以下简称为AG细胞)。
1.1.2 药品与试剂:CTO(MCE公司);DMSO(Sigma-Aldrich公司);DMEM高糖培养基、0.25%胰蛋白酶(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(Gibco公司);磺酰罗丹明B(Sulforhodamine B, SRB)细胞增殖和毒性检测试剂盒、annexinV-FITC/PI细胞凋亡检测试剂盒和BCA蛋白定量检测试剂盒(上海翊圣生物科技有限公司);XF Mito Stress Test Kit(Agilent公司);NAD+/NADH检测试剂盒(BioAssay公司)。兔抗LC3-Ⅱ单克隆抗体和兔抗P62抗体(CST公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:15%胎牛血清DMEM高糖培养基,在5% CO2、37 ℃的培养箱中培养AG细胞。实验分组为:对照组(control组);给药组(CTO),CTO用DMSO配制成40 mmol/L母液,后用DMEM培养基配制不同终浓度CTO处理细胞。
1.2.2 SRB法检测细胞活力:用DMEM高糖培养基进行AG细胞培养与传代。在96孔板中接种AG细胞悬液,调整细胞为2×106个/mL,每孔100 μL,分组给药,给药组以20和40 μmol/L CTO给药,培养48和72 h。随后弃去孔中的培养液,按照SRB检测试剂盒说明书操作,用酶标仪上机检测激发波长在515 nm处的吸光度值,并依据吸光度值计算细胞存活率。计算公式为存活率=(A-A空白)/(Acon-A空白)×100%。
1.2.3 CFSE染色及流式细胞仪检测细胞分裂速度:用无血清的DMEM(高糖)培养基配制5 μmol/L的CFSE工作液备用。准备1 mL AG细胞悬液,用不含血清的DMEM(高糖)培养基调整细胞浓度至1.0×106个/mL。取500 μL细胞悬液至15 mL离心管中,加入适量浓度的CFSE工作液。将离心管放入37 ℃培养箱中15~30 min。离心去上清,加入2 mL PBS溶液,重悬细胞,再离心去上清。加入DMEM(高糖)培养基制成细胞悬液,重新种板并分组给药,药物处理之后收集细胞,用流式细胞仪检测细胞分裂,激发波长为488 nm。
1.2.4 Annexin V/PI双染色及流式细胞仪检测细胞凋亡:取对数增殖期的AG细胞接种于中皿中,2.0×105个/孔,隔天分组给药。药物作用48 h后收集细胞,PBS洗3遍。按照细胞凋亡试剂盒说明书操作,室温避光孵育10~15 min。用流式细胞仪检测细胞凋亡,激发波长为488 nm。
1.2.5 MTT法检测细胞内NAD+、NADH含量:取对数增殖期的AG细胞接种于10 cm培养皿中,2.0×106个/皿,隔天分组给药,药物作用6 h后,收集细胞,调整各组细胞数目一致。按照NAD+/NADH检测试剂盒说明书操作,用酶标仪测定565 nm处的吸光度(A)值。
1.2.6 Seahorse生物能量实验检测细胞耗氧速率(oxygen consumption rate,OCR):取对数增殖期的AG细胞接种于24孔板中,1×105个/孔,隔天给药,给药组以20 μmol/L CTO给药。药物作用6 h后按照XF Mito Stress检测试剂盒的说明书进行操作,使用Seahorse XF分析仪上机检测。
1.2.7 Western blot检测细胞自噬相关蛋白表达:取对数增殖期的AG细胞接种于6 cm培养皿中,5×105个/皿,隔天给药,给药组以20 μmol/L CTO给药。药物给药48 h后提取蛋白,并将提取出的蛋白溶液进行BCA蛋白定量。之后用Western blot检测相关蛋白表达,具体步骤包括:SDS-PAGE、转膜、杂交与封闭、化学发光与成像,用Image J软件进行吸光度值分析。
1.3 统计学分析
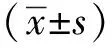
2 结果
2.1 CTO抑制AG细胞存活
AG细胞与CTO共同孵育48和72 h后,与对照组相比,细胞存活率呈时间-剂量依赖性明显降低(P<0.05,P<0.01和P<0.001)(图1)。
2.2 CTO减缓AG细胞分裂
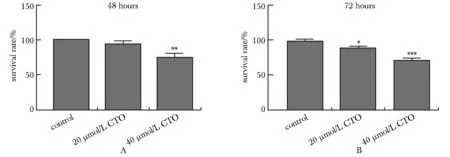
20 μmol/L CTO组荧光强度明显右移,平均荧光强度明显高于对照组(P<0.05)(图2)。
2.3 CTO促进AG细胞凋亡
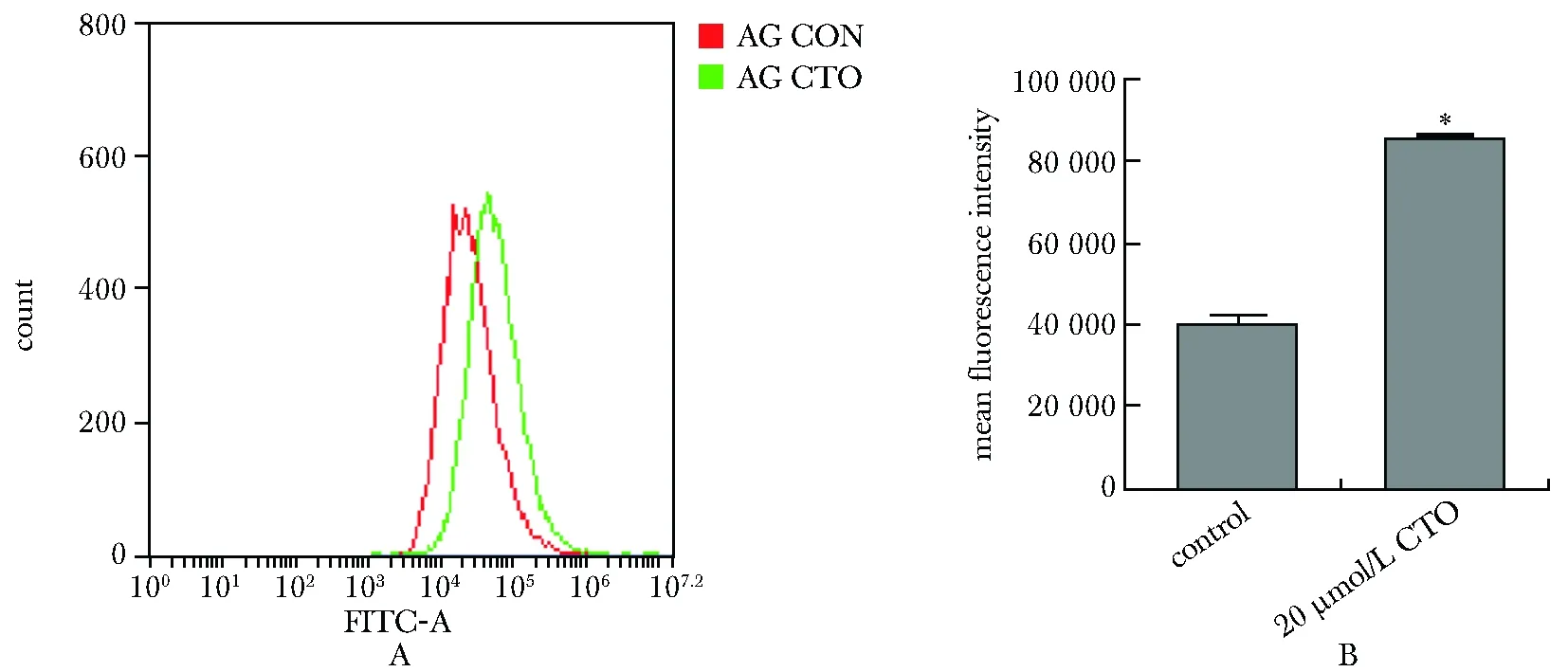
与对照组相比,10、20和40 μmol/L CTO组早期凋亡的细胞比例随着药物浓度明显增加,20、40 μmol/L CTO组晚期凋亡的细胞比例随着药物浓度明显增加(P<0.05或P<0.01)(图3)。
2.4 CTO升高AG细胞内NADH含量,降低NAD+/NADH比值
与对照组相比,20、40 μmol/LCTO组AG细胞内NADH的量随着剂量的增加显著升高(P<0.05或P<0.001)。与对照组相比,20、40 μmol/L CTO组AG细胞内NAD+/NADH的比值随着剂量的增加明显降低(P<0.01)(图4)。
A.bar graph of survival rate of AG cells after being treated with CTO for 48 hours; B.bar graph of survival rate of AG cells after being treated with CTO for 72 hours; *P<0.05, **P<0.01,***P<0.001 compared with control group
A.division rate of AG cells by flow cytometry; B.bar graph of mean fluorescence intensity in AG cells after being staining with CFSE; *P<0.05 compared with control group
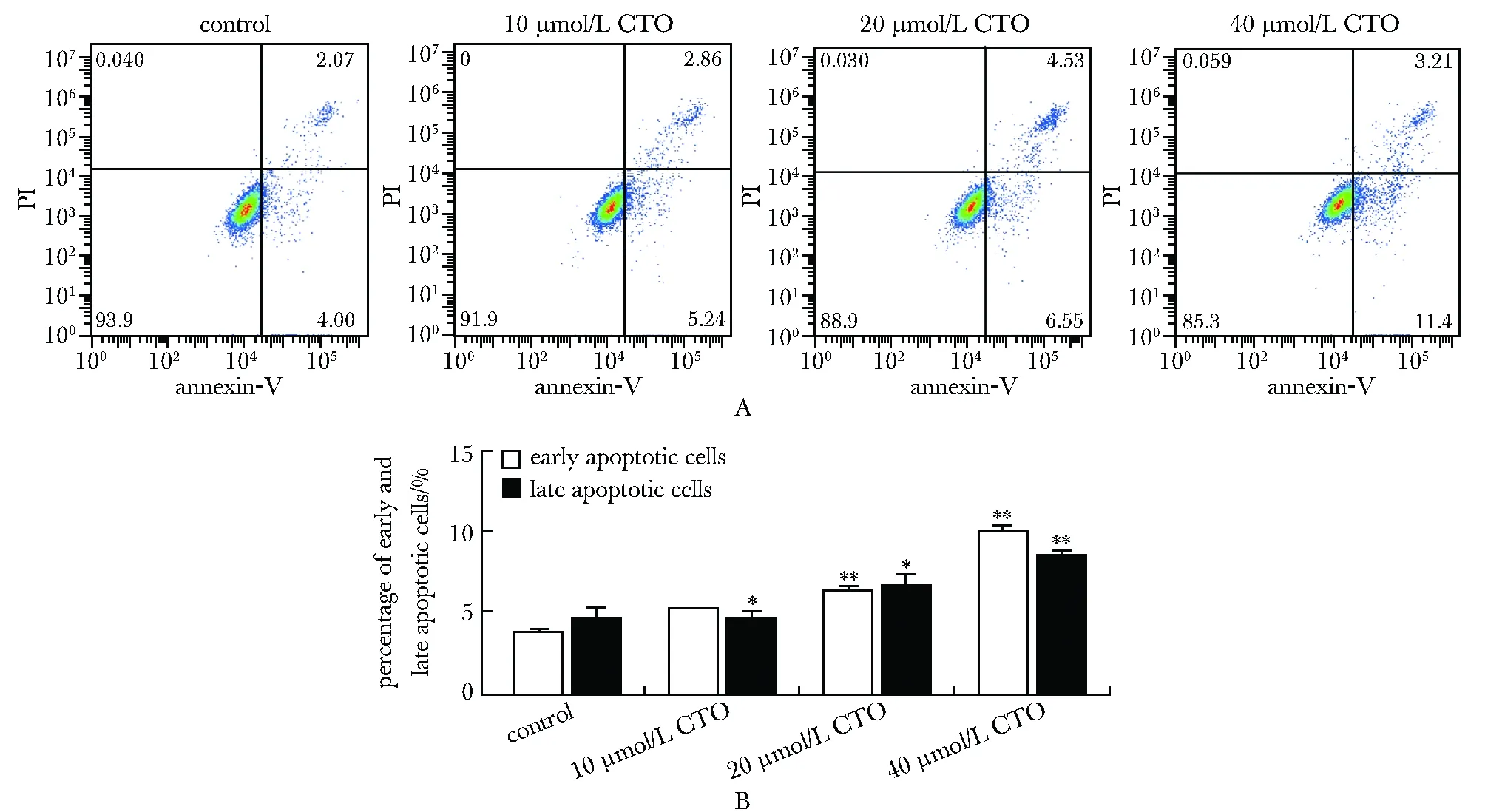
A.apoptosis of AG cells by flow cytometry; B.bar graph of early and late apoptotic AG cells; *P<0.05, **P<0.01 compared with control group
2.5 CTO能够抑制AG细胞线粒体呼吸
在Seahorse生物能量实验中,与对照组相比,20 μmol/L CTO组AG细胞的OCR降低,基础呼吸值、剩余呼吸能力和最大呼吸值都明显降低(P<0.05)(图5)。
2.6 CTO降低AG细胞的LC3-Ⅱ、P62蛋白表达
与对照组相比,CTO给药组明显降低AG细胞内LC3-Ⅱ、P62蛋白表达(P<0.05)(图6)。

A.concentration of NADH in AG cells after being treated with CTO for 6 hours; B.concentration of NAD+ in AG cells after being treated with CTO for 6 hours; C.the radio of NAD+/NADH in AG cells;*P<0.05, **P<0.01 compared with control group
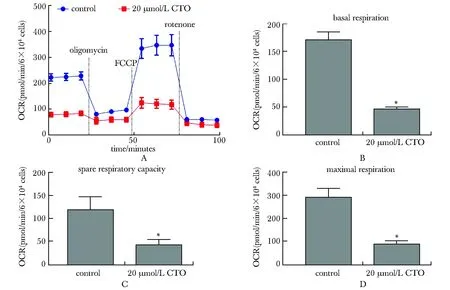
A.OCR data of AG cells after being treated with CTO for 6 hours; B.bar graph of basal respiration; C.bar graph of spare respiratory capacity; D.bar graph of maximal respiration;*P<0.05 compared with control group
3 讨论
羧胺三唑是一种具有抗肿瘤作用的小分子化合物,而羧胺三唑的乳清酸盐形式(CTO)能够增加羧胺三唑的生物利用度,提高羧胺三唑的血药浓度,从而达到低细胞毒性的效果[7]。本研究证实了CTO能够通过减缓细胞分裂速率和促进细胞凋亡来抑制AG细胞增殖,并且呈时间-剂量依赖性。
胰腺癌发展进程中广泛的代谢重编程与治疗抗性有密切关系,这种代谢复杂性使胰腺癌细胞在各种应激环境下通过线粒体呼吸获取能量,保持存活。而有关不同亚群的胰腺癌细胞的代谢异质性已有相关报道。非胰腺癌肿瘤干细胞是高度糖酵解依赖的,但胰腺癌肿瘤干细胞依赖于氧化磷酸化代谢 (oxidative phosphorylation,OXPHOS)[8]。因此,线粒体呼吸成为肿瘤治疗上的一个新兴靶点。本实验室前期多项研究结果表明,羧胺三唑能够抑制多种肿瘤细胞的线粒体呼吸[9-10]。本研究继续探究CTO对胰腺癌吉西他滨耐药细胞线粒体呼吸的作用,结果显示CTO能够降低AG细胞OCR、基础呼吸值、最大呼吸值和剩余呼吸能力,并且能够呈剂量依赖性地增加胞内NADH的含量,降低NAD+/NADH比值,提示CTO能够影响AG细胞线粒体电子传递链(electron transport chain,ETC)复合物I对NADH的利用,造成细胞内NADH蓄积抑制线粒体功能。已有文献报道,在卵巢癌中对顺铂产生多药耐药性的肿瘤细胞有更高的自噬水平,自噬一定程度上也维持肿瘤细胞耐药性[11]。自噬与线粒体功能密切相关,在关于炎性反应的研究中表明线粒体功能障碍能够诱发细胞自噬水平降低,从而加速细胞凋亡和坏死[12]。为了探究CTO作用之后线粒体功能障碍对AG细胞自噬水平的影响,通过Western blot实验验证CTO作用之后LC3-Ⅱ、P62在AG细胞中表达减少,提示CTO对AG细胞的自噬水平也有影响。
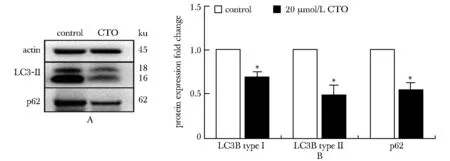
A.expression of LC3-Ⅱ,P62 proteins by Western blot; B.bar graph of LC3-Ⅱ, P62 proteins expression; *P<0.05 compared with control group
综上所述,本研究初步证实CTO通过破坏线粒体呼吸功能造成胞内NADH蓄积,减缓AG细胞分裂速率诱导AG细胞凋亡,降低自噬相关蛋白表达从而抑制AG增殖细胞。本研究为进一步探索在胰腺癌耐吉西他滨治疗方法提供实验依据,但同时也存在一定的局限性。自噬与肿瘤细胞的增殖有密切关系,本文关于CTO对AG细胞自噬的影响探讨较浅,将会在日后进一步完善自噬与AG耐药性及CTO减少AG自噬相关蛋白表达的机制探索。

