酸黄皮细菌群落研究及基因功能预测
熊英梅,魏冰倩,张 彦,熊建文,郭 壮,王玉荣*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.湖北文理学院 乳酸菌生物技术与工程襄阳市重点实验室,湖北 襄阳 441053;3.安琪酵母股份有限公司,湖北 宜昌 443003;4.柳州工学院 柳州市螺蛳粉植物源性配料研究重点实验室,广西 柳州 545616)
山黄皮(Clausena dentata(Willd.)Roem)别名鸡皮果、野黄皮,为芸香科的多年生南亚热带“药食同源”水果,主要分布在广西、云南南部和越南北部等地区[1]。山黄皮富含氨基酸、维生素和矿物质,药用价值较高,具有助食消暑、祛痰化气、消风肿和止痛等多种功效[2-3]。此外,山黄皮果实中还含有挥发油和黄酮,具有抑菌、抗氧化等功效[4-6]。成熟的山黄皮可鲜食,亦可干制或腌制成果干果脯,目前,亦有研究人员尝试将其开发成果酱、乳酸菌饮料等[7-8]。
南宁市位于广西壮族自治区南部偏西,与越南毗邻,地处亚热带,具有丰富的野生植物类群,是一个以壮族为主体的多民族聚居地,当地人民常把口感好且保健价值高的野生植物作为腌制品的原材料,制成特色的腌制酸食,酸黄皮即为当地的特色食品之一[9-10]。家庭自制的酸黄皮多以成熟山黄皮为主要原料,经去叶清洗、蒸熟去核后放凉,采用一层果肉一层盐或糖的方法放入洗净的玻璃瓶中,于阴凉处密封腌制一个月以上制成[11]。当地人常在肉类加工时加入腌制山黄皮,用于去腥提鲜,或是直接泡水饮用。酸黄皮在广西等地食用历史久远,受众范围较广,但目前有关酸黄皮制品的研究较少且主要集中在腌制成品的分析检测部分,对于酸黄皮细菌群落的研究鲜见报道。
本研究采用Illumina MiSeq高通量测序技术对采自广西壮族自治区南宁市的8份酸黄皮样品的细菌菌群结构进行解析,并进一步使用BugBase网站和PICRUSt软件预测酸黄皮样品的细菌基因功能,以期为发掘菌种资源、提高其食用安全性和经济效益提供部分参考。
1 材料与方法
1.1 材料与试剂
酸黄皮样品:于2019年7月中旬采自广西壮族自治区南宁市(E 107°45′~108°51′,N 22°13′~23°32′)五里亭农贸市场、琅西菜市场和淡村菜市场,共采集8份,编号为SHP1~SHP8。所用样本原料来源于当地,均为自然发酵形成,腌制时间均在一个月左右。每个样品采集100 g左右,放于一次性密封袋中低温运回实验室。
DNeasymericonFoodKit:德国QIAGEN公司;338F/806R双向引物:武汉天一辉远生物科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(酶活5 U/μL)、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)Mix(2.5 mmol/L)、rTaq酶(酶活5 U/μL)、DL 2 000 Marker、10×聚合酶链式反应(polymerase chain reaction,PCR)缓冲液:宝生物工程(大连)有限公司;Illumina MiSeq测序配套试剂:美国Illumina公司。
1.2 仪器与设备
MiSeq PE250高通量测序平台:美国Illumina公司;R920机架式服务器:美国DELL公司;Veriti FAST梯度PCR仪:美国ABI公司;164-5050基础电泳仪:美国Bio-Rad公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司。
1.3 方法
1.3.1 DNA的提取、扩增及测序
使用QIAGEN Dneasy mericon Food Kit提取酸黄皮样品的宏基因组DNA,以其为模板,参考QIU Z C等[12]的方法对16S rRNA V3-V4区基因序列进行PCR扩增,使用1.0%琼脂糖凝胶电泳对PCR扩增产物进行检测,并将检验合格的PCR扩增产物交由上海美吉生物医药科技有限公司进行Illumina MiSeq高通量测序。
1.3.2 生物信息学分析及可视化
参考郭壮等[13]的方法去除序列中的核苷酸标签与引物,使用QIIME分析平台[14]进行PyNAST对齐[15],依据100%和97%两步UCLUST对序列进行划分得到各操作分类单元(operational taxonomic units,OTU)[16],利用ChimeraSlayer去除含有嵌合体的OTU[17],比对序列明确其分类学地位[18]。使用FastTree软件构建核心OTU的系统发育树[19],然后使用BugBase网站(https://bugbase.cs.umn.edu/)[20]和PICRUSt软件[21]对酸黄皮样品中微生物的基因功能进行预测,并参照蛋白质直系同源簇数据库(clusters of orthologous groups of proteins,COGs)注释细菌的基因功能[22]。本研究将在8份酸黄皮样品中均存在且平均相对含量>1.0%的细菌门、属和OTU定义为核心优势细菌门、属和OTU。
1.3.3 数据处理
使用R软件的corrplot和waterfall包进行数据的分析和绘图。
2 结果与分析
2.1 酸黄皮样品中细菌群落组成及优势菌属相关性分析
纳入本研究的8份酸黄皮样品经Illumina MiSeq高通量测序后,共产生了362 818条高质量的16S rRNA序列,平均每个样品45 352条。通过UCLUST的100%相似性划分共得到了104 062个OTU,根据97%相似性划分共得到了6 342个OTU,平均每个样品包含793个OTU。本研究进一步对序列进行比对,发现酸黄皮样品中共存在22个细菌门和593个细菌属,其相对含量见图1。
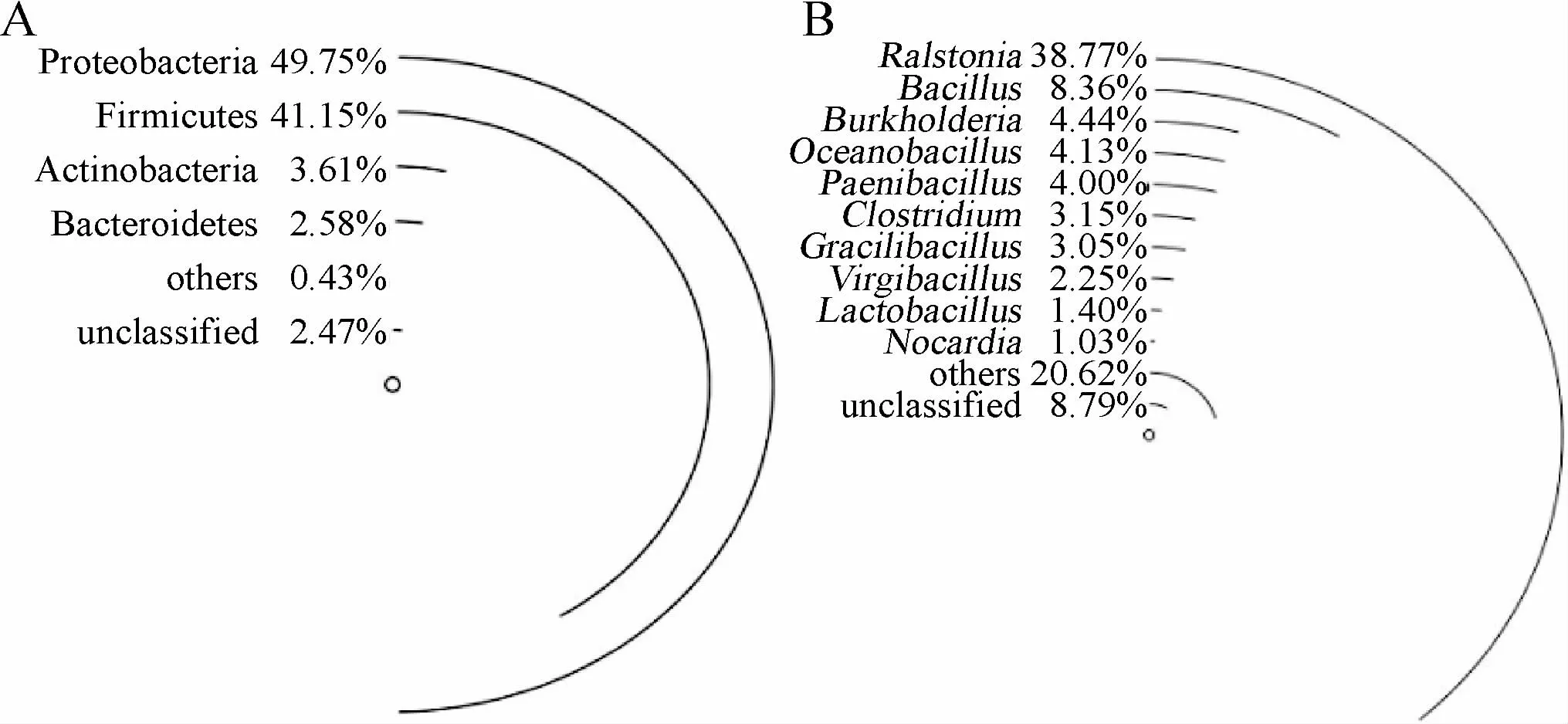
图1 酸黄皮样品中细菌门(A)和细菌属(B)的相对含量分析结果Fig.1 Analysis results of relative contents of bacteria phyla (A) and bacteria genera (B) in acidic Randia cochinchinensis samples
由图1可知,酸黄皮样品中的核心优势细菌门有4个,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),平均相对含量分别为49.75%、41.15%、3.61%和2.58%;核心优势细菌属有10个,分别为隶属于Firmicutes的芽孢杆菌属(Bacillus)、大洋芽孢杆菌属(Oceanobacillus)、类芽孢杆菌属(Paenibacillus)、梭菌属(Clostridium)、纤细芽孢杆菌属(Gracilibacillus)、枝芽孢菌属(Virgibacillus)和乳杆菌属(Lactobacillus),隶属于Proteobacteria的罗尔斯通氏菌属(Ralstonia)和伯克氏菌属(Burkholderia),隶属于Bacter-oidetes的诺卡氏菌属(Nocardia),平均相对含量分别为8.36%、4.13%、4.00%、3.15%、3.05%、2.25%、1.4%、38.77%、4.44%和1.03%。周金沙等[23]亦使用Illumina MiSeq高通量测序技术和生物信息统计与分析,探索了同为广西地区的无盐发酵酸笋样品中的细菌菌群结构及多样性,结果发现Firmicutes、Proteobacteria 和Actinobacteria为其优势细菌门,这与本研究结果类似,造成这种现象的原因可能与采集地区有关[24]。有研究指出Burkholderia的部分菌可引起肺炎的传播[25],而在纳入本研究的酸黄皮样本中均检测出Burkholderia,由此可见,解析酸黄皮中菌群组成可为提高食用安全性提供指导。
为进一步探究酸黄皮样品中各菌属间的影响,本研究使用皮尔森相关性系数判定各核心优势细菌属间的关联性,结果见图2。
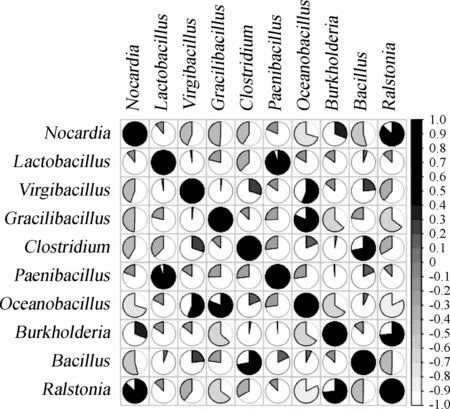
图2 酸黄皮样品中核心优势细菌属的相关性分析结果Fig.2 Correlation analysis results of core dominant genera in acidic Randia cochinchinensis samples
由图2可知,在10个核心优势细菌属中Ralstonia与Nocardia、Burkholderia呈显著的正相关(P<0.05),与Oceanobacillus呈显著的负相关(P<0.05);Bacillus与Clostridium、Oceanobacillus与Gracilibacillus呈显著正相关(P<0.05);Paenibacillus与Lactobacillus呈极显著的正相关(P<0.01),其余各核心优势细菌属间相关性不显著(P>0.05)。结果表明,多数核心优势菌属间正相关关系明显,表明酸黄皮样品中多数细菌呈正向相互调节机制,这也是形成广西酸黄皮特殊风味的基础。
2.2 基于OTU水平的细菌群落结构分析
为了解各酸黄皮样品中优势细菌菌群的差异,本研究对酸黄皮样本中OTU的出现频率及核心优势OTU的平均相对含量进行了分析,结果见图3。
由图3可知,纳入本研究的酸黄皮样品中共产生了6 342个OTU,其中仅出现一次的OTU有2 964个,占OTU总数的46.74%,拥有的序列数为18 755条,占总序列数的5.35%,而在8份酸黄皮样品中均存在的OTU数为145个,占OTU总数的2.29%,拥有的序列数为232 593条,占总序列数的66.36%。由图3亦可知,8个核心优势OTU分别隶属于Proteobacteria的Ralstonia(OTU5087)和Burkholderia(OTU10290),隶属于Firmicutes的Paenibacillus(OTU13645)、Bacillus(OTU15510)、Oceanobacillus(OTU15314)、Gracilibacillus(OTU2400)和Clostridium(OTU9917),隶属于Acti nobacteria的Nocardia(OTU4677),平均相对含量分别为37.36%、3.15%、2.60%、2.24%、1.33%、1.51%、1.08%和1.02%。结合酸黄皮样品中的核心优势细菌属分析,发现Virgibacillus和Lactobacillus虽为酸黄皮样品的核心细菌属,但两者在共有OTU中的相对含量均<1.0%。由此可见,在酸黄皮样品中存在大量的核心菌群,同时,由于开放式制作与发酵,不同样品中亦存在独特的细菌类群。
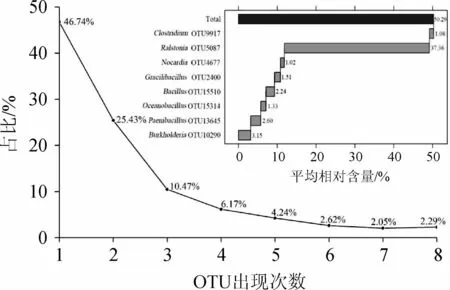
图3 酸黄皮样品中OTU出现次数及核心优势OTU平均相对含量分析结果Fig.3 Analysis results of OTU occurrence times and average relative contents of core dominant OTU in acidic Randia cochinchinensis samples
本研究进一步根据核心优势OTU的序列构建系统发育树,结果见图4。

图4 酸黄皮样品中核心OTU的系统发育树Fig.4 Phylogenetic tree of core OTU in acidic Randia cochinchinensis samples
由图4可知,OTU15314与索氏海洋杆菌(Oceanobacillus sojae)在同一分枝,OTU2400与Gracilibacillus massiliensis聚为一类,OTU15510与阿氏芽孢杆菌(Bacillus aryabhattai)亲缘关系较近,OTU13645与Paenibacillus xylanexedens聚为一类,OTU9917与糖丁基梭菌(Clostridium saccharobutylicum)聚为一类,OTU4677与产腔诺卡氏菌(Nocardia coeliaca)聚为一类,OTU5087与Ralstonia syzygii聚为一类,OTU10290与Burkholderia insulsa聚为一类。由此可见,在8个核心优势OTU中有50%被鉴定为芽孢杆菌,芽孢杆菌产生的抗菌物质具有广谱杀菌活性,对食品中多种革兰氏阴性菌和阳性菌均有较强的杀菌作用,可用于防止食品发酵过程中受到杂菌的污染,大量研究人员筛选对植物病原微生物、食源性病原微生物和腐败微生物具有拮抗作用的芽孢杆菌,用作功能性食品的发酵剂,具有较好的市场前景[26]。
2.3 酸黄皮样品中细菌序列基因潜在功能分析
使用PICRUSt软件对酸黄皮样品中细菌菌群的基因功能进行预测,发现所有序列共注释到隶属于23个功能大类的4 354个COG,本研究进一步对广西酸山黄皮中细菌序列潜在基因功能进行分析,结果见图5。
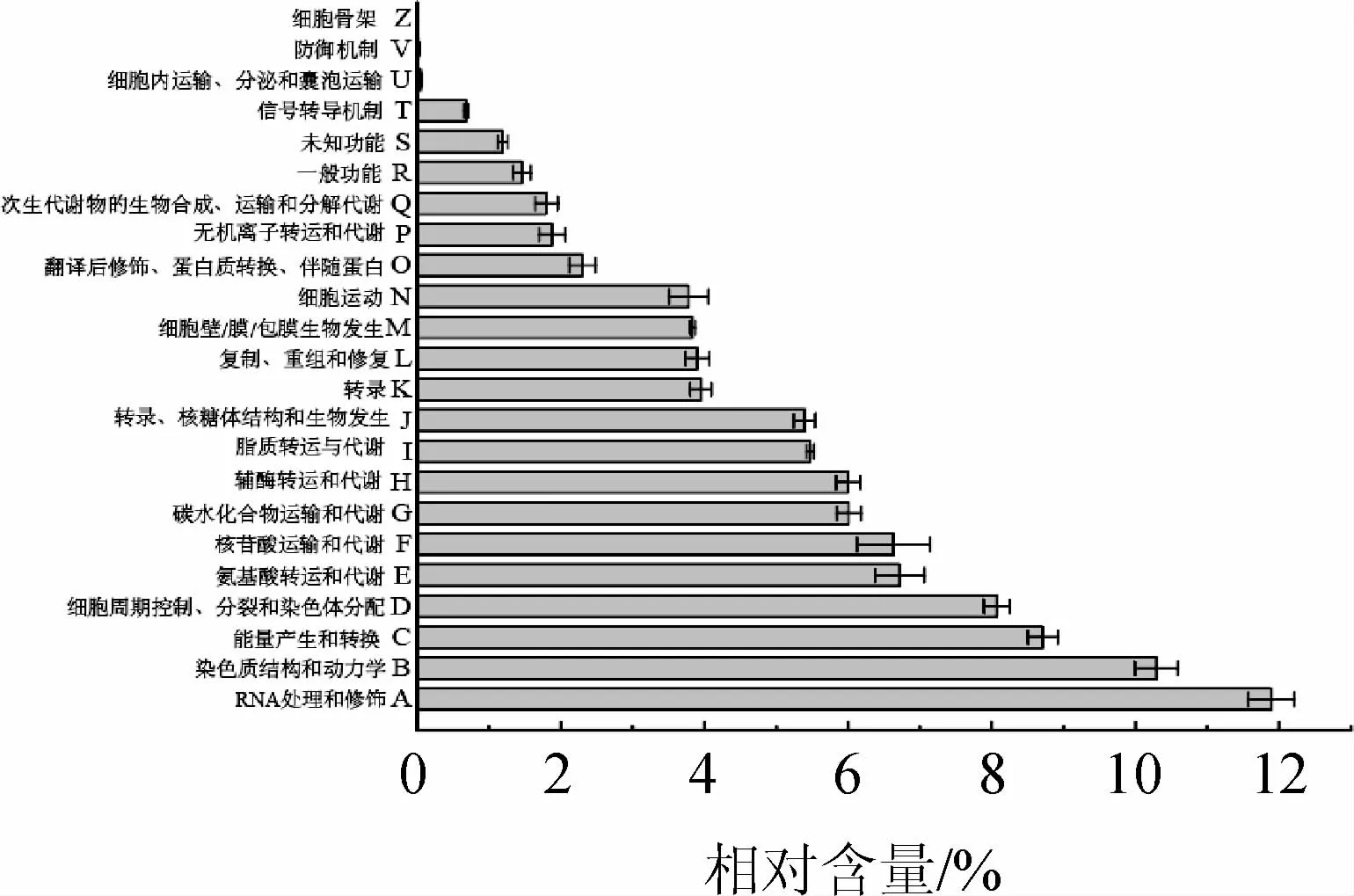
图5 酸黄皮样本细菌序列中的潜在功能基因及其相对含量分析结果Fig.5 Analysis results of potential functional genes and their relative contents in bacterial sequences of acidic Randia cochinchinensis samples
由图5可知,酸黄皮样品中细菌序列除具有较强的维持细胞生命活动的基本功能外,氨基酸转运与代谢功能、碳水化合物运输和代谢功能以及脂质转运与代谢方面潜在功能占比相对较高,平均相对含量分别为8.71%、6.63%和3.78%。杨益林等[27]研究发现,山黄皮含有丰富的天冬氨酸、γ-氨基丁酸和丙氨酸等氨基酸,其中人体必需氨基酸的含量占游离氨基酸总量的3.46%,占水解氨基酸总量的12.75%,这可能是造成酸黄皮样品中细菌氨基酸转运和代谢功能较强的原因。依据味感,氨基酸可分为酸味、甜味、苦味和鲜味氨基酸,其代谢物可作为食品风味的前体物[28-29],酸黄皮中与氨基酸转运及代谢有关细菌序列占比较多,可促进成品风味形成。
3 结论
酸黄皮中细菌群落组成复杂,本研究从8份样本中共检测出隶属于22个细菌门的593个属,4个核心优势细菌门分别为变形菌门(Proteobacteria)(49.75%)、硬壁菌门(Firmicutes)(41.15%)、放线菌门(Actinobacteria)(3.61%)和拟杆菌门(Bacteroidetes)(2.58%);10个核心优势细菌属分别为罗尔斯通氏菌属(Ralstonia)(38.77%)、芽孢杆菌属(Bacillus)(8.36%)、伯克氏菌属(Burkholderia)(4.44%)、大洋芽孢杆菌属(Oceanobacillus)(4.13%)、类芽孢杆菌属(Paenibacillus)(4.00%)、梭菌属(Clostridium)(3.15%)、纤细芽孢杆菌属(Gracilibacillus)(3.05%)、枝芽孢菌属(Virgibacillus)(2.25%)、乳杆菌属(Lactobacillus)(1.40%)和诺卡氏菌属(Nocardia)(1.03%),多数核心优势菌属间正相关关系显著,呈正向相互调节机制。酸黄皮中细菌序列除具有较强的维持细胞生命活动的基本功能外,氨基酸转运与代谢功能、碳水化合物运输和代谢功能以及脂质转运与代谢方面潜在功能占比相对较高。

