miR-22-5P靶向调控相关信号通路对毛囊干细胞增殖和分化的影响
严其高 祁冰洁 刘慧娟 刘金林 刘 毅
安庆医药高等专科学校,安徽安庆 246052
迄今为止,毛囊再生的机制尚未完全阐明,“隆突激活学说”认为,休止期末的毛乳头紧邻毛囊干细胞并向其释放激活信号,毛囊干细胞激活而启动后,毛囊由休止期进入生长期[1]。毛囊干细胞具有较强的自我更新和多向分化潜能,可以形成毛囊,也可以参与到表皮的更新过程中,对于毛囊的周期性生长、毛囊再生、皮肤伤口修复均具有重要作用[2]。由此可见,关于毛囊干细胞增殖、迁移、分化的研究是探讨毛囊周期性发育调控的基础。微小核糖核酸(MicroRNA,miRNA)通过结合靶基因3'UTR 区域并发挥降解信使(mRNA)作用,同时抑制翻译进程,从而调控靶基因表达的非编码miRNA[3]。以往研究毛囊干细胞增殖分化过程的文献,主要通过单一“转录组”进行相关研究,关于miRNA与mRNA之间相互关系的研究较少,关于调节毛囊干细胞增殖分化的miRNA 以及探讨miRNA在毛囊干细胞增殖分化过程中相关分子机制的研究均较少。因此本研究探讨miR-22-5P对毛囊干细胞增殖和分化的影响,并通过检测相关信号通路的关键蛋白,分析在毛囊干细胞周期循环中miR-22-5P的作用机理。
1 材料与方法
1.1 材料
细胞:来自于内蒙古自治区生物制造重点实验室分离纯化的内蒙古绒山羊毛囊干细胞所建立的P3代绒山羊毛囊干细胞系。
试剂:高糖DMEM培养基、10%胎牛血清、胰蛋白酶购于美国Gibco 公司;CCK8、EdU、细胞周期检测试剂盒购于上海生工有限公司;定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)检测试剂盒购于美国Thermo Fisher 公司;Western blot检测所用抗体及相关试剂盒均购于美国Bioworld公司。
仪器:PCR仪、酶标仪、超净工作台、CO2恒温培养箱为美国Thermo 公司生产;冷冻离心机、高速离心机、PCR 基因扩增仪为美国BD bioscience 公司生产;电泳仪、核酸定量仪为美国Bio-Rad 公司生产。凝胶成像系统为美国Bio-Rad公司产品。荧光显微镜、倒置显微镜为美国AMG公司生产。
1.2 细胞处理及分组
将P3 代毛囊干细胞置于37 ℃、5%CO2细胞培养箱中,当细胞生长到60% ~ 70%汇合时,应用0.25%胰蛋白酶将细胞消化为单细胞悬液,加入24 孔板中,每孔1 × 104个细胞接种。置于37 ℃、5% CO2细胞培养箱中培养,当细胞生长贴壁后进行分组。分为空白对照组、空白转染组、miR-22-5P转染组。空白对照组未作处理;空白转染组使用miR-NC 转 染;miR-22-5P 转 染 组 使 用miR-22-5P mimics进行转染。具体转染步骤如下:将接种于24孔板中的毛囊干细胞加入配置好的转染剂,于37 ℃、5% CO2条件下培养6 h。吸出转染试剂后,RPMI 1640细胞培养液继续培养48 h。
1.3 方法
1.3.1 CCK8 检测毛囊干细胞增殖活性 收集各组对数生长期毛囊干细胞,将1×104个细胞接种于96孔板中,分别于接种后24 h向各孔中加入CCK-8溶液,37 ℃培养24 h,振荡混匀,酶标仪上读取450 nm波长处吸光光度值(optical density,OD)。根据以下公式计算细胞活力值。实验重复3次。
细胞活力(%)=[A(处理组)-A(空白组)]/[A(未处理组)-A(空白组)]×100%。
1.3.2 EdU 实验检测毛囊干细胞增殖情况 收集各组对数生长期毛囊干细胞,接种至24 孔板中,去除培养基后,经4%多聚甲醛固定15 min,0.3%TritonX-100 作用15 min,加入EdU 检测试剂盒中的反应液,37 ℃避光孵育30 min,复染后,荧光显微镜拍照。经Image J软件进行细胞计数,通过计算EdU阳性细胞比值分析细胞增殖情况。实验重复3次。
1.3.3 流式细胞法进行细胞周期检测 收集各组对数生长期毛囊干细胞,按照细胞周期检测试剂盒步骤进行处理,经流式细胞仪检测各组细胞所处周期情况。实验重复3次。
1.3.4 qPCR法检测细胞增殖及分化标志物mRNA水平 以β-actin作为内参基因,采用qPCR 法检测各组细胞中的细胞增殖标志物(KI67、PCNA)、细胞增殖经典通路标志物(AKT、mTOR)、细胞分化标志物(K6、S100A3)、细胞分化经典通路标志物(Notch1、β-catenin)的mRNA水平。实验重复3次。
按照Trizol 试剂盒中说明书的步骤提取总RNA,标记后进行芯片杂交,选取芯片结果中KI67、PCNA、AKT、mTOR、K6、S100A3、Notch1、β-catenin进行荧光定量PCR 分析。应用反转录试剂盒合成环状DNA,反应条件:变性(95 ℃,10 s)→退火(60 ℃,20 s)→延伸(70 ℃,10 s),共计40 个循环。引物的设计与合成来自生工生物工程(上海)股份有限公司,各基因的引物序列见表1。2-△△Ct法计算KI67、PCNA、AKT、mTOR、K6、S100A3、Notch1、β-catenin的相对表达量。

表1 扩增基因及引物序列
1.3.5 Western blot检测细胞增殖及分化标志物蛋白水平 采用RIPA 裂解缓冲液提取细胞或组织蛋白,BCA法检测蛋白浓度,取上样缓冲液与样品混合并置于95 ℃变性l0 min。蛋白样品以每孔50µg加到10%SDS-PAGE中电泳分离蛋白,将蛋白转到PVDF膜上后,5%脱脂奶粉封闭2 h。将抗体(1∶1 000)加入至PVDF膜,β-actin为内参。4 ℃过夜。弃一抗,加入1∶1 000 稀释的辣根过氧化物酶标记二抗,室温孵育1 h。弃二抗。ECL 化学发光剂显色,暗室下显影。
1.4 统计学分析
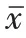
2 结 果
2.1 CCK8实验检测各组毛囊干细胞增殖情况
CCK8实验检测结果显示,miR-22-5P mimics 转染毛囊干细胞后,细胞增殖能力明显减弱,miR-22-5P转染组的细胞活力值明显低于空白对照组、空白转染组,差异有统计学意义(P<0.05)。说明上调miR-22-5P对毛囊干细胞具有增殖抑制作用。见表2。
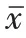
表2 CCK8实验检测过表达miR-22-5P对毛囊干细胞增殖的影响(±s)
2.2 EdU实验检测各组毛囊干细胞增殖情况
EdU 实验检测结果显示,miR-22-5P mimics 转染毛囊干细胞后,细胞增殖能力明显减弱,miR-22-5P转染组的细胞增殖比明显低于对照组,差异有统计学意义(P<0.05)。说明上调miR-22-5P 对毛囊干细胞具有增殖抑制作用。见表3。
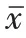
表3 EdU实验检测过表达miR-22-5P对毛囊干细胞增殖的影响(±s)
2.3 流式细胞法检测各组毛囊干细胞所处周期分布情况
经流式细胞仪检测各组毛囊干细胞所处周期分布情况,见表4。miR-22-5P转染后,处于S期的毛囊干细胞比例较空白对照组、空白转染组明显减少,差异有统计学意义(P<0.05);处于G0~G1期的毛囊干细胞比例较空白对照组、空白转染组明显增加(P<0.05)。结果表明,过表达miR-22-5P 能够使毛囊干细胞阻滞于G0~G1期。
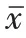
表4 流式细胞法检测各组毛囊干细胞所处周期分布情况(±s,%)
2.4 qPCR 法检测各组增殖相关基因mRNA 表达水平
miR-22-5P 转染毛囊干细胞后,KI67、PCNA、AKT的mRNA 表达水平均显著低于空白对照组、空白转染组,差异有统计学意义(P<0.05)。各组毛囊干细胞中mTOR的mRNA 表达量基本相当,差异无统计学意义(P>0.05),详见表5。
表5 qPCR法检测各组增殖相关基因mRNA表达水平(±s)
2.5 Western blot检测各组增殖相关蛋白表达量
Western blot 实验检测毛囊干细胞增殖过程中相关蛋白的表达量,见图1。miR-22-5P 转染组KI67、PCNA、AKT 蛋白表达量明显低于空白对照组、空白转染组,表明miR-22-5P 能够激活AKT 通路,对毛囊干细胞的增殖发挥抑制作用。
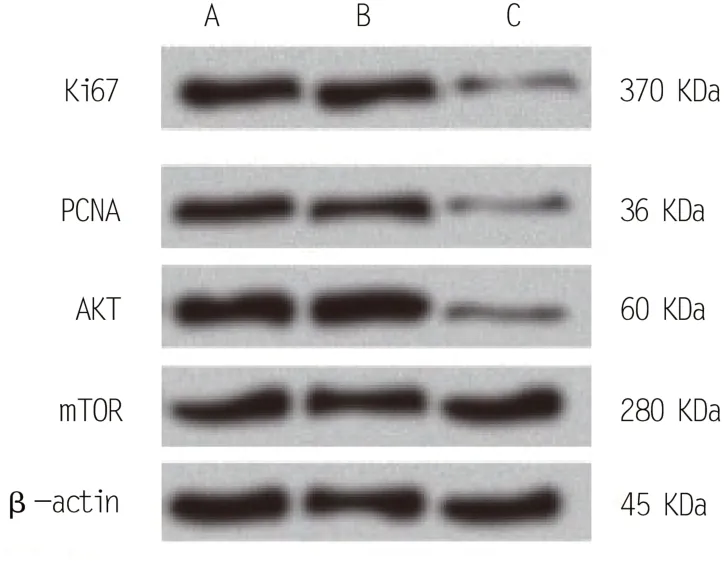
A:空白对照组;B:空白转染组;C:miR-22-5P转染组
2.6 qPCR 法检测各组细胞分化标志物mRNA 表达水平
如表6 所示,miR-22-5P 转染毛囊干细胞后,K6、S100A3、Notch1的mRNA 表达水平均显著高于空白对照组、空白转染组,差异有统计学意义(P<0.05)。各组毛囊干细胞中β-catenin的mRNA 表达量基本相当,差异无统计学意义(P>0.05)。
表6 qPCR法检测各组细胞分化标志物mRNA表达水平(±s)
2.7 Western blot检测各组分化相关蛋白表达量
Western blot 实验检测毛囊干细胞分化过程中相关蛋白的表达量,见图2。miR-22-5P 转染组K6、S100A3、Notch 蛋白表达量明显高于空白对照组、空白转染组,差异有统计学意义(P<0.05),表明miR-22-5P 能够激活Notch 通路,诱导毛囊干细胞向毛囊分化。
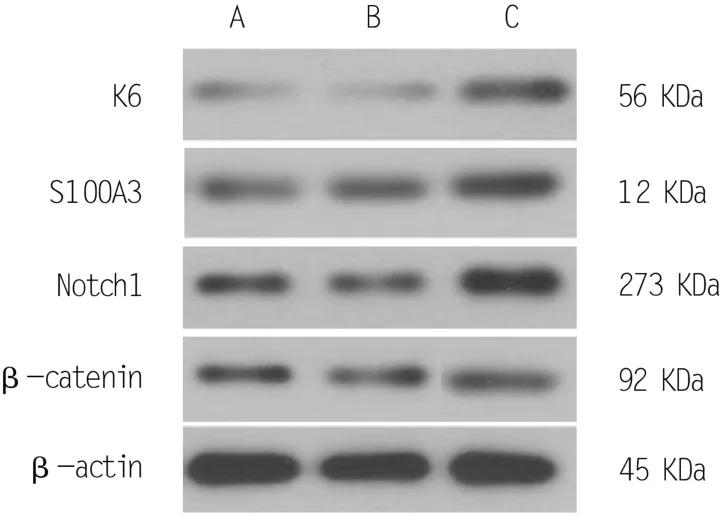
A:空白对照组;B:空白转染组;C:miR-22-5P转染组
3 讨 论
有研究通过联合分析绒山羊毛囊各个时期miRNA和mRNA的数据,对调控毛囊周期性生长的关键miRNA 进行了筛选,发现miR-1、miR-182、miR-151-3p、miR-143-3p 对毛囊干细胞的增殖分化发挥重要调控作用[4-7]。miR-22-5P是近年来发现的与毛囊干细胞预测靶基因之间存在靶向关系的miRNA,前期有研究对miR-22-5P 的靶向基因进行了预测,结果发现LEF1、Dlx3、Foxn1、Sostdc1等在毛囊的分化过程中发挥重要作用[8-9]。且有研究发现,miR-22-5P 伴随毛囊的周期变化表达量明显改变[10],以上均说明miR-22-5P 在毛囊周期变化中具有潜在的作用,能够促进毛囊从生长期到退行期的转变。因此本研究选取miR-22-5P作为研究毛囊干细胞增殖分化调控机制的靶点。
本研究通过CCK8 实验、EdU 实验分析了miR-22-5P对毛囊干细胞增殖的影响,结果证实,miR-22-5P mimics转染毛囊干细胞后,细胞增殖能力明显减弱,说明上调miR-22-5P 对毛囊干细胞具有增殖抑制作用。流式细胞法检测了miR-22-5P对毛囊干细胞所处周期分布的影响,数据显示,转染miR-22-5P后,处于S 期的毛囊干细胞比例较对照组明显减少(P<0.05);处于G0~G1期的毛囊干细胞比例较对照组明显增加(P<0.05)。以上结果表明,过表达miR-22-5P 能够使毛囊干细胞阻滞于G0 ~ G1 期。进一步证实了miR-22-5P促进毛囊干细胞细胞周期停止,阻止细胞增殖的生物学作用。PI3K/AKT/mTOR 信号通路是调节细胞周期的重要通路[11];而Wnt/β-catenin 和Notch1 通路是促进毛囊干细胞分化过程的经典通路[12]。本研究通过分析各组增殖标志物(KI67 和PCNA)、增殖相关通路(AKT/mTOR)在mRNA 和蛋白水平的表达,证实了miR-22-5P 能够激活AKT 通路,对毛囊干细胞的增殖发挥抑制作用。通过分析各组分化标志物(K6、S100A3)、分化相关通路基因(Notch1 和β-catenin)在mRNA 和蛋白水平的表达,证实了miR-22-5P 能够激活Notch通路,诱导毛囊干细胞向毛囊分化。
综上所述,本研究通过多种方法检测了miR-22-5P 对绒山羊毛囊干细胞增殖和分化的影响,发现miR-22-5P的表达增加能够对毛囊干细胞发挥增殖抑制作用,且可通过激活相关信号通路促进毛囊干细胞向毛囊分化。在后续的研究中,将利用生物学信息分析手段筛选出影响毛囊干细胞增殖和分化的其他miRNA和关键基因,进一步阐明毛囊干细胞增殖分化调控的相关机制和调节靶点。
利益冲突 所有作者均声明不存在利益冲突

