大黄浸膏的HPLC指纹图谱研究
范 珊 赵新红 张作华 齐永秀
山东第一医科大学(山东省医学科学院)药学院,山东泰安 271016
大黄浸膏是一种棕色至棕褐色粉末,将大黄通过回流提取、浓缩、干燥等步骤制备大黄浸膏,方法简单,便于操作。大黄是目前临床常用的中药材,也是比较常见的草本植物,在我国分布较广泛[1],药用价值较高。大黄具有调血脉,利关节,除痰湿,利大小肠的功效。目前对大黄的化学组成、含量测定以及药理作用的研究都比较深入和广泛。国内外的研究表明蒽醌类、双蒽酮类、芪苷类、鞣质类化合物为大黄的主要成分。研究表明大黄的药理作用主要与其所含的蒽醌类成分有关[2-3]。大黄中的有效成分具有较强的泻下作用,并且会对离体小肠产生影响[4-6],同时还可以发挥抗病毒、抑菌、抗炎等作用。因此,目前国内外文献对大黄及其制剂的研究主要以蒽醌类成分作为质量控制指标[7-10]。大黄浸膏作为大黄药材的制剂之一,多种成药处方的组成成分都会使用大黄浸膏,因其作为提取物有效成分含量高于大黄药材,在临床上应用非常广泛。但是,目前国内外对于大黄浸膏的研究较少,中国药典对大黄浸膏的收载项目也较少,主要为含量测定和鉴别检查,没有完善的质量标准。中药指纹图谱作为中药应用较为广泛的质量评价模式之一,因其能够体现中药成分的整体性,所以在评价中药材的质量时应用广泛[11-15]。为了完善对大黄浸膏的研究,本实验采用高效液相色谱法(high-performance liquid chromatography,HPLC)测定大黄浸膏指纹图谱,结合相似度评价、聚类分析、主成分分析等方法进行分析[16],并采用外标法测定其主要活性成分(芦荟大黄素、大黄酸、大黄酚、大黄素、大黄素甲醚)含量,为大黄浸膏的质量控制提供依据。
1 仪器与材料
1.1 仪器
Waters e2695 型高效液相色谱仪,Waters 2998PDA 紫外检测器,Empower 色谱工作站(美国Waters 公司);KQ-500E 型医用超声波清洗器(昆山市超声仪器有限公司);FR224CN型电子天平(奥豪斯仪器上海有限公司)。
1.2 材料和试剂
色谱纯甲醇为安徽天地高纯溶剂有限公司产品;分析纯甲醇为天津市凯通化学试剂有限公司产品;冰醋酸为天津市凯通化学试剂有限公司产品;娃哈哈饮用纯净水为杭州娃哈哈集团有限公司产品。芦荟大黄素(批号:T28D6F8264,纯度:≥97%)、大黄素甲醚(批号:TAO421FA14,纯度:≥98%)对照品(上海源叶生物科技有限公司);大黄酸(批号:0757-200206)、大黄素(批号:110756-200110)对照品(中国药品生物制品检定所);大黄酚(批号:09T18,纯度:≥98%)对照品(西玛实验室);大黄药材购自药店;大黄浸膏为实验室自提,见表1。
2 方法与结果
2.1 色谱条件
Thermo C18(4.9 mm × 250 mm,5 µm)色谱柱;流动相0.1%磷酸水溶液(A)-甲醇(B);梯度洗脱(0 ~ 90 min,95% ~ 0% A);流速1 mL/min;进样量10µL;检测波长280 nm;柱温30 ℃。
2.2 溶液的制备
2.2.1 大黄浸膏粉的制备 取大黄,磨粉,取20 g大黄粉浸渍30 min,用75%乙醇回流提取2 次(200 mL,160 mL),每次1 h,合并提取液,滤过,滤液减压回收乙醇至稠膏状,干燥,研细。
2.2.2 供试品溶液的制备 精密称取大黄浸膏粉0.5 g,加入甲醇25 mL,超声30 min,1 200 r/min 离心5 min,取上清液过0.45µm微孔滤膜,即得。
2.2.3 对照品溶液的制备 精密称取大黄素,大黄酚,芦荟大黄素,大黄素甲醚,大黄酸适量于10 mL 量瓶中,配置成浓度分别为280,180,200,180,180µg/mL的对照品储备液,4 ℃下保存。
2.3 指纹图谱研究及方法学考察
2.3.1 精密度实验 取S1号样品,按“2.3”项下制备方法制备供试品溶液,按“2.1”项下色谱条件连续进样5 次,记录色谱图,以大黄酚为参考峰,计算共有峰相对保留时间的相对标准偏差(relative standard deviation,RSD)值均小于0.33%,相对峰面积的RSD值均小于4.6%,表明仪器的精密度良好。2.3.2 重复性实验 取S1号样品供试品溶液5份,进样分析,记录色谱图,以大黄酚为参考峰,计算共有峰相对保留时间的RSD值均小于0.45%,相对峰面积的RSD值均小于5%,表明该方法重复性良好。2.3.3 稳定性实验 取S1 号样品的供试品溶液,按色谱条件,分别在0,3,6,9,24 h 进样,记录色谱图,以大黄酚为参考峰,计算各共有峰相对保留时间的RSD 值均小于2%,相对峰面积的RSD 值均小于4.6%,表明样品在24 h内稳定。
2.3.4 指纹图谱的分析 分别精密称取不同来源的大黄样品各0.5 g,按“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定其指纹图谱,将数据导入2009 版中国色谱指纹图谱相似度评价系统软件,经多点校正后生成大黄浸膏指纹图谱共有模式及对照指纹图谱,见图1 和图2。其中10 批大黄浸膏有16 个共有峰。通过比较共有峰紫外吸收光谱和对比对照品保留时间的方法(图3),确认1号峰为芦荟大黄素,2号峰为大黄酸,3号峰为大黄素,4号峰为大黄酚,5号峰为大黄素甲醚。其中4号峰大黄酚的峰面积较大且较稳定,故将其作为内参比峰。10批大黄浸膏以4号峰作为参照峰,计算各共有峰的相对保留时间及相对峰面积,结果表明各批次样品的相对保留时间RSD均小于1.3%,但相对峰面积RSD 21.10% ~ 221.67%范围内波动较大,表明不同批次间大黄浸膏的指纹图谱相似度具有差异性。

图1 10批大黄浸膏指纹图谱共有模式

图2 大黄浸膏的对照指纹图谱

1. 芦荟大黄素(aloe emodin);2. 大黄酸(rhein);3. 大黄素(emodin);4. 大黄酚(chrysophanol);5. 大黄素甲醚(physcion)
2.4 指纹图谱评价
2.4.1 相似度评价 以对照指纹图谱为参照,采用中药色谱指纹图谱相似度评价系统(2009版)软件计算10批样品的相似度(表2),将10批大黄浸膏指纹图谱与对照图谱进行相似度评价,结果显示10批大黄浸膏指纹图谱的相似度在0.691~0.984。

表2 10批大黄浸膏样品相似度
2.4.2 聚类分析 将10批大黄浸膏指纹图谱数据导入SPSS 25.0 软件进行聚类分析得到树状图,结果见图4。由图4 可见,10 批大黄浸膏大致可以划分为两类:S1,S2,S4,S5,S6,S7,S8,S9 为一类,S3,S10为一类。

图4 10批大黄浸膏的聚类分析树状图
2.4.3 主成分分析 以指纹图谱共有峰面积为变量,运用SPSS 25.0 软件对10 批大黄浸膏样品进行主成分分析。结果表明主成分有2 个,其中第一主成分特征值为7.293,方差贡献率为72.925%;第二主成分特征值为1.165,方差贡献率为11.646%,方差累计贡献率为84.571%。
2.5 外标法测定10批大黄浸膏指标成分含量
将10 批大黄浸膏样品,按照“2.2.2”项下方法制备供试品溶液,精密称取适量对照品储备液,制备混合对照品溶液,分别精密吸取混合对照品溶液和供试品溶液10 µL,按照“2.1”项下色谱条件进样,采用外标法对供试品中5 种指标成分进行含量测定,结果见表3。
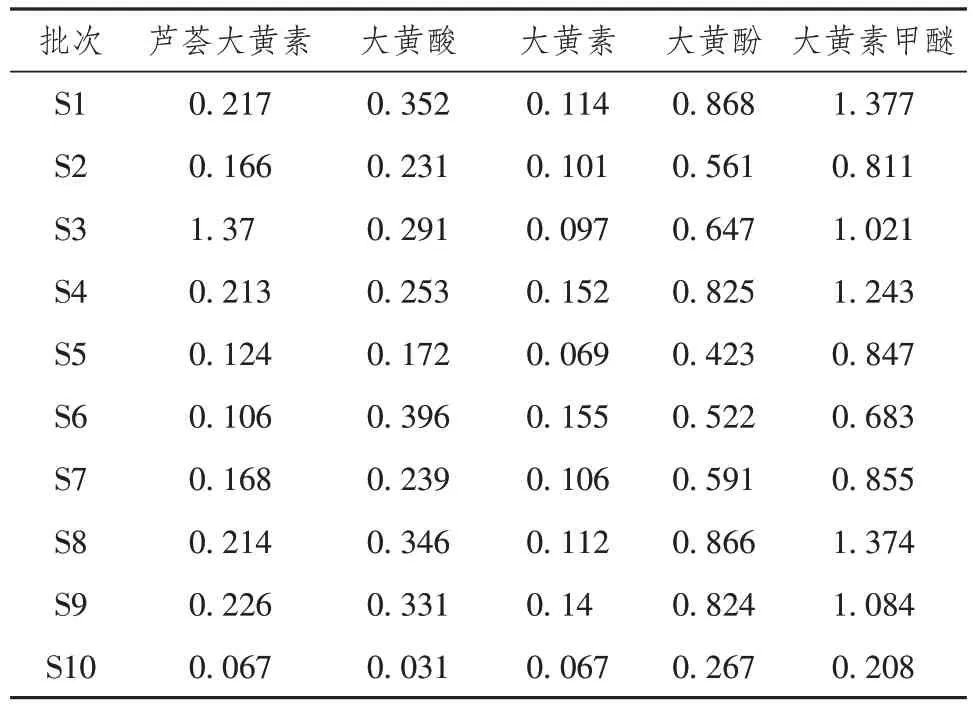
表3 样品含量测定(mg/g)
3 讨 论
本实验考察了甲醇-水,甲醇-0.1%磷酸水,甲醇-0.2%磷酸水,甲醇-0.4%冰醋酸水,乙腈-水,乙腈-0.1%磷酸等作为流动相进行梯度洗脱时的色谱图,结果表明当甲醇-0.1%磷酸水溶液作为流动相时可以达到基线平稳,分离度好且峰型良好,无拖尾。同时考察了相同洗脱条件下柱温30 ℃、35 ℃、40 ℃下的色谱图,结果表明30 ℃时色谱峰的峰型较好。同时比较了相同条件下254、280、329 nm 的色谱图,结果表明检测波长为280 nm 时色谱峰数量较多且分离度较好,最终确定本实验所用色谱条件为甲醇-0.1%磷酸水,柱温为30 ℃,检测波长为280 nm。
本研究采用HPLC 法建立了10 批大黄浸膏的指纹图谱,通过指纹图谱相似度软件共标定了16个共有峰,并且指认了其中5种主要活性成分,并结合相似度分析、聚类分析、主成分分析等方法更为准确和全面的对不同批次的大黄浸膏指纹图谱进行了深入分析,通过外标法测定了大黄浸膏中5 种活性成分的含量,结果表明不同批次间大黄浸膏的成分存在一定的差异。通过分析可知,不同批次的大黄浸膏的提取手段是一致的,产生这种差异的原因可能是由于大黄的产地或者栽培方式不同造成的,游离蒽醌成分是大黄清热解毒、抑菌消炎的主要成分,因此通过指纹图谱结合质量分析可以选择出不同蒽醌含量的药材,对大黄浸膏的应用提供了理论基础,评价了药材的批间差异,为不同批次大黄浸膏的质量评价提供参考。
利益冲突 所有作者均声明不存在利益冲突

