利用荧光偏振方法的IDOL/LDLR蛋白相互作用评价体系的建立
李霓,韩江雪,姜新海,许艳妮,司书毅
低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)是细胞表面型受体,在肝脏细胞中呈高表达,它通过胞吞作用将血浆中的 LDL-C转运至肝脏中进行代谢,从而降低血浆中 LDL-C水平,是治疗动脉粥样硬化(atherosclerosis,AS)疾病的重要靶点[1-2]。LDLR 的表达受到转录水平及转录后水平的调控,其转录水平主要受固醇调控元件结合蛋白-2(sterol regulatory element binding protein-2,SREBP-2)的调控[3];除此之外,LDLR的诱导型降解因子(inducible degrader of the LDL receptor,IDOL)和前蛋白转化酶枯草溶菌素 9(proprotein convertase subtilisin/kexin type 9,PCSK9)能够通过转录后水平对 LDLR 的表达进行调控[4-5]。
IDOL 是一个依赖于固醇调节的 E3 泛素连接酶,能够介导 LDLR 泛素化进而经溶酶体途径降解,主要受到肝 X 受体(liver X receptor,LXR)的调控,这与 PCSK9 对 LDLR 的降解机制有所不同[4,6]。IDOL 包含两个主要功能结构域,即 N端的 FERM 区和 C 端的 RING 区[7]。FERM 区负责与 LDLR 胞内部分相结合,RING 区与泛素结合酶 E2D(ubiquitin conjugating enzyme E2D,UBE2D)结合,随后 LDLR 被 UBE2D 泛素化修饰,最终导致 LDLR 在溶酶体降解[8]。研究表明,抑制 IDOL 对 LDLR 的降解将有效提高肝脏LDLR 表达,有利于减少血浆中 LDL-C 水平[9]。因此,抑制 IDOL/LDLR 蛋白相互作用是抗 AS 药物研发的新思路。有学者对 IDOL 与 LDLR 的相互作用以及降解机制进行了透彻的研究,并通过同源模建、染色质免疫共沉淀等手段确证了两个蛋白的结合界面[10]。荧光偏振(fluorescence polarization,FP)技术具有简便、高效、重复性好的优势,是体外水平研究蛋白质相互作用的重要方法[11]。
本实验通过原核表达并纯化获得人全长 IDOL重组蛋白,将能够与 IDOL-FERM 区相结合的LDLR 多肽片段进行异硫氰酸荧光素(fluorescence isothiocyanate,FITC)荧光标记,利用荧光偏振方法,建立体外 IDOL/LDLR 的蛋白相互作用体系,确定 IDOL 与 LDLR 作用区域,探索最适条件,为基于 IDOL/LDLR 相互作用的抗 AS 小分子抑制剂的开发和评价提供新的策略。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 pET-30a(+) 原核表达质粒购自美国 Novagen 公司;pCMV3-IDOL 商品化质粒购自义翘神州公司;大肠杆菌E. coliDH5α 克隆感受态细胞和E. coliTransetta(DE3) 表达感受态细胞购自北京全式金公司。
1.1.2 试剂 DNA marker、胶回收试剂盒和质粒小提试剂盒均购自北京全式金公司;DNA 连接酶购自美国 Promega 公司;限制性内切酶购自日本Takara 公司;DNA 聚合酶 2 × Es Taq MasterMix购自康为世纪公司;BCA 蛋白浓度测定试剂盒购自美国 ThermoFisher 公司;胰蛋白胨、酵母提取物和琼脂粉均购自英国 Oxoid 公司;硫酸卡那霉素和异丙基 β-D-硫代半乳糖苷(IPTG)购自美国Amresco 公司;HisTrap 层析柱购自美国 GE 公司;384 孔不透明黑色检测板购自美国 Corning 公司;其他生化试剂为国产分析纯。
1.1.3 主要仪器 AKTA explorer 型蛋白层析系统为美国 GE Health 公司产品;3-18K 型高速冷冻离心机为美国 Sigma 公司产品;TS 型高压细胞破碎仪为北京康坦科技有限公司产品;EnVision 2104型酶标仪为美国 PerkinElmer 公司产品。
1.2 方法
1.2.1 引物设计及合成 在 NCBI 数据库中查得IDOL(NM_013262.3)基因全长为 1338 bp,共编码 445 个氨基酸,蛋白分子量约为 50 kD。根据其编码序列设计引物,上游:5' CGGGATCCATGC TGTGTTATGTGACGA 3'(下划线部分为BamH I酶切位点);下游:5' CCGCTCGAGTTAGATTACA GTCAGATTGAGAA 3'(下划线部分为XhoI 酶切位点)。扩增全长片段,引物由睿博兴科有限公司合成。
1.2.2 pET-30a-IDOL 原核表达质粒的构建 pCMV3-IDOL 质粒含有 IDOL ORF,因此,以该质粒为模板,进行 PCR 扩增人全长 IDOL 基因。反应条件为:94 ℃ 预变性 5 min;94 ℃ 变性30 s,55 ℃ 退火 30 s,72 ℃ 延伸 1 min,共 35 个循环;72 ℃ 延伸 10 min。PCR 产物经 1% 琼脂糖凝胶电泳鉴定。
将 IDOL 的 PCR 产物及质粒 pET-30a(+) 分别进行BamH I 和XhoI 双酶切反应,经 T4 DNA连接酶 4 ℃ 连接 12 h,之后转化至大肠杆菌E.coliDH5α 感受态细胞,经菌落 PCR 及双酶切鉴定后,送测序。经鉴定序列正确,重组表达质粒命名为 pET-30a-IDOL。
1.2.3 His-IDOL 蛋白的原核表达及纯化 将pET-30a-IDOL 重组质粒转化至E.coliTransetta(DE3)感受态细胞,经卡那霉素抗性筛选后,挑取单克隆于 LB 培养基中培养。待OD600达 0.6 时,加入终浓度为 0.5 mmol/L 的 IPTG,分别于 15 ℃ 和37 ℃ 条件下,100 r/min 过夜诱导重组蛋白表达。之后离心并收集菌体,超声破碎后,利用SDS-PAGE 电泳分别检测两种诱导条件对重组蛋白全菌以及上清表达水平的影响。
将 600 ml 过夜诱导的菌体离心,用上样缓冲液(20 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.4)重悬菌体,采用高压细胞破碎仪裂解菌体,4 ℃ 高速离心后将上清液用 0.45 mm 滤膜过滤。由于表达的重组 IDOL 蛋白带有 His 标签,因此采用Ni2+螯合的 HisTrap HP 亲和层析柱进行层析,用洗脱缓冲液(20 mmol/L Tris-HCl,500 mmol/L NaCl,500 mmol/L 咪唑,pH 7.4)进行梯度洗脱,收集对应洗脱峰蛋白并利用 BCA 试剂盒定量以及 SDS-PAGE 电泳鉴定。
1.2.4 多肽的设计与合成 根据文献[10]报道,LDLR 的 811 ~ 833 位氨基酸可与 IDOL 蛋白相互作用,因此,我们以 FITC 标记该氨基酸片段,便于后续荧光偏振测定。FITC 标记的 LDLR 多肽荧光探针(FITC-LDLR:FITC-CKNWRLKNINSINF DNPVYQKTTE)由上海强耀生物公司合成,并用DMSO 溶解为 2 mmol/L 溶液,于 -20 ℃ 保存。
1.2.5 FITC-LDLR 多肽最佳反应浓度的确定 将2 mmol/L FITC-LDLR 以 FP 反应缓冲液(PBS,0.01% Triton X-100,0.1 mg/ml BSA,pH 7.4)进行倍比稀释,至终浓度分别为 1000、500、250、125、62.5、31.25、15、7.5、3.75、1.875 nmol/L,依次加入到 384 孔板中,每孔 20 μl,设置 3 个重复孔,于 25 ℃ 避光 100 r/min 振荡孵育 30 min,以多功能酶标仪检测 ΔmP 值,摸索最适多肽浓度。
1.2.6 His-IDOL 与 FITC-LDLR 结合实验和稳定性测定 将纯化后的 His-IDOL(30 μmol/L)蛋白以 FP 反应缓冲液进行 2 倍稀释,依次加入至384 孔板中,每孔 10 μl,使得蛋白终浓度分别为15 000、7500、3750、1875、960、480、240、120、60、30、15 nmol/L,之后加入 2 μl FITC-LDLR(终浓度 500 nmol/L),8 μl FP 反应缓冲液,总反应体系为 20 μl。设置 3 个重复孔,于 25 ℃ 避光100 r/min 振荡孵育 30 min,以多功能酶标仪检测ΔmP 值。将上述反应分别于 30 min、1 h、2 h 反应,摸索最佳反应时间。以 GraphPad Prism5.0 软件拟合结合曲线,计算 His-IDOL 与 FITC-LDLR结合反应的解离平衡常数(Kd)以及蛋白的半数有效浓度(EC50)。
2 结果
2.1 重组表达质粒 pET-30a-IDOL 的构建
以 pCMV3-IDOL 质粒为模板,对人 IDOL 全长基因片段进行 PCR 扩增,电泳结果显示,800 ~1500 bp 之间有一条特异性明亮条带,目的基因大小相符(图1A)。将经过BamH I 和XhoI 双酶切的 IDOL PCR 产物与 pET-30a(+) 空载体连接,转化至E.coliDH5α 感受态细胞,挑取单克隆进行菌落 PCR 鉴定。结果显示,菌株 1 ~ 4 号均扩增出与目的基因大小相符的条带(图1B)。之后从中挑取菌株 1 保菌并提取质粒,重组质粒经BamH I和XhoI 双酶切后,显示约 1344 bp 大小的条带,与目的基因大小一致(图1C)。同时,将该阳性克隆测序,结果与目标基因序列完全一致。上述结果表明,我们成功构建了 pET-30a-IDOL 原核表达质粒。
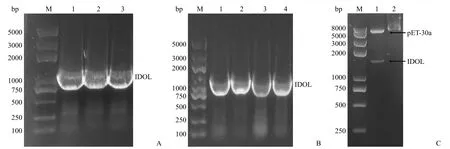
图1 重组表达质粒 pET-30a-IDOL 的构建[A:IDOL 基因的 PCR 扩增(M:DNA 分子量标准;1 ~ 3:IDOL 基因的 PCR产物);B:菌落 PCR 鉴定(M:DNA 分子量标准;1 ~ 4:pET-30a-IDOL 菌落 PCR 产物);C:重组质粒 pET-30a-IDOL的双酶切鉴定(M:DNA 分子量标准;1:经酶切的重组质粒 pET-30a-IDOL;2:未经酶切的重组质粒 pET-30a-IDOL)]Figure 1 The construction of pET-30a-IDOL recombinant plasmid [A: PCR amplification of IDOL gene (M: DNA marker;1 - 3: PCR product of IDOL); B: PCR of IDOL in E.coli DH5α (M: DNA marker; 1 - 4: PCR product of pET-30a-IDOL in E.coli DH5α); C: Digestion identification of pET-30a-IDOL recombinant plasmid (M: DNA marker; 1: Digestion product of pET-30a-IDOL;2: pET-30a-IDOL recombinant plasmid)]
2.2 His-IDOL 重组蛋白的表达与纯化
将 pET-30a-IDOL 重组质粒转化至E.coliTransetta(DE3) 感受态细胞,经 IPTG 诱导表达。结果表明,与转化有空载体 pET-30a(+) 的菌株相比,15 ℃ 和 37 ℃ 条件下均表达出与目的蛋白大小一致的蛋白(约 55 kD)(图2),说明蛋白表达成功。由于低温条件蛋白更易可溶性表达,因此,后续我们采用 0.5 mmol/L 的 IPTG、15 ℃、100 r/min 过夜条件,诱导重组蛋白表达。经HisTrap 层析柱分离纯化后,收集不同咪唑浓度下洗脱的蛋白,并进行 SDS-PAGE 电泳分析。结果表明,200 mmol/L 及 300 mmol/L 咪唑浓度洗脱均能够获得较高纯度的 His-IDOL 重组蛋白(图3)。将 300 mmol/L 咪唑浓度洗脱蛋白(> 90% 纯度)富集,进行超滤浓缩,用于后续荧光偏振实验测定。

图2 His-IDOL 的原核表达Figure 2 The expression of His-IDOL

图3 His-IDOL 的蛋白纯化原核表达Figure 3 The purification of His-IDOL
2.3 FITC-LDLR 最佳反应浓度确定
实验结果表明,从 1000 nmol/L 开始,随着多肽浓度的降低,FITC-LDLR在实验体系中的 ΔmP值表现出显著升高的趋势(图4)。在荧光偏振体系中,仅有多肽存在时,ΔmP 值处于 25 ~ 50 之间为最佳,这与待测荧光标记分子的分子量大小及构象有直接关系。为了保持本实验体系具有较好的灵敏度及较低的本底值,选用 500 nmol/L FITC-LDLR 用于后续结合反应。

图4 最佳多肽浓度的确定Figure 4 Determination of the optimal concentration of peptides in FP assay
2.4 荧光反应体系的确定
采用饱和曲线法,首先测定 His-IDOL 与FITC-LDLR 结合能力。荧光偏振实验结果表明,His-IDOL 与 FITC-LDLR 能够很好地结合,并且在 10 μmol/L 浓度下达到饱和,最大 ΔmP 值为183,该反应Kd值为 1.64 μmol/L(图5A)。实验结果表明,随着 His-IDOL 蛋白浓度的增加,蛋白的 EC50值逐渐升高,当 His-IDOL 约为 2 μmol/L时,ΔmP 值稳定在 140 左右,此时具有较高灵敏度和较大信号窗(图5B)。随后,确定不同孵育时间对该反应稳定性的影响。结果表明,分别孵育 30 min、1 h 和 2 h 后,结合反应的Kd值和ΔmP 值保持稳定,对应Kd值分别为 1.59、1.54和 1.63 μmol/L(图5C)。本实验选择 500 nmol/L FITC-LDLR 和 2 μmol/L His-IDOL 于 25 ℃、100 r/min 振荡避光孵育 1 h 作为最优反应体系。该体系的成功构建为研究 IDOL/LDLR 蛋白相互作用提供了新的方法。

图5 IDOL/LDLR 相互作用的荧光偏振测定及优化最佳多肽浓度的确定(A:饱和曲线测定;B:量效曲线测定;C:作用时间优化)Figure 5 FP assay of IDOL/LDLR interaction and optimization (A: Saturation binding curves; B: Concentration-response curve;C: Optimization of reaction time)
3 讨论
提升肝脏中 LDLR 表达水平对于预防高脂血症具有重要意义,也是治疗 AS 疾病的核心药物靶点。目前临床广泛应用的他汀类药物就是通过SREBP2 转录因子增加 LDLR 表达水平从而降低血浆 LDL-C 水平的。但他汀类药物副作用及局限性不容忽视[12-13]。除了受到转录水平调控之外,LDLR 转录后水平的调控对于其蛋白水平同样重要。IDOL(也称为 MYLIP),是能够与 LDLR 结合的 E3 泛素连接酶,通过泛素化降解来调节LDLR 的表达水平。Zelcer 等[4]发现,IDOL 是LXR 的重要靶基因,不同细胞和组织中,LXR 的激动剂,如 GW3965 和 T0901317 能够上调IDOL 表达水平,从而抑制 LDLR 的表达。SREBP以及 LXR 是两个重要的转录因子家族,共同维持着机体胆固醇水平的平衡,包括内源性胆固醇的合成、多余胆固醇的外流和转化等途径[14-15]。LXR-IDOL-LDLR 轴平衡对于机体胆固醇稳态十分重要,并且其对 LDLR 的内化和途径溶酶体的降解过程不依赖于网格蛋白和小泡,这与 PCSK9对 LDLR 的调控机制截然不同[16-17]。
抑制 IDOL 对 LDLR 的降解,有利于提升肝脏 LDLR 表达水平,有望成为抗 AS 药物开发的新思路。2015年,Zhou 等[18]发现 DHA 通过多重机制增加肝脏中 LDLR 的表达水平,其中包括通过 LXR-IDOL 轴调控。另外,Nelson 等[19]利用抑制 IDOL 活性的手段,提高了 LDLR 肝脏中表达水平。由此可见,无论是下调 IDOL 表达或者抑制其泛素连接酶活性,均能够有效增加 LDLR 表达。以蛋白-蛋白相互作用为靶点的研究从功能角度更加接近细胞生理状态,相对于以单个蛋白为靶点的体外筛选模型具有更好的选择性和特异性,不易造成“脱靶”现象。荧光偏振是研究蛋白质与小分子、多肽相互作用的重要方法,目前基于此方法建立的小分子抑制剂筛选模型以及评价体系在药物研发领域得到了广泛的使用[20]。因此,本研究基于荧光偏振方法建立体外 IDOL/LDLR 蛋白相互作用体系,具有操作简便、稳定性好、重复度高等优势。
在不同国家和地区的 GWAS 调查中显示,IDOL 蛋白表达水平与人类血脂谱以及单核苷酸多态性具有密切相关性[21]。比如,2019年调查显示,IDOL 蛋白的 G51S 突变体对于 LDLR 有更强的亲和力以及降解活性,因此 G51S 突变体人群中LDL-C 明显高于普通样本值[22];2020年在新疆维吾尔自治区流行病学统计显示,汉族人群中 IDOL基因 rs9370867 与高血脂症相关[23]。这些都说明IDOL 蛋白对于高胆固醇血症的调控具有重要的生理意义。随着对 IDOL 蛋白研究的逐步深入,IDOL的相关动物模型以及与之有相互作用网络的蛋白相继出现。2016年,Ibrahim 等[24]利用腺病毒载体构建了肝脏组织中特异表达 IDOL 蛋白的人源化小鼠模型,并发现该模型小鼠的血浆胆固醇水平显著升高,由此,从整体动物水平对 IDOL 生理功能的研究也得到不断丰富。因此,进一步探索 IDOL蛋白的作用机制,围绕 IDOL 蛋白开展多元化靶点的研究,构建合理有效的药物筛选模型,对抗 AS药物研发具有深远的意义。
综上所述,本研究通过原核表达并纯化获得人全长 IDOL 蛋白,利用荧光偏振方法,建立体外IDOL/LDLR 的蛋白相互作用体系,确定 IDOL 与LDLR 作用方式以及最适反应条件,为今后基于IDOL/LDLR 相互作用的小分子抑制剂的开发和AS 疾病的治疗提供了新的策略。
——一道江苏高考题的奥秘解读和拓展

