多肽IMB-P1的理性设计及活性评价
刘娟娟,金媛媛,邹森,冯晓,赫卫清,杨兆勇
恶性肿瘤是一个全球范围的公共健康问题[1]。由于环境因素、不良生活习惯和遗传等各种因素的影响,恶性肿瘤的发病率及死亡率呈逐年上升的趋势[2]。据统计,目前恶性肿瘤已成为我国居民的第一位死亡原因[3]。现在常用的抗肿瘤药物主要有小分子化学药物、抗体类药物和多肽类药物等。其中多肽类药物具有分子量较小、易改造、易合成、合成原料相对易得、适于规模化筛选与开发等优点[4],在世界新药研发、生产、使用中已独具特色,且业已形成规模。
山羊抗癌活性肽(goat anti-cancer bioactive peptides,gACBPs)是用人胃癌细胞碎片免疫山羊,从其脾脏中分离获得的具有良好抗肿瘤活性的分子量单一的(16.7 kD)肽类混合物,其良好的抗肿瘤作用及安全性在体内外实验中均得到验证[5-11]。前期应用二维纳升液相色谱-电喷雾静电场轨道阱组合式高分辨质谱联用系统(2D-nano-LC-ESI LTQ-Orbitrap MS/MS)对 gACBPs 进行生物合成信息的解析,获得其中一个单组分羊过氧化物还原酶 5(goat peroxiredoxin 5,gPRDX5)的序列信息并实现了异源表达[12]。为了解决 gPRDX5 作为药物应用的免疫原性问题,对序列相似率达 89% 的人过氧化物还原酶 5(human peroxiredoxin 5,hPRDX5)进行异源表达,体内实验证实 hPRDX5在结肠癌 C26 小鼠及荷 B16 黑色素瘤小鼠中均具有抑瘤作用,且与肿瘤免疫相关[13]。对 hPRDX5 功能片段进行鉴定发现,含有 47 位半胱氨酸(Cys47)的多肽 IMB-P1(AFTPGCSKTHLPGFVEQAEAL)体内抗肿瘤活性与 hPRDX5 完整蛋白相当[14]。但多肽 IMB-P1 仍然存在分子量偏大、发挥抗肿瘤作用的关键氨基酸位点不明等问题,仍需确定其最小活性区域及关键氨基酸位点,为进一步选择合理有效的多肽优化策略提供依据。
多肽序列截短是多肽设计的代表性策略之一[15],因此本研究拟对多肽 IMB-P1 从两端分别进行截短。通过测定各截短多肽体外和体内生物活性,并结合在小鼠血浆中稳定性以及二级结构的检测,确定与 IMB-P1 活性相当的最短多肽,为该类多肽药物的下一步开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 Fmoc-Gln-Resin、Fmoc-Thr-Resin、1-羟基苯并三唑、O-苯并三唑-N,N,N',N'-四甲基脲四氟硼酸盐(HBTU)、N,N-二异丙基乙胺(DIEA)购自吉尔生化(上海)有限公司;其他化学试剂购自北京百灵威科技有限公司;均相时间分辨荧光(homogeneous time-resolved fluorescence,HTRF)试剂盒购自美国 Cisbio 公司;BMS202(S7912)购自美国百时美施贵宝公司;384 浅孔板购自美国Thermo Fisher Scientific 公司;RPMI1640 培养基、胎牛血清(fetal bovine serum,FBS)、0.25% 胰蛋白酶、25 ml 细胞培养瓶和 1 × PBS 缓冲液均购自美国 Corning 公司;胸腺肽 α1 购自成都地奥九泓制药厂;小鼠黑色素瘤细胞(B16 细胞)购自中国医学科学院基础医学研究所。
1.1.2 实验动物 六周龄、雄性、清洁级、近交系 C57BL/6 小鼠,体重(20 ± 2)g,由中国医学科学院动物研究所提供。本次动物实验依据本研究所《实验动物管理条例》中的相关实验动物伦理规范进行操作。
1.1.3 实验仪器 全自动多肽合成仪为美国CSBio 公司产品;半制备高效液相色谱仪为日本岛津公司产品;EYELA N-1300 旋转蒸发仪为日本东京理化器械株式会社产品;ALPHA 2-4 LD plus 冷冻干燥机为德国 Christ 公司产品;Infinite M200酶标仪为瑞士 Tecan 公司产品;细胞培养箱为美国Thermo Fisher Scientific 公司产品;Chirascan 圆二色谱仪为英国应用光物理公司产品。
1.2 方法
1.2.1 多肽的设计 对多肽 IMB-P1 序列进行分析,其在完整蛋白中为 α-螺旋结构,而 α-螺旋结构为多肽链主链绕中心轴旋转,形成棒状螺旋结构,每个螺旋含有 3.6 个氨基酸残基。因此以 4 个氨基酸为单位,分别从 N 端和 C 端依次截短 4、8 和 12 个氨基酸残基来缩短多肽的长度。
1.2.2 多肽的合成和纯化 本研究中所设计的6 条多肽通过多肽合成仪进行合成。使用 Kromasil 100-5C18(4.6 mm × 250 mm)色谱柱,检测波长设为 210 nm,通过高效液相色谱(HPLC)对合成获得的目标多肽粗品进行分离鉴定;质谱(MS)检测确认多肽分子量,进行制备。旋转蒸发仪去除多肽溶液中的有机溶剂,放入 -70 ℃ 冰箱冷冻后再进行冷冻干燥,获得目标多肽。
1.2.3 体外活性评价 采用 HTRF 方法[16-17],以BMS202(S7912)为阳性对照,测定 100 μmol/L 多肽 IMB-P1-1 ~ 6 对 PD-1 和 PD-L1 结合的抑制活性。
1.2.4 动物模型构建 将 B16 黑色素瘤细胞复苏后培养于含有 10% FBS 的 RPMI1640 培养液中,置于 37 ℃、5% CO2培养箱中培养。待细胞处于指数增殖期时用 0.25% 的胰酶消化,调整细胞悬液浓度为 1 × 106/ml 备用。用备皮刀将小鼠背部毛发去除,去毛面积约为 4 cm2,用 75% 乙醇充分消毒,取备用的细胞溶液 0.2 ml 接种于小鼠背部皮下,隔天观察肿瘤生长情况,观测小鼠生存期并记录相关数据。
1.2.5 体内抗肿瘤活性评价 分别设置未接种肿瘤组(阴性对照)、空白对照组(PBS)、阳性对照组、各实验组,每组 6 只小鼠。由于设计合成多肽的分子量不一,为保证给药量一致,按照统一摩尔浓度进行药物配制。为了进行与同种类型药物的对比,本次阳性对照药物选择临床上用于肿瘤治疗的多肽类免疫增强剂胸腺肽 α1。在本实验中,胸腺肽 α1 的给药量依据临床用量即每周两次 1.6 mg皮下注射,根据公式 10 × 1.6 mg/70 kg 换算,最终算得小鼠的给药量为 0.2285 mg/kg。以 PBS 作为空白对照;多肽 IMB-P1 及 IMB-P1-1 ~ 6 用 PBS配制成相应浓度的溶液,无菌 0.22 μm 滤膜过滤除菌。给药方式:皮下注射给药,每天 1 次,给药 2 ~ 3 周。观察小鼠生长状态及生理状态,待小鼠生长状态出现下降或实验周期结束后采用颈椎脱臼法处死小鼠,将肿瘤组织剥离,称量瘤重。
1.2.6 多肽在小鼠血浆中稳定性实验 用 PBS将多肽 IMB-P1、IMB-P1-2、IMB-P1-3、IMB-P1-6配制成 5 mmol/L 的母液,按表1 比例与适量空白小鼠血浆混合,添加 PBS 稀释混合溶液,使其终浓度分别为 10% 和 1 mmol/L,同时设置血浆空白组和多肽空白组,按不同时间点(0、0.5、1、3、6 h、过夜)分装 100 μl/管,37 ℃ 温箱孵育,按相应时间点取样,将样品 4 ℃、12 000 r/min 离心10 min,取上清 HPLC 分析(检测波长 210 nm,流速 1 ml/min,进样体积 20 μl,5% ~ 90% 乙腈/水 + 0.1% TFA 梯度洗脱)。

表1 多肽在小鼠血浆中稳定性实验分组Table 1 Grouping of peptide stability test in mouse plasma
1.2.7 多肽二级结构的测定 用超纯水模拟体液环境,10% SDS 溶液模拟细胞膜表面的疏水环境。用圆二色谱仪检测多肽 IMB-P1 和 IMB-P1-2的二级结构,多肽浓度为 100 μmol/L,设定带宽为1 nm,选择光谱的测试范围为 180 ~ 260 nm,扫描速度为 100 nm/min。设置数据采样方式 Sampling,Time-per-point 为 0.5 s,设置采集模式为 Spectrum光谱。用 CDPro 软件包进行数据处理,作图分析。
1.3 统计学处理
采用 IBM SPSS 20.0 软件进行统计分析,计量资料均以±s表示。多组间比较时,使用完全随机设计资料的方差分析(one-way ANOVA);多组间两两比较或两组间比较时,若资料为正态分布则使用非配对t检验,若非正态分布则使用Wilcoxon 秩检验。以P< 0.05 判定为有统计学差异。
2 结果
2.1 IMB-P1 同源多肽的设计与合成
分别对多肽 IMB-P1 从 N 端和 C 端进行氨基酸残基截短,获得多肽 IMB-P1-1 ~ 6(表2),其中多肽 IMB-P1-1 ~ 3 依次为 C 端截去 4、8 和12 个氨基酸,多肽 IMB-P1-4 ~ 6 依次为 N 端截去 4、8 和 12 个氨基酸。采用固相合成法制备出纯度达 95% 的目的多肽。
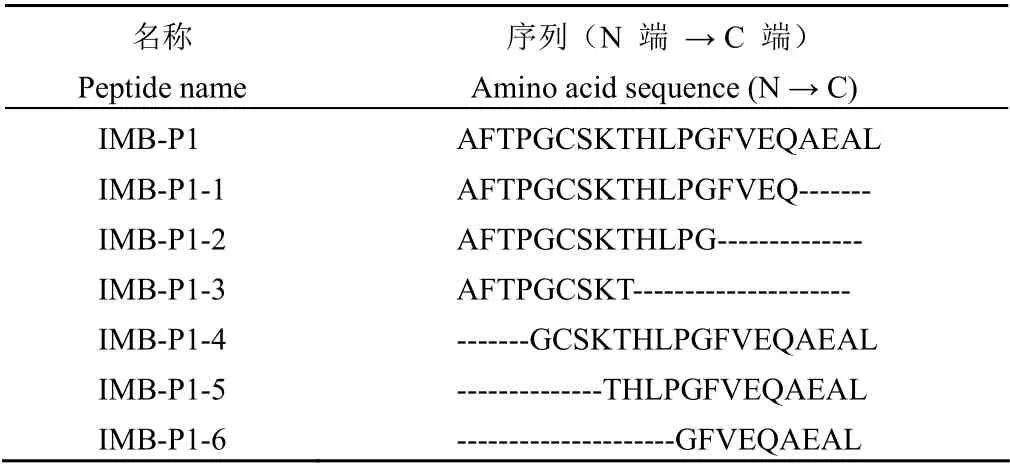
表2 IMB-P1 优化设计的 6 条多肽序列Table 2 The sequence of 6 peptides by optimizing IMB-P1 design
2.2 PD-1 和 PD-L1 结合的抑制活性评价
采用 HTRF 方法,以 BMS202 为阳性对照,对 IMB-P1 和多肽 IMB-P1-1 ~ 6 进行 PD-1/PD-L1抑制活性评价发现,多肽 IMB-P1、IMB-P1-1 ~ 6 均有体外抑制 PD-1 和 PD-L1 结合的活性(图1)。多肽 IMB-P1 的抑制率约为 20%,IMB-P1-2、IMB-P1-3 和 IMB-P1-6 抑制活性优于 IMB-P1。其中,多肽 IMB-P1-6 抑制活性最高,可达 90%以上;其次为多肽 IMB-P1-3,其抑制率约为 70%;多肽 IMB-P1-2 的抑制率大于 50%。
2.3 体内抗肿瘤活性的测定
选用评价 hPRDX5 蛋白及多肽 IMB-P1 体内抗肿瘤活性的荷 B16 黑色素瘤小鼠模型,对IMB-P1 同源多肽进行体内抗肿瘤活性的测定。IMB-P1 和其截短多肽的体内抑瘤活性如表3 所示,IMB-P1 和从 C 端截短的多肽 IMB-P1-1 ~ 3的抑瘤活性均优于胸腺肽 α1,多肽 IMB-P1-1 和IMB-P1-2 的抑瘤活性与 IMB-P1 相当,但IMB-P1-2 的长度更短。而从 N 端截短的多肽IMB-P1-4 ~ 6 的抗肿瘤活性较 IMB-P1 变差。
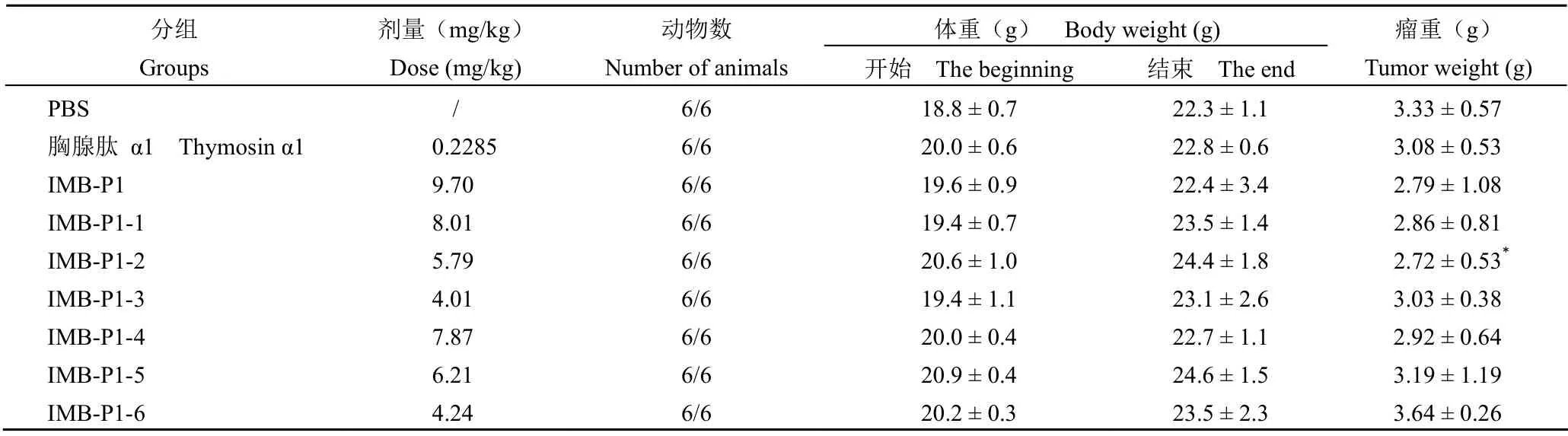
表3 IMB-P1 和其截短多肽在荷 B16 黑色素瘤小鼠模型中的抗肿瘤活性Table 3 The anti-cancer activity of IMB-P1 and its truncated peptides with melanoma B16/C57BL/6 mouse tumor model
2.4 多肽在小鼠血浆中的稳定性评价
由于多肽类药物存在半衰期较短、血浆清除率高、稳定性较差等问题,使得其发展受到限制[18]。因此对多肽 IMB-P1 和体内抗肿瘤活性与其相当的多肽 IMB-P1-2 及体外 PD-1/PD-L1 抑制活性较好的多肽 IMB-P1-3、IMB-P1-6 进行小鼠血浆中稳定性检测,以探究多肽进入机体后半衰期的长短。结果如图2 所示,多肽 IMB-P1 在血浆中37 ℃ 孵育过夜后仍未完全降解,多肽 IMB-P1-2则在血浆中 37 ℃ 孵育过夜后全部降解,多肽IMB-P1-3 在血浆中 37 ℃ 孵育 3 h 后全部降解,而多肽 IMB-P1-6 在血浆中 37 ℃ 孵育 6 h 后全部降解。对比发现,在血浆中的稳定性顺序是多肽IMB-P1 > IMB-P1-2 > IMB-P1-6 > IMB-P1-3。
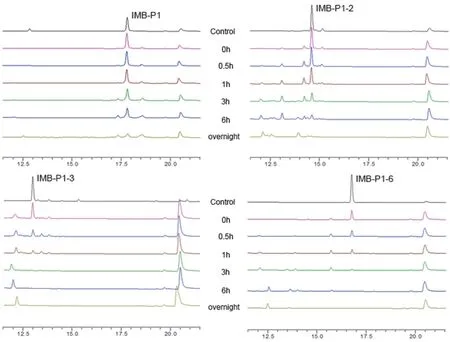
图2 多肽 IMB-P1、IMB-P1-2、IMB-P1-3 和 IMB-P1-6 在血浆中的稳定性Figure 2 The stability of IMB-P1, IMB-P1-2, IMB-P1-3 and IMB-P1-6 in plasma
2.5 多肽二级结构的测定
多肽 IMB-P1 为蛋白 hPRDX5 结构中的一段 α-螺旋片段,鉴于某一肽段从整体蛋白结构中分离出来后很可能不能保持原有的构象,随之影响其生物活性,因此对多肽 IMB-P1 和截短的 IMB-P1-2 进行二级结构的测定。由于细胞膜表面是一种疏水环境,因此使用 10% SDS 溶液来模拟细胞膜表面环境。结果如图3 所示,多肽IMB-P1 无论是在水中还是在 SDS 环境中,均在198 nm 处有一个明显的负峰,这说明此时的IMB-P1 的二级结构均以无规则卷曲为主。而当多肽 IMB-P1-2 在水中时,在 208 nm 处有一个明显的负峰,在 222 nm 处有一个轻微的负峰,这说明多肽 IMB-P1-2 在水中形成了 α-螺旋的结构。在SDS 溶液环境中,多肽 IMB-P1-2 呈现无规则卷曲状态。
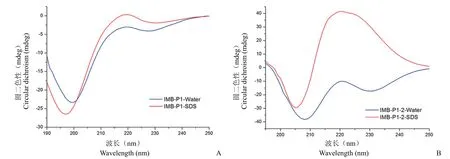
图3 多肽 IMB-P1(A)和 IMB-P1-2(B)在水和 SDS 中的二级结构分析Figure 3 The secondary structure analysis of IMB-P1 (A) and IMB-P1-2 (B) in water and SDS
3 讨论
通过对蛋白质结构与功能的研究发现,蛋白质发挥其功能时,有时候仅需要其部分功能区域,并不需要全部序列,即通过基因敲除或者仅合成多肽功能片段的方式也可发挥药效,从而避免了基因工程表达蛋白质的工艺繁琐以及高成本、难纯化等缺点[19]。因此基于蛋白质功能区域的多肽药物研发,成为了多肽类新药发现的一个重要方式。
前期通过对 hPRDX5 功能片段的鉴定,获得体内抗肿瘤活性与 hPRDX5 完整蛋白相当的多肽IMB-P1。为进一步选择合理有效的多肽优化策略,仍需确定多肽 IMB-P1 的最小活性区域及关键氨基酸位点。考虑多肽 IMB-P1 包含 21 个氨基酸,丙氨酸扫描的方式[20]合成成本较高、耗时较长、工作量较大,而多肽序列截短[21]可更直接判断活性区域,且同步完成多肽截短,成本较低,故多肽IMB-P1-1 ~ 6 的设计采用两端截短氨基酸残基的方式进行。
依据前期 hPRDX5 的体内抗肿瘤活性以及与PD-L1 的分子对接模拟结果,推测hPRDX5 发挥活性与肿瘤免疫密切相关,很有可能作用于PD-1/PD-L1 信号通路[13]。因此,本研究以百时美施贵宝公司专利中的 PD-1/PD-L1 小分子抑制剂BMS202 为阳性对照,对 IMB-P1 及其截短多肽进行 PD-1/PD-L1 抑制活性的评价,发现该 7 条多肽均有体外抑制 PD-1 和 PD-L1 结合的活性,且多肽 IMB-P1-6、IMB-P1-3 及 IMB-P1-2 较IMB-P1 抑制活性有所提高,推测可能是由于氨基酸数目减少,使得其更容易与 PD-1/PD-L1 通路产生相互作用,这为该类多肽作用于 PD-1/PD-L1 通路的猜测提供了依据。
胸腺肽 α1 是人体胸腺激素中重要的活性组分,是由胸腺素组分 5(TF-5)中分离纯化获得的一种小分子生物活性多肽,该药物由人工合成,具有促进胸腺细胞及 T 淋巴细胞的分化、成熟及产生多种生物因子,调节和增强机体免疫功能的作用[22-23]。由于前期推测 hPRDX5 发挥活性与肿瘤免疫密切相关,因此本研究以胸腺肽 α1 为阳性对照,通过荷 B16 黑色素瘤小鼠对 IMB-P1 截短多肽进行体内活性评价。发现长度最短且与 IMB-P1抗肿瘤活性相当的是在 C 端删除 8 个氨基酸残基的 IMB-P1-2,而多肽 IMB-P1-3、IMB-P1-6 未呈现预期的抑瘤作用,结合多肽在小鼠血浆中的稳定性结果,推测可能是因为多肽 IMB-P1-3、IMB-P1-6 在血浆中的稳定性较差而导致体内活性不佳。
此外,多肽 IMB-P1 中除包含关键半胱氨酸Cys47 外,hPRDX5 作为过氧化物还原酶的活性位点 Thr44、Pro45、Gly46、Lys49、Thr50[24]也全部包含其中。从 C 端依次删除 4、8、12 个氨基酸残基的多肽 IMB-P1-1 ~ 3 包含以上全部活性位点,实验发现其 PD-1/PD-L1 抑制活性随氨基酸数目的减少而提高,且含有活性位点的多肽仍保留体内活性,据此推断 hPRDX5 作为过氧化物还原酶的活性位点与其抗肿瘤活性相关。然而从 N 端完全删除活性位点的多肽 IMB-P1-6 却表现出了显著的 PD-1/PD-L1 抑制活性,且高于其他多肽,具体原因尚不清楚,仍需进一步研究。
抗肿瘤多肽通常具有一定的二级结构特点,以α-螺旋最为常见。而 α-螺旋结构是自然界中存在的一种重要的蛋白质表位,生物体内许多重要的蛋白间相互作用以及蛋白的识别都是由 α-螺旋结构介导的[25-26]。因此本研究对多肽 IMB-P1 和其截短多肽中体内活性相当的 IMB-P1-2 进行二级结构的测定。结果发现多肽 IMB-P1 无论是在水中还是在 SDS 环境中均呈无规则卷曲状态,而多肽IMB-P1-2 仅在水中形成了 α-螺旋的结构,这可能是多肽 IMB-P1-2 抑制 PD-1 和 PD-L1 结合的活性高于多肽 IMB-P1 的原因,为将来进一步提高多肽活性的修饰策略提供了锁定其 α-螺旋构象的方向。
综上所述,本研究发现了与多肽 IMB-P1 体内抗肿瘤活性相当的更短多肽 IMB-P1-2 以及具有较好抑制 PD-1 和 PD-L1 结合活性的多肽IMB-P1-6,为相关抗肿瘤多肽类药物的发现及改造奠定了基础。

