高丹草SRAP-PCR反应体系优化及验证
石 悦,刘拴成,房永雨,丁海君,吕二锁,路玉红
(1.集宁师范学院生命科学与技术学院,内蒙古集宁 012000;2.内蒙古自治区农牧业科学院草原研究所,内蒙古呼和浩特 010031;3.敖汉旗四家子镇农业技术推广站,内蒙古四家子 024300)
高丹草是高粱与苏丹草的种间杂交品种,分蘖多、产草量高、抗逆性和适应性强、适口性好、再生能力强,可多次刈割饲喂家畜[1-2],饲用价值和生态价值高。近年来,DNA 分子标记技术被广泛应用于牧草遗传性状差异分析、图谱构建及相关性状QTL 定位和新品种选育研究,如RAPD[3]、SSR[4-5]、EST-SSR[6]、ISSR[7]、AFLP[8]、SRAP[9]等分子标记技术均有报道。关于高丹草分子标记体系优化的研究报道,李杰勤等[3]研究不同因素水平(Mg2+、退火温度和Taq 酶含量)对苏丹草RAPD 反应体系进行PCR 扩增,确定苏丹草RAPD 反应体系的最优条件。温莹等[6]选取14 对引物,对50 份高丹草、3 份苏丹草和7 份高粱进行EST-SSR 扩增,并根据扩增结果进行聚类分析。
SRAP 分子标记技术(sequence -related amplified polymorphism)是由LI 等[10]提出的一种利用特殊引物设计对开放阅读框架(ORFs)进行多态性扩增的新分子标记技术,其多态性是由不同作物的启动子和内含子与间隔区域长度不同产生的。SRAP 分子标记具有试验操作简便、共显性强、扩增结果稳定、正向和反向引物可通过自由组合形成引物对而降低合成引物费用等优点。目前,SRAP-PCR分子标记的扩增体系已应用于多种作物,如马铃薯[11]、结缕草属植物[12]、石斛属植物[13]等,但迄今还未见关于高丹草SRAP-PCR反应体系优化和引物筛选的研究报道。
本试验以高丹草基因组DNA 为模板,采用单因素水平和正交试验设计相结合的方法,对SRAP-PCR反应体系的5 个因素(dNTP、DNA、引物、Taq DNA 聚合酶、Mg2+)进行试验体系优化和适宜引物筛选,旨在建立适合高丹草SRAR-PCR 的最佳反应体系,从而为高丹草遗传差异分析、新品种选育、遗传作图及相关性状QTL 精细定位等研究奠定理论基础。
1 材料和方法
1.1 试验材料
供试材料为蒙农9 号高丹草(散穗高粱×红壳苏丹草)部分单株,种植于集宁师范学院植物园试验基地。
1.2 基因组DNA 提取
拔节期剪取高丹草幼嫩叶片装入塑封袋,放入冰盒带回实验室,将叶片剪碎称取1.0 g,用植物基因组试剂盒提取样品DNA,检测基因组DNA 的纯度(1.4%琼脂糖凝胶电泳),并将DNA 稀释至50 ng/μL,于-80 ℃冰箱备用。
1.3 SRAP 引物来源及程序
SRAP 引物采用LI 等[10]报道的引物序列,正向引物和反向引物碱基序列见表1。本试验由6 对正向引物(m2、m4、m5、m9、bm8、bm9)和9 对反向引物(e2、e4、e6、e9、k2、k4、be10、coe7、coe9)随机组合形成的54 对SRAP 引物序列,委托上海生物工程公司合成。高丹草SRAP-PCR 扩增程序参照李佳奇等[14]基于SRAP 分子标记构建冰草遗传图谱中的程序。

表1 SRAP 引物的碱基序列
1.4 优化高丹草SRAP-PCR反应体系
1.4.1 SRAP-PCR反应体系单因素试验设计
以引物m5be10 进行SRAP-PCR 体系优化,结合单因素和正交试验方法:(1)对高丹草SRAP-PCR反应体系的5 个因素设置水平梯度,筛选适宜浓度区域;(2)利用正交试验每个因素设置8 个浓度梯度水平,确定最优组合(表2)。优化试验前需做预试验,设定SRAP-PCR反应体系各因子参数为浓度梯度的中间值,分别为:模板DNA 浓度3.0 ng/μL、Mg2+浓度2.50 mmol/L、Taq DNA 聚合酶用量1.00 U、dNTP 浓度200 μmol/L、引物浓度1.0 μmol/L,最后用ddH2O 补足至20 μL。
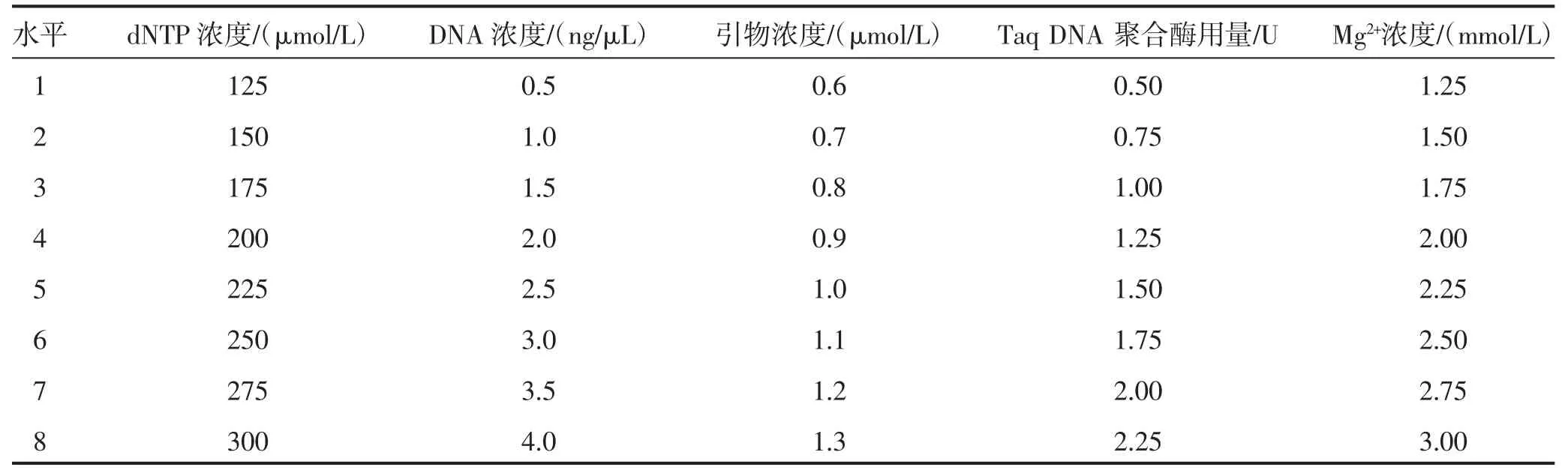
表2 SRAP-PCR反应体系单因素试验
1.4.2 SRAP-PCR反应体系正交试验设计
试验以影响高丹草SRAP-PCR反应体系的5 个因素(dNTP、DNA、引物、Taq DNA 聚合酶和Mg2+)以及利用单因素试验确定的4 个最优浓度梯度水平进行体系筛选(表3),即利用L16(45)正交试验设计进行优化,每个处理组合重复3 次。依据SRAP-PCR反应体系扩增产物的电泳条带数目、多态性情况、电泳结果清晰程度、是否有杂带等,对16 个试验组合进行评定打分[15-16]。以扩增条带多态性丰富且清晰为最高分(16 分),条带数少且模糊不清为最低分(1 分),其余组合按照这个标准划分为2~15 分。

表3 SRAP-PCR反应体系的正交试验设计
1.5 高丹草SRAP-PCR反应体系优化验证
以双亲基因组DNA 作为对照,对高丹草基因组DNA 进行SRAP-PCR反应体系扩增,依据表1 列出的引物进行自由组合,以bm8e6、m4e9、bm9e4、m5e9、m9e9、m9e2、m9e4 和m9k4 引物对进一步验证上述优化反应体系的效果。
2 结果与分析
2.1 供试材料DNA 纯度和浓度检测
采用植物基因组试剂盒提取高丹草幼嫩叶片DNA,经纯度电泳检测结果显示,DNA 纯度较高、条带清晰、无降解、无杂质、质量好;用紫外分光光度计测定各供试材料的DNA,浓度为50 ng/μL,经电泳检测条带清晰、纯度高,可用于SRAP-PCR 扩增(图1)。
图1 试验材料DNA 电泳检测结果
2.2 高丹草SRAP-PCR反应体系的单因素试验结果
2.2.1 dNTP 浓度对SRAP-PCR反应体系的影响
SRAP-PCR 延伸过程中,dNTP 主要影响DNA模板链的形成,其浓度高低可影响PCR 扩增效果的准确性、条带数量、特异性、聚合酶的活性。在其他因素不变的条件下,dNTP 浓度梯度由图2a 可知,随着dNTP 浓度的逐渐增加,在浓度为250 μmol/L 和275 μmol/L 时,扩增条带最多且清晰稳定;当浓度增加到300 μmol/L 时,条带清晰但数量有所减少,因此正交试验选用的dNTP 浓度为200~275 μmol/L 。
2.2.2 DNA 浓度对SRAP-PCR反应体系的影响
DNA 作为SRAP-PCR反应体系模板,其纯度(有无降解和其他杂质污染等情况)和浓度大小影响扩增结果。试验对模板DNA 设置8 个浓度梯度(0.5~4.0 ng/μL)。由图2b 可知,DNA 浓度为0.5 ng/μL 时,背景模糊不清、条带数量最少且多态性效果差;当SRAP-PCR 体系体积为20 μL,DNA 浓度在1.0~3.5 ng/μL 时,高丹草电泳条带数目有所增加、分布范围广(100~1 500 bp)、背景清晰;综合电泳扩增效果,正交试验确定模板DNA 浓度为2.0~3.5 ng/μL。
2.2.3 引物浓度对SRAP-PCR反应体系的影响
引物浓度对于SRAP-PCR反应体系扩增效率起着主要作用,过高或过低都会增加引物与模板DNA 的错配率,导致条带特异性差。由图2c 可知,引物浓度太低,如0.6 μmol/L 和0.7 μmol/L 时,PCR 扩增条带数少且不清晰;浓度过高,如1.2 μmol/L和1.3 μmol/L 时,条带模糊且数量减少,试验效果不好;引物浓度在0.8~1.1 μmol/L 时,随着浓度增加扩增条带丰富且清晰,因此正交试验选用的引物浓度为0.8~1.1 μmol/L。
2.2.4 Taq DNA 聚合酶用量对SRAP-PCR反应体系的影响
Taq DNA 聚合酶在SRAP-PCR 扩增试验中起到直接影响作用。以DNA 为模板合成新链时,Taq DNA聚合酶起到了关键作用,浓度过高会产生非特异性扩增,浓度过低扩增条带数少且效果差。由图2d 可知,Taq DNA 聚合酶用量为0.50 U 时,条带背景模糊、条带数少;Taq DNA 聚合酶用量为2.00 U 和2.25 U时,条带数虽然多但不清晰,Taq DNA 聚合酶用量影响PCR 扩增效果;Taq DNA 聚合酶用量在0.75~1.50 U时,扩增产物条带丰富且清晰稳定,因此正交试验选用的Taq DNA 聚合酶用量为0.75~1.50 U。
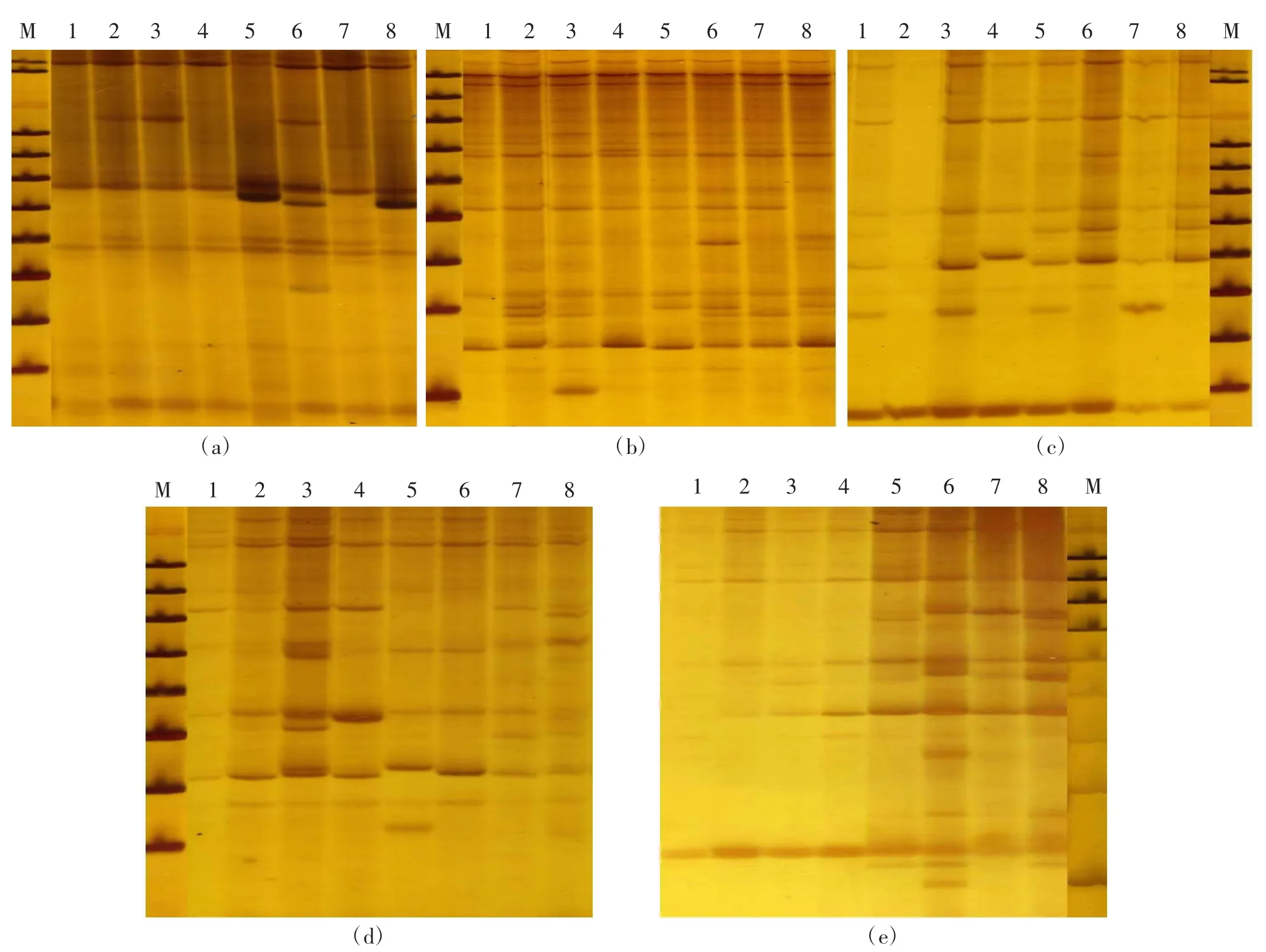
图2 不同浓度水平高丹草单因素的SRAP-PCR 产物电泳结果
2.2.5 Mg2+浓度对SRAP-PCR反应体系的影响
Mg2+浓度会在一定程度上影响Taq DNA 聚合酶活性,导致引物、模板DNA、dNTPs 产生结合现象。由2e 可知,Mg2+浓度在1.25~2.00 mmol/L 时,扩增产物条带少、背景模糊、效果差;Mg2+浓度在2.25~3.00 mmol/L时,扩增产物条带丰富且清晰稳定,因此正交试验选用的Mg2+浓度为2.25~3.00 mmol/L。
2.3 高丹草SRAP-PCR反应体系正交试验结果分析
高丹草SRAP-PCR 正交试验扩增结果见图3。由图3 可知,处理组合5、14、16 中扩增电泳条带数目最少(2~4 条)、多态性差、扩增效果差;处理组合1、3、4、7、8、10、11、15 电泳条带分布范围小、数目较少、有缺条带且背景较模糊;2、6、9、12、13 处理组合的电泳条带数目多、多态性丰富、分布范围广(100~1 500 bp),且背景清晰、扩增效果较好;对SRAP-PCR反应体系试验扩增结果进行直观分析和评定打分,确定处理组合13 为高丹草SRAP-PCR最佳反应体系,具体为:275 μmol/L dNTP、3.0 ng/μL DNA、1.1 μmol/L 引物、1.00 U Taq DNA 聚合酶和2.25 mmol/L Mg2+,用ddH2O 补至20 μL。

图3 高丹草SRAP-PCR 正交试验扩增结果
试验对5 个因素(3 次重复)水平进行极差分析,k值表示在SRAP-PCR反应体系中各因素同一水平下产生条带数的平均值,其数值越大扩增效果越好;R值是指高丹草SRAP-PCR反应体系中同一因素在不同水平下的极差,即R值越大,对SRAP-PCR反应体系的影响程度越大。高丹草SRAP-PCR 正交试验统计结果(表4)表明,各因素对SRAP-PCR反应体系的影响程度为:DNA 浓度>Taq DNA 聚合酶用量>dNTP 浓度>引物浓度>Mg2+浓度。

表4 正交试验设计结果的统计分析
2.4 高丹草SRAP-PCR优化体系的验证
选用筛选出的SRAP-PCR 最佳体系对高丹草双亲和3 个单株基因组DNA 进行体系扩增重复验证。由图4 可知,8 对SRAP 引物组合扩增出的电泳条带数目多、背景清晰无杂带、分布范围广、多态性丰富且稳定,证明该扩增体系效果和重复性好、可靠性高,可用于高丹草SRAP-PCR 扩增。

图4 高丹草SRAP-PCR 的最佳体系验证
3 讨论
筛选适宜的引物组合和稳定扩增效果清晰的SRAP-PCR反应体系可用于SRAP 分子标记多态性的研究[17-18]。单因素和正交试验设计具有操作简便、均衡分散、可包含多种处理组合、整齐可比等优点,能够体现不同因素水平的相互影响[19]。
本试验结合单因素和正交试验设计对高丹草SRAP-PCR反应体系中5 个主要因素进行优化,筛选出高丹草最佳SRAP-PCR反应体系。高丹草SRAP-PCR 扩增产物凝胶电泳图的条带数量和清晰度由于各因素对SRAP-PCR反应体系的影响程度明显不同,依次为DNA 浓度>Taq DNA 聚合酶用量>dNTP 浓度>引物浓度>Mg2+浓度。正交试验结果表明,对高丹草SRAP-PCR反应体系影响最大的是模板DNA 浓度,其次为Taq DNA 聚合酶用量,Taq DNA 聚合酶作为PCR反应的催化剂,可直接影响扩增条带的数目和清晰度。苏辉等[20]研究表明,DNA 模板用量是优化大豆SSR-PCR反应体系的关键因素;于肖夏等[21]研究表明,dNTP 浓度对冰草属SSR-PCR反应体系影响最大;贾新平等[22]利用SSR-PCR反应体系在二月兰研究中得出,影响最大的是Taq DNA 聚合酶用量,其次为Mg2+浓度;戚华沙等[23]以海南油茶植物组DNA 为模板,进行SRAP-PCR反应体系优化,结果表明,引物浓度对其扩增效果影响最大,其次为dNTPs,并采用优化后的体系进行引物筛选获得清晰稳定和多态性丰富的32 对引物;梁芳瑜等[24]建立宽叶缬草的SRAP-PCR反应体系,正交试验表明,影响其扩增效果最大的为TaqMix 用量,其次为Taq DNA 聚合酶用量,退火温度最优为36.8 ℃,并采用该最优体系筛选多态性丰富、条带清晰稳定的引物17 对。通过上述文献研究发现,不同的物种间,对SRAP-PCR反应体系的影响因子有所差别。
4 结论
本试验筛选出适合高丹草SRAP-PCR 的最佳反应体系,总体积为20 μL,dNTP 浓度275 μmol/L、模板DNA 浓度3.0 ng/μL、引物浓度1.1 μmol/L、Taq DNA 聚合酶用量1.00 U 和Mg2+的浓度2.25 mmol/L,其扩增出的电泳条带数目多、背景清晰无杂带、分布范围广,并用8 对SRAP 引物验证了该反应体系的稳定性和可靠性,可为开展高丹草遗传差异分析、新品种选育研究、遗传作图及相关性状QTL 精细定位等研究奠定基础。

