EGFR与HER-2在不同分子类型乳腺癌中的表达及其相关性分析
郭晓娟,王金西,牛广旭,田云霄,*
(1.邯郸市中心医院病理科,河北 邯郸056001;2.邯郸市第一医院普外四科,河北邯郸 056002)
乳腺癌是全球女性最常见的癌症,其发病率、死亡率在不断上升,而我国女性乳腺癌发病人数及死亡人数均居世界首位,分别占世界女性乳腺癌发病和死亡人数的17.6%和15.6%[1]。不同区域乳腺癌发病率、死亡率及分子类型存在差异[2],乳腺癌中约70%~80%为浸润性导管癌(invasive ductal carcinoma,IDC)。根据2019圣加伦(St.Gallen)乳腺癌国际共识,采用免疫组化检测替代基因表达谱分析,可将浸润性乳腺癌(invasive breast carcinoma,IBC)分为Luminal A型、Luminal B型、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)过表达型及基底样乳腺癌(basal-like breast carcinoma,BLBC)。BLBC是三阴型乳腺癌(triple negative breast carcinoma,TNBC)的一种亚型。人类表皮生长因子受体(human epidermal growth factorreceptor,EGFR)家族属于酪氨酸激酶Ⅰ亚族的跨膜蛋白受体,包括EGFR(HER-1/erbB1)、HER-2(erbB2)、HER-3(erbB3)和HER-4(erbB4)[3],其中EGFR和HER-2最常见于人类肿瘤发生过程中。目前研究证实,EGFR和HER-2可在多种人类恶性肿瘤中过度表达,且与肿瘤细胞的增殖、侵袭、转移及血管生成密切相关[4],并且是目前国际公认的重要治疗靶点。但二者之间是否存在某种关系,研究甚少。本文回顾性收集邯郸市中心医院650例乳腺癌患者标本,应用免疫组化方法检测EGFR、HER-2蛋白在乳腺癌组织中的表达情况,采用χ2检验及Spearman相关分析对数据进行统计学分析,发现EGFR、HER-2阳性率在乳腺浸润性导管癌显著升高,且EGFR阳性率与HER-2的评分等级及阳性表达均呈正相关,EGFR在HER-2过表达型与三阴型乳腺癌组织中显著升高,为研究HER-2阳性乳腺癌及三阴型乳腺癌的靶向药物治疗提供线索及理论依据。
1 材料与方法
1.1 病例资料
收集2015年1月—2020年3月邯郸市中心医院住院行乳腺癌根治切除术或乳腺癌单切术标本650例,病例筛选纳入标准:女性患者;患者临床资料、病理诊断结果、免疫组化检测结果、随访治疗完整;术前未进行放疗、化疗、内分泌等任何治疗。排除标准:男性患者;临床资料不完整;未行免疫组化检测;HER-2评分可疑阳性未进一步行FISH检测。650例乳腺癌患者中,IDC 600例,浸润性小叶癌50例。对照病例选取同期手术切除的乳腺纤维腺瘤的标本30例,要求肿物完整切除不伴有其他乳腺疾病,患者资料完整。患者或家属同意参与研究并签署知情同意书。本次研究得到邯郸市中心医院伦理委员会批准。
1.2 方 法
所有标本经4%中性福尔马林固定18~24 h,常规石蜡包埋,切片4μm厚,苏木精-伊红染色法(HE染色)。采用SP法行免疫组织化学检测,一抗EGFR、HER-2、雌激素(estrogen,ER)、孕激素(progesterone,PR)、增殖指数(Ki67)均购自福州迈新生物技术开发有限公司。
1.3 免疫组织化学分析及结果评价
1.3.1 HER-2蛋白采用DAKO Hercept Test评分系统评价HER-2蛋白表达水平,表达于细胞膜,评级为(0)~(3+)。阴性(0):无染色或≤10%的浸润癌细胞呈现不完整的、微弱细胞膜染色;(1+):>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色。可疑阳性(2+):>10%浸润癌细胞呈现弱至中等强度的、完整细胞膜染色或≤10%的浸润癌细胞呈现强而完整的细胞膜染;阳性(3+):>10%的浸润癌细胞呈强、完整、均匀的细胞膜染色。
1.3.2 EGFR蛋白根据阳性细胞数量及着色程度进行半定量分析,EGFR主要定位于细胞膜,阳性细胞数量:阳性细胞数<1%,计0分;1%≤阳性细胞数≤30%,计1分;30%<阳性细胞数≤70%,计2分;70%<阳性细胞数≤100%,计3分;着色程度:0分为不着色;1分为浅棕色;2分为棕黄色;3分为棕褐色。两项分数累计相加:<3分为阴性(-),≥3分为阳性(+)[5]。ER、PR、Ki67均定位于细胞核,阳性细胞数与肿瘤细胞数的比例即为阳性率(%)。
1.4 荧光原位杂交检测HER-2基因扩增情况
免疫组化染色HER-2可疑阳性的病例需进一步行荧光原位杂交(fluorescentin situhybridization,FISH)检测明确HER-2基因是否扩增。在肿瘤区域清晰处,计数至少20个细胞核内GSP HER-2(红色)和CEPl7(绿色)信号。分别记录红色和绿色的信号总数,计算平均每个细胞GSP HER-2、CEPl7拷贝数及两者的比值。HER-2/CEPl7<2.0,且平均GSP HER-2拷贝数/细胞数<4.0,为HER-2阴性(无基因扩增);HER-2/CEPl7<2.0,且4.0≤平均HER-2拷贝数/细胞数<6.0,为不确定HER-2基因是否扩增;HER-2阳性且HER-2/CEPl7≥2.0,或HER-2/CEPl7<2.0而平均HER-2拷贝数/细胞数≥6,为HER-2基因扩增。
1.5 分子分型定义
按St.Gallen乳腺癌国际共识,依据ER、PR、HER-2、Ki67表达情况进行分型。Luminal A型:ER且PR阳性,HER-2阴性以及Ki67≤14%。Luminal B型:ER阳性,HER-2阴性以及Ki67>14%,或Ki67中间型、PR阴性或低表达(<20%);ER阳性,HER-2阳性或扩增,任何Ki67或任何PR。HER-2过表达型:HER-2阳性或扩增,且ER与PR阴性。三阴型:ER、PR和HER-2均阴性。
1.6 统计学分析
采用SPSS 22.0软件对数据进行分析,计数资料以例数(n)或率(%)表示,组与组之间率的比较采用χ2检验,相关性分析采用Pearson积矩及Spearman秩相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 EGFR、HER-2蛋白在不同乳腺病变中的表达情况
本研究纳入IDC 600例,其中EGFR蛋白表达阳性292例(48.7%);HER-2表达阳性167例(27.8%),其中包括HER-2蛋白表达阳性149例、HER-2基因扩增18例。浸润性小叶癌50例,其中EGFR蛋白表达阳性12例(24.0%),HER-2蛋白表达阳性4例(8.0%)。对照组乳腺纤维腺瘤30例,EGFR蛋白表达阳性5例(16.7%),HER-2蛋白表达阳性2例(6.7%)。各组之间两两比较,EGFR、HER-2在IDC中表达阳性率显著高于浸润性小叶癌与纤维腺瘤(P<0.05),在浸润性小叶癌与纤维腺瘤中的差异无统计学意义(P>0.05,见表1)。

表1 EGFR、HER-2在浸润性导管癌、浸润性小叶癌、纤维腺瘤中的表达情况
2.2 浸润性导管癌中EGFR、HER-2蛋白表达情况及其相关性
600例IDC中HER-2评分为0者58例(9.7%),其中12例EGFR阳性(20.7%);评分(1+)病例数261例(43.5%),其中72例EGFR阳性(27.6%);评分(2+)病例数132例(22.0%),其中78例EGFR阳性(59.1%);评分(3+)病例数149例(24.8%),其中130例EGFR阳性(87.2%)。见图1。132例HER-2评分(2+)均进行FISH检测HER-2基因扩增情况,其中18例扩增阳性,检测阳性率为13.6%。见图2。EGFR阳性率随HER-2评分等级增高而逐渐升高,采用Spearman秩相关分析,提示EGFR阳性率同HER-2评分等级呈正相关(r=1.000,P<0.05)。见表2。
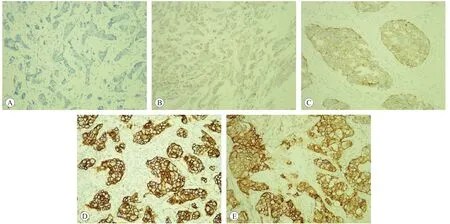
图1 EGFR、HER-2蛋白免疫组织化学检测结果评价示例(SP法,×200)

图2 FISH检测显示HER-2基因扩增1 000倍
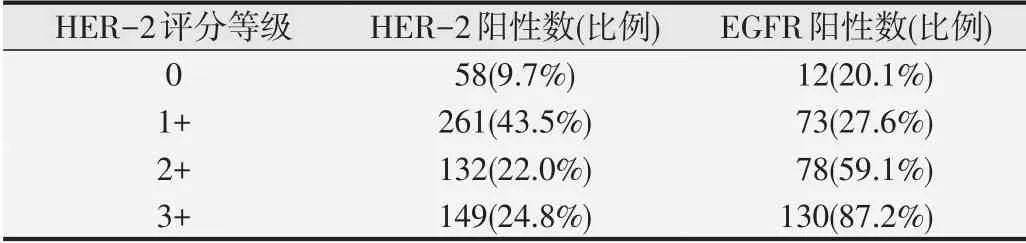
表2 600例IDC中EGFR、HER-2表达情况及其相关性
2.3 浸润性小叶癌中EGFR、HER-2蛋白表达情况及其相关性
50例浸润性小叶癌中HER-2评分为0者7例(14.0%);评分(1+)的病例数为31例(62.0%),其中5例FGER阳性(16.1%);评分(2+)的病例数为8例(16.0%),其中4例EGFR阳性(50.0%);评分(3+)的病例数为4例(8.0%),其中3例EGFR阳性(75.0%)。8例HER-2评分(2+)者中,FISH检侧HER-2基因扩增者0例。EGFR阳性率随HER-2评分等级增高而逐渐升高,采用Spearman秩相关分析,提示EGFR阳性率同HER-2评分等级呈正相关(r=1.000,P<0.05)。见表3。

表3 50例浸润性小叶癌中EGFR、HER-2蛋白表达情况及其相关性
2.4 浸润性乳腺癌中EGFR、HER-2表达的相关性
650例浸润性乳腺癌中,EGFR蛋白表达阳性总数304例(46.8%),HER-2蛋白表达阳性总数171例(26.3%),171例HER-2蛋白表达阳性组中EGFR蛋白表达阳性151例,479例HER-2蛋白表达阴性组中EGFR蛋白表达阳性153例,采用Pearson积矩相关分析,提示EGFR蛋白表达与HER-2蛋白阳性表达呈正相关(r=0.209,P<0.05)。
2.5 浸润性乳腺癌中各分子亚型中EGFR蛋白表达情况
依据ER、PR、HER-2及Ki-67的表达结果进行分子分型,650例浸润性乳腺癌中Luminal A型166例(25.5%);Luminal B型总数290例(44.6%),其中Luminal B(HER-2阴性)型221例(34.0%),Luminal B(HER-2阳性)型69例(10.6%);HER-2过表达型102例(15.7%);三阴型92例(14.2%)。各组分别对应EGFR阳性数35例(21.1%)、110例(37.9%)、53例(24.0%)、57例(82.6%)、93例(91.2%)、66例(71.7%)。Luminal B型病例数明显多于其他3型,Luminal A型明显多于HER-2过表达型及三阴型,Luminal B(HER2阴性)型明显多于Luminal B(HER2阳性)型。EGFR阳性率在HER-2过表达型和三阴型中显著高于Luminal A型和Luminal B型,Luminal B型中HER-2阳性型明显高于HER-2阴性型(P<0.01),其他指标的组间差异无统计学意义。见表4。
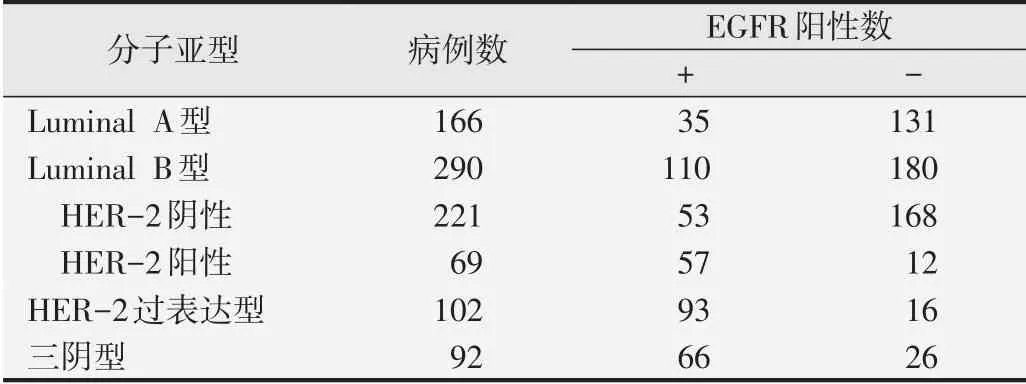
表4 650例IBC各分子亚型分布情况及EGFR表达情况
3 讨论
EGFR是一种跨膜蛋白受体,由erbB1基因编码,其位于人第7号染色体短臂上(7p12),全长约118 kb,由28个外显子组成。现有的研究表明EGFR相关信号通路在肺癌的发生和发展中起重要作用。EGFR酪氨酸激酶抑制剂是目前针对EGFR治疗非小细胞肺癌的重要分子靶向药。多项研究显示EGFR在结直肠癌、鼻咽癌、子宫内膜样腺癌、胆管癌等多种恶性肿瘤中高表达,参与了肿瘤血管的生成、转移、黏附,并抑制了细胞凋亡等过程,并且与患者的预后和总生存期密切相关[5-6]。一项研究结直肠癌CAR-T细胞治疗相关肿瘤靶点的筛选中,发现CAR-T细胞可以大量杀死EGFR阳性的肿瘤细胞,认为EGFR为CAR-T细胞免疫疗法的靶点[7]。以EGFR为靶点治疗肿瘤的研究越来越多。宋欣等[8]采用免疫组化与荧光原位杂交技术研究发现,EGFR和HER-2在肺癌和乳腺癌中的蛋白表达与基因扩增具有同样的变化趋势,EGFR和HER-2蛋白表达与基因扩增之间均存在正相关性。由此,我们通过EGFR、HER-2免疫组化检测结果阳性来判断存在基因扩增的可能性大。我们的研究数据显示EGFR在IDC中表达明显高于浸润性小叶癌及乳腺纤维腺瘤,提示EGFR的高表达与IDC的发生、发展有关。这为我们将来研究针对EGFR为靶点治疗乳腺癌提供了线索。
2011年的研究统计138例乳腺癌,其中EGFR表达与HER-2表达呈负相关[9],而本研究统计的650例乳腺癌数据中显示EGFR的表达随着HER-2的表达强度增加而升高,且EGFR的表达阳性率与HER-2阳性表达呈正相关。HER-2与ERFG同属于酪氨酸激酶受体家族成员,具有高度同源性。至今未找到HER-2的特异性配体,在其它家族成员的配基作用下,可与同家族成员EGFR结合形成同源性二聚体,引起HER-2羧基末端酪氨酸残基磷酸化,之后,激活其下游信号转导Ras-Raf-MEK-MAPK通路与PI3K-Akt激酶通路,从而参与肿瘤细胞的增殖、分化、迁移、黏附、转化、存活、凋亡等过程[10]。另有研究显示HER-2可阻断EGFR的内化降解,致使EGFR表达水平升高[11]。这些理论可以解释本研究的结果,且已有研究报道呈现与本实验相同的结果[12]。杨悦等[13]研究EGFR、HER-2在结直肠癌组织中的表达及临床意义时,发现EGFR阳性组中HER-2阳性率明显高于EGFR阴性组,提示二者在结直肠癌中有共表达现象。在胃癌的研究中亦是如此[14]。目前,针对HER-2靶点的乳腺癌药物曲妥珠单抗在临床中取得了一定成效,成为HER-2阳性乳腺癌患者首选靶向药物,尽管如此,临床上出现曲妥珠单抗耐药,导致部分患者的治疗无效,普遍耐药性成为临床靶向治疗的巨大挑战,因此研究联合用药的成为新需求。早有报道,HER-2/EGFR双受体酪氨酸激酶抑制剂拉帕替尼可以在体内外抑制肿瘤细胞活性,且临床研究显示,可以治疗侵袭、复发、炎性、脑转移的乳腺癌,并展望拉帕替尼能成为HER-2过表达乳腺癌的一线辅助或解救治疗药物,同时拉帕替尼治疗其他实体肿瘤的临床试验也在大规模的开展,不断报道拉帕替尼在临床中取得了较好的疗效[15]。在研究HER-2/EGFR双重抑制作用的小分子抑制剂时,发现同时针对HER-2和EGFR两个靶点,可以抑制多条细胞信号传导通路,避免单一信号通路抑制的代偿,从而降低耐药性和不良反应,进一步构建了一种靶向HER-2/EGFR分子双特异性单链抗体,并在体内外抑制乳腺癌肿瘤细胞的活性和增殖[16]。
我们统计的650例浸润性乳腺癌中Luminal A型166例(25.5%);Luminal B型总数290例(44.6%),其中Luminal B(HER-2阴性)型221例(34.0%),Luminal B(HER-2阳性)型69例(10.6%);HER-2过表达型102例(15.7%);三阴型92例(14.2%)。实验结果与Ishitha等[17]的研究结果相比,Luminal B(HER-2阴性)型比例偏高,三阴型略偏低,Luminal A型、Luminal B(HER-2阳性)型、HER-2过表达型比例基本保持一致。乳腺癌在不同区域,其分子亚型可以出现差异[2]。EGFR在HER-2过表达型、Luminal B(HER-2阳性)的阳性率显著高于Luminal A型及Luminal B(HER-2阴性),这可以用EGFR表达与HER-2表达呈正相关来解释。EGFR阳性率在HER-2过表达型和三阴型中显著高于Luminal A型和Luminal B型,这同李星枝等[18]的研究结果保持一致。三阴型乳腺癌具有非常特殊的生物学行为和临床病理特征,被认为是一种独立的临床病理类型,侵袭性强,预后差,由于ER、PR、HER-2均为阴性,因此难以从内分泌治疗中获益,同时对常规化疗不敏感,HER-2靶向药物治疗无效,寻找其有效的治疗方案是近几年研究的热点之一。EGFR靶向药物的研究及在临床治疗多种肿瘤中取得一定疗效,其成为我们关注的热点[19-20]。EGFR在三阴型乳腺癌中阳性率显著升高,提示EGFR靶向药物治疗三阴型乳腺患者的可能性。
综上所述,EGFR在浸润性乳腺癌中表达阳性率升高,且与HER-2表达呈正相关,在HER-2过表达型,三阴型乳腺癌中的高表达,为我们研究HER-2/EGFR双重抑制剂治疗HER-2阳性乳腺癌及EGRF靶向药物治疗三阴型乳腺癌的可能性提供了线索和依据。

