肿瘤坏死因子诱导基因-6对牙髓干细胞成牙分化的影响
李 锐,王 颖,孙晶晶,刘一鸣,康 鹏,何 巍
郑州大学第一附属医院口腔颌面外科 郑州 450052
牙髓炎是由龋病或创伤引起的牙齿急性或慢性炎症,会发展为根尖周炎症并影响牙周健康,严重可导致牙齿缺失[1]。根管治疗是牙髓炎的重要治疗方法之一,但是随之会出现牙体变脆等问题[2]。牙再生组织工程中牙髓再生是一个新的研究领域,已经有学者[3]实现人体内牙髓的再生,表明牙髓干细胞(dental pulp stem cell,DPSC)在牙髓疾病治疗中的潜力。但是炎症状态下DPSC的修复能力及其机制尚有待研究。
炎症刺激下间充质干细胞会高表达抗炎因子,而某些抗炎因子的表达会抑制间充质干细胞的成骨能力[4]。肿瘤坏死因子诱导基因-6(tumor necrosis factor stimulated gene 6,TSG-6)蛋白主要由TNF-α、IL-1诱导产生,是一种重要的抗炎因子。研究[5-6]表明TSG-6可通过抑制骨形态发生蛋白(bone morphogenetic protein,BMP)/Smad信号通路,进而抑制骨髓间充质干细胞的成骨分化;可促进破骨,抑制成骨。BMP/Smad信号通路是DPSC成牙分化的重要分子机制,BMP-4是影响早期成牙分化过程的重要分子之一[7]。牙髓炎发展过程中伴随成牙本质细胞形成修复性牙本质,提高DPSC在炎症环境中的分化能力可能会成为牙髓炎治疗的新方向。本研究对炎症、TSG-6与DPSC成牙分化的关系进行探索,为牙髓炎症的治疗提供新思路。
1 材料与方法
1.1 主要试剂与动物DMEM培养基、胎牛血清、青链霉素、胰蛋白酶和Ⅰ型胶原蛋白酶购自美国HyClone公司;TSG-6增强(Ad-TSG-6)和敲低(TSG-6-RNAi)病毒、慢病毒感染试剂购自吉凯基因(中国);GAPDH、TSG-6、Smad1/5、BMP-4、牙本质基质蛋白(dentin matrix protein,DMP)-1和牙本质涎磷蛋白(dentin sialophospho protein,DSPP)一抗,山羊抗小鼠和山羊抗兔二抗购自英国Abcam公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;蛋白提取试剂盒购自鼎国生物技术有限公司;水凝胶购自美国Corning公司。抗坏血酸、β-甘油磷酸钠及地塞米松均购自北京索莱宝生物公司;TNF-α购自美国Peprotech公司。50 mg/L抗坏血酸、10 mmol/L β-甘油磷酸钠、10-8mol/L地塞米松和体积分数5%胎牛血清加入DMEM配制成矿化诱导液。OCN和OPN一抗购自武汉塞维尔生物科技有限公司。24只6周龄雄性BALB/c裸鼠购自北京维通利华实验动物公司。
1.2 DPSC的分离、培养本研究经郑州大学第一附属医院伦理委员会批准、患者知情同意后收集30颗无龋坏和炎症的完整智齿,无菌条件下使用拔髓针取出牙冠部牙髓,使用改良组织块法对DPSC进行分离、培养。取出牙髓组织,无菌器械剪碎,使组织块小于1 mm×1 mm×1 mm。在剪碎的组织块中加入3 g/L的Ⅰ型胶原蛋白酶,置37 ℃培养箱孵育 40 min后终止消化,1 000 r/min离心5 min,弃上清,留下沉淀,并加入含有体积分数20%胎牛血清和青链霉素的DMEM培养基,吹打混匀,置于6孔板中培养。
1.3 慢病毒感染与细胞分组[8]通过慢病毒感染技术对DPSC中TSG-6的表达进行增强(Ad-TSG-6-DPSC)以及敲低 (TSG-6-RNAi DPSC)。严格按照说明书进行感染。取第3代DPSC按照1×104个细胞/孔接种在6孔板中,24 h后加入含慢病毒的感染试剂,感染复数为40。12 h后改为正常培养基培养,转染48 h后,荧光显微镜下观察到细胞转染效率达80%进行后续的实验。细胞分为正常组和增强组,炎症组和敲低组。正常组和增强组分别采用DPSC和Ad-TSG-6 DPSC,加入矿化诱导液培养。炎症组和敲低组分别采用DPSC和TSG-6-RNAi DPSC,加入含终浓度50 μg/L TNF-α的矿化诱导液培养。
1.4 细胞中TSG-6、BMP-4、Smad1/5、DMP-1、DSPP蛋白表达的检测各组DPSC培养48 h后检测TSG-6、BMP-4、Smad1/5蛋白的表达;7 d后检测DMP-1、DSPP蛋白的表达。使用蛋白提取试剂盒提取细胞总蛋白,在聚丙烯酰胺凝胶上分离后,转印至PVDF膜上,BSA室温封闭2 h,加BMP-4、TSG-6、Smad1/5、DSPP、DMP-1、GAPDH一抗(均按照1∶1 000稀释),4 ℃孵育过夜,加二抗孵育。使用GE Amersham Imager 600曝光蛋白。以目的蛋白与内参GAPDH条带灰度值的比值作为目的蛋白的相对表达水平。实验重复3次。
1.5 皮下异位成骨实验
1.5.1动物分组与处理 BALB/c裸鼠分为正常组和增强组、炎症组和敲低组(n=6),分别采用1.3相应分组处理的DPSC预培养7 d后与水凝胶组合,按照1×106个细胞/注射点注射到裸鼠的背部,每只裸鼠以中线为界在背部左右对称部位各注射1个点。
1.5.2观测指标和方法 实验6周后,观察裸鼠皮下异位成骨情况,切取异位组织,40 g/L多聚甲醛固定过夜,石蜡包埋,切片,并进行HE和MASSON染色。采用SP法进行免疫组化染色,严格按照试剂盒说明书进行操作,OCN和OPN一抗均按照1∶200稀释,光镜下观察异位组织OCN、OPN蛋白的表达情况。
1.6 统计学处理使用SPSS 21.0分析。正常组和增强组,炎症组和敲低组细胞中TSG-6、BMP-4、DSPP、DMP-1、Smad1/5蛋白表达情况,以及皮下异位组织OCN、OPN蛋白表达的比较均采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 细胞中TSG-6、BMP-4、Smad1/5、DMP-1、DSPP蛋白表达见表1、2。与正常组比较,增强组BMP-4、Smad1/5、DSPP、DMP-1蛋白表达水平降低。与炎症组比较,敲低组BMP-4、Smad1/5、DSPP、DMP-1蛋白表达水平升高。
2.2 裸鼠皮下异位成骨正常组和增强组有皮下异位组织形成。HE染色(图1)显示正常组形成的异位组织更接近早期骨组织。MASSON染色(图2)可将胶原纤维染成蓝色,正常组DPSC形成的皮下异位组织富含胶原纤维,而增强组DPSC形成的组织细胞十分密集,且胶原纤维含量较少。正常组和增强组皮下异位组织中OCN和OPN蛋白表达的比较见表3,正常组高于增强组。

表1 正常组和增强组TSG-6、BMP-4、DSPP、DMP-1、Smad1/5蛋白的表达
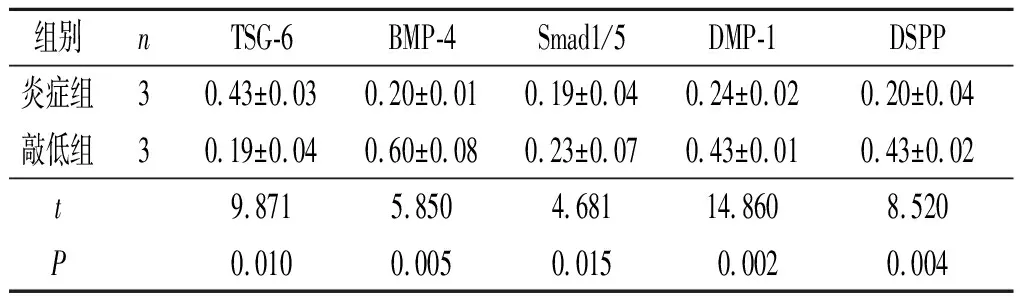
表2 炎症组和敲低组TSG-6、BMP-4、DSPP、DMP-1、Smad1/5蛋白的表达
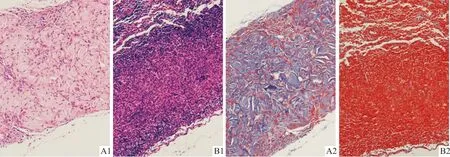
A:正常组;B:增强组
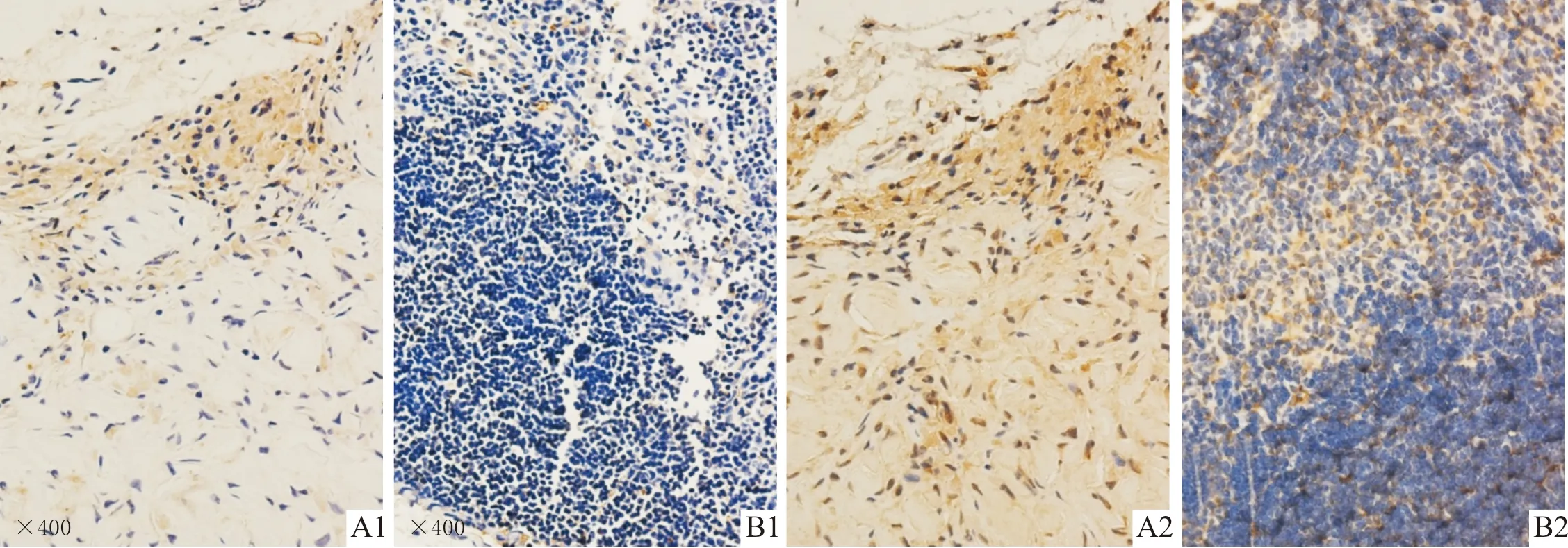
A:正常组;B:增强组
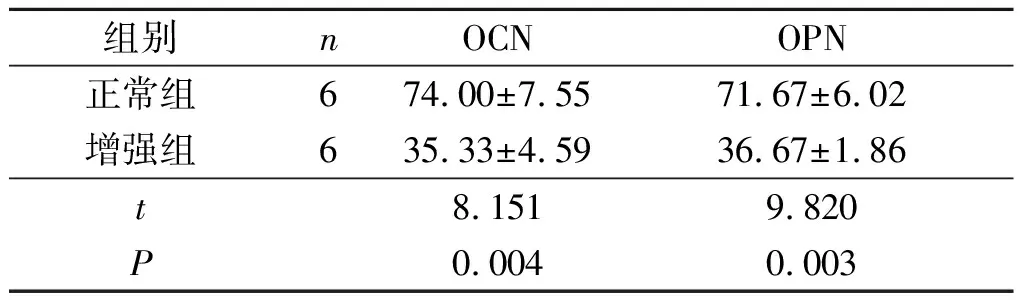
表3 正常组和增强组皮下异位组织中OCN和OPN蛋白的表达
3 讨论
细胞外微环境尤其是炎症微环境会影响间充质干细胞的分化能力[9-10]。研究DPSC在炎症微环境中的变化及其分子机制对牙髓炎症的治疗具有重要意义。本课题组前期研究[11]发现DPSC可高表达TSG-6,提示TSG-6可作为治疗牙髓炎症的新的切入点;此外,还发现高浓度的TNF-α可抑制DPSC的成牙分化。因此本研究选择50 μg/L TNF-α作为实验浓度。
BMP信号在牙齿早期发育中起着重要作用,BMP信号的中断导致牙齿早期发育停滞[12-13]。本研究结果表明,BMP-4/Smad信号通路蛋白随着TSG-6表达水平的改变发生变化,随着TSG-6表达水平的增加,该信号通路受到抑制。矿化诱导液可诱导DPSC中的BMP-4/Smad信号通路激活,以及DPSC的成牙本质向分化;TNF-α体外可以使TSG-6在DPSC中高表达,并抑制DPSC矿化[10]。与正常组比较,增强组细胞中BMP-4、Smad1/5、DMP-1、DSPP蛋白的表达降低,提示TSG-6高表达可抑制DPSC的BMP-4/Smad信号通路和成牙分化能力。与炎症组比较,敲低组细胞中BMP-4、Smad1/5、DMP-1、DSPP蛋白的表达升高,提示下调TSG-6 的表达可以减少炎症对DPSC矿化的抑制作用;也提示在炎症环境中,若降低TSG-6的表达水平,可挽救DPSC的矿化能力,这对牙髓炎的治疗有一定的参考价值。总之,TNF-α通过上调TSG-6的表达来调节BMP-4/Smad信号通路和DPSC的成牙分化能力。
本研究正常组和增强组形成了皮下异位组织,但是正常组的皮下异位组织在组织学形态上更接近于早期骨组织,而增强组的组织形态变异较大。增强组皮下异位组织成牙标志物OCN、OPN蛋白的表达明显低于正常组,进一步提示TSG-6的高表达可抑制DPSC的矿化能力。
总之,TSG-6是DPSC成牙分化过程中的下调蛋白,降低TSG-6的表达可能提高DPSC在炎症环境中的成牙分化能力。

