组织因子途径抑制物2对SD乳鼠心房成纤维细胞和心房肌细胞功能的影响
洪 晋,黄玉起,白中乐,朱记法,张振宇,赵 文,刘献志,董建增
1)郑州大学第一附属医院心血管内科 郑州 450052 2)郑州大学第一附属医院神经外科 郑州 450052 3)郑州大学药学院 郑州 450001 4)首都医科大学附属北京安贞医院心内科 北京 100029
心房颤动(atrial fibrillation,AF)是临床最常见的心律失常之一,在全球范围内造成巨大医疗负担,且发病率逐年增加[1]。心房纤维化是AF发生的结构基础,也是AF进展和维持的重要因素[2],其特征是细胞外基质(extracellular matrix,ECM)积聚、正常组织结构和功能破坏。心脏ECM的主要成分是胶原纤维[2];基质金属蛋白酶类(matrix metalloproteinase,MMP)以MMP-9和MMP-2为代表,在心脏重构过程中发挥重要作用[3]。组织因子途径抑制物2(tissue factor pathway inhibitor-2,TFPI-2)是一种丝氨酸蛋白酶抑制剂[4]。迄今为止有关TFPI-2对心血管疾病影响的研究主要集中在动脉粥样硬化领域:过表达TFPI-2能抑制斑块内MMP水解活化[5],部分敲除TFPI-2可促进斑块局部MMP表达[6],TFPI-2还能影响动脉血管平滑肌细胞的增殖、迁移及凋亡[7],从而抑制动脉粥样硬化进展。本研究从细胞和分子层面着手,探索TFPI-2对参与心房纤维化的心房成纤维细胞和心房肌细胞功能的影响及相关分子机制。
1 对象与方法
1.1 研究对象
1.1.1病例来源 2018年10月至2019年8月在郑州大学第一附属医院心血管内科住院治疗的孤立性AF患者15例(AF组),排除任何可能导致AF的心血管疾病如高血压、冠心病、瓣膜病、先心病、心肌病、心包疾病等,排除可导致AF的其他系统疾病如甲亢、糖尿病、肺部疾病、自身免疫疾病等,排除其他影响TFPI-2水平的疾病或状态如炎症、肿瘤、肝肾功能损伤、妊娠等。所有患者均无其他合并症或既往手术史。选取15名同期体检健康者作为正常对照。入组后均签署知情同意书。本研究经郑州大学第一附属医院伦理委员会审查通过(审批号:2018-KY-38)。
1.1.2动物来源 SPF级出生1~3 d的SD乳鼠,雌雄不限,由河南省实验动物中心提供,动物合格证号:SCXK(豫)2017-0001。
1.2 主要试剂DMEM高糖培养基、胎牛血清(FBS)均购自以色列Biological Industries公司,青链霉素、5-溴脱氧尿苷(5-BrdU)、DAPI均购自北京索莱宝科技有限公司,胰蛋白酶购自美国Amresco公司,Transwell小室购自美国BD公司,Ⅱ型胶原酶购自美国Worthington公司,BCA蛋白浓度测定试剂盒购自美国赛默飞公司,Vimentin抗体购自美国Signalway抗体公司,α-平滑肌肌动蛋白(α-SMA)抗体、Ⅲ型胶原抗体、Ⅰ型胶原抗体、MMP-2抗体均购自美国Proteintech公司,大鼠TFPI-2重组蛋白(rTFPI-2)、TFPI-2检测试剂盒购自武汉Cloud-Clone公司,CCK-8试剂盒购自日本同仁化学公司,细胞凋亡试剂盒购自江苏凯基生物技术股份有限公司,p-Erk1/2抗体、t-Erk1/2抗体、MMP-9抗体均购自美国Abcam公司,PARP抗体购自沈阳万类生物科技有限公司,GAPDH抗体购自北京康为世纪生物科技有限公司。
1.3 AF患者和正常对照血清TFPI-2水平检测抽取AF患者和正常对照静脉血标本4 mL,采用ELISA法检测血清TFPI-2水平。
1.4 原代心房成纤维细胞和心房肌细胞的分离与鉴定取SD乳鼠消毒后取出心脏,D-Hanks液清洗。沿房室沟剪下心房并剪碎至约1 mm3,1 g/L胰蛋白酶4 ℃消化过夜。吸弃胰蛋白酶液,加入0.8 g/L Ⅱ型胶原酶,37 ℃水浴消化至溶液变浑浊,取消化液加入等量含体积分数20%FBS的完全培养基(以青链霉素处理的DMEM高糖培养基)。重复直至组织块消化完全。200目滤网过滤细胞混悬液,离心弃上清,加入体积分数10% FBS的完全培养基重悬细胞。铺板后置于37 ℃、体积分数5% CO2培养箱中培养2 h,心房成纤维细胞贴壁,而心房肌细胞不贴壁,利用差速贴壁法将两种细胞分开。将含心房肌细胞的培养液吸入一新培养皿,同时加入10 g/L 5-BrdU,原培养皿(含心房成纤维细胞)中加入等量含体积分数10% FBS的完全培养基继续培养。取3代以内心房成纤维细胞和原代心房肌细胞进行后续实验。
将细胞接种于24孔板,贴壁培养到细胞融合度达60%,预冷甲醇固定15 min;体积分数0.5% Triton X-100 处理10 min后加体积分数5%FBS室温封闭30 min,加体积分数5%FBS稀释的Vimentin抗体(1∶200稀释)或α-SMA抗体(1∶200稀释),4 ℃过夜;用预冷体积分数0.1% Tween-20漂洗2次,再用预冷PBS漂洗;加入PBS配制的荧光二抗(1∶200稀释)室温避光孵育1 h,预冷体积分数0.1% Tween-20漂洗2次,再用预冷PBS漂洗。DAPI染核30 min后用预冷PBS漂洗。荧光显微镜下观察,拍照。
1.5 rTFPI-2对心房成纤维细胞增殖的影响调节细胞密度为5×104个/mL,将心房成纤维细胞铺于96孔板,每孔100 μL。待细胞生长至融合度达80%,更换含不同质量浓度(0、50、100、200 μg/L)rTFPI-2的完全培养基,培养24、48 h后加入CCK-8溶液,继续孵育4 h,于酶标仪450 nm波长处测定光密度(OD)值,以评价细胞增殖能力。根据该结果选择合适的rTFPI-2浓度进行后续实验。
1.6 rTFPI-2对心房成纤维细胞迁移的影响将约5×104个心房成纤维细胞用无血清培养基重悬、转移到Transwell小室上室(膜孔直径为8.0 μm),分别将不含rTFPI-2(空白对照组)或含有100 μg/L rTFPI-2(rTFPI-2处理组)的无血清培养基加入下室培养24 h。取出小室,用冰甲醇4 ℃固定30 min,室温下用结晶紫染色30 min,轻柔冲洗滤膜后晾干。显微镜(×100)下拍摄滤膜下室面,取6个视野,使用Image J软件计数穿膜细胞,取均值。实验重复3次。
1.7 rTFPI-2对心房成纤维细胞和心房肌细胞凋亡的影响将心房成纤维细胞铺于6孔板中,37 ℃孵育至细胞融合度约70%,更换不含rTFPI-2(空白对照组)或含100 μg/L rTFPI-2(rTFPI-2处理组)的完全培养基孵育48 h。用不含EDTA的胰蛋白酶处理细胞,预冷PBS洗涤两次,2 000×g离心5 min。将细胞重悬于500 μL结合缓冲液中,加入5 μL Annexin V-FITC,并加入5 μL PI,室温避光孵育15 min,上流式细胞仪检测细胞凋亡率。同法检测心房肌细胞凋亡率。实验重复3次。
1.8 rTFPI-2对心房成纤维细胞及心房肌细胞相关蛋白表达的影响心房成纤维细胞和心房肌细胞同1.7分组处理,48 h后收集细胞,提取总蛋白并通过BCA法测定蛋白浓度。每组样品上样20 μg,SDS-PAGE电泳分离蛋白后转印于NC膜,使用50 g/L脱脂牛奶低速摇床室温封闭2 h。加一抗(p-Erk1/2、t-Erk1/2、MMP-9、MMP-2、PARP、Ⅲ型和Ⅰ型胶原抗体均按1∶1 000稀释,GAPDH抗体按1∶2 000稀释)4 ℃孵育过夜。洗膜后,加二抗(1∶10 000稀释)室温孵育2 h。洗膜后加入ECL发光液显影。使用Image J软件对条带灰度值进行分析。计算目的条带和内参(GAPDH)条带灰度值的比值,以实验组此比值与空白对照组均值的比值为实验组目的蛋白的相对表达量。实验重复3次。
1.9 统计学处理应用SPSS 21.0处理数据。采用两独立样本t检验或精确概率法比较正常对照组和AF组临床资料及血清TFPI-2水平的差异,采用单因素方差分析探讨不同浓度rTFPI-2对心房成纤维细胞增殖的影响,两两比较采用SNK-q检验,采用两独立样本t检验比较空白对照组与rTFPI-2处理组心房成纤维细胞迁移、凋亡和相关蛋白表达的差异以及心房肌细胞凋亡和相关蛋白表达的差异。检验水准α=0.05。
2 结果
2.1 AF组和正常对照组临床资料、血清TFPI-2水平比较两组在年龄、性别、BMI、血压等方面差异均无统计学意义,而AF患者血清TFPI-2水平低于正常对照(表1)。

表1 两组临床资料、血清TFPI-2水平的比较(n=15)
2.2 原代心房成纤维细胞和心房肌细胞鉴定本研究采用Vimentin抗体鉴定心房成纤维细胞,α-SMA抗体鉴定心房肌细胞,结果见图1。两种细胞纯度均在90%以上,可用于后续实验。
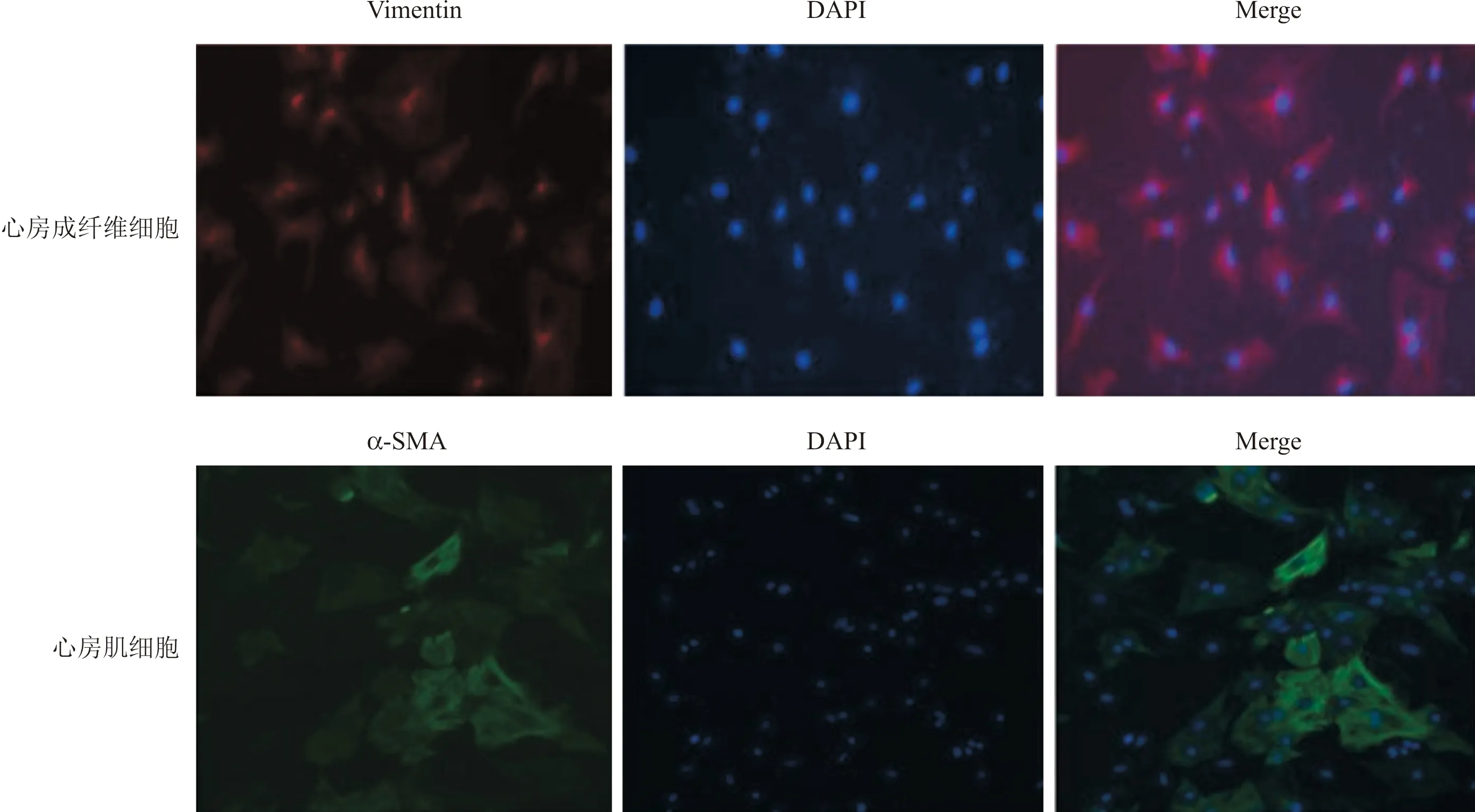
图1 心房成纤维细胞和心房肌细胞免疫荧光鉴定(×200)
2.3 rTFPI-2对心房成纤维细胞增殖的影响不同浓度rTFPI-2处理后心房成纤维细胞增殖活性受到不同程度抑制,且随rTFPI-2浓度升高,抑制作用增强(表2),rTFPI-2浓度为100 μg/L时抑制效果显著,故后续实验rTFPI-2 浓度取100 μg/L。
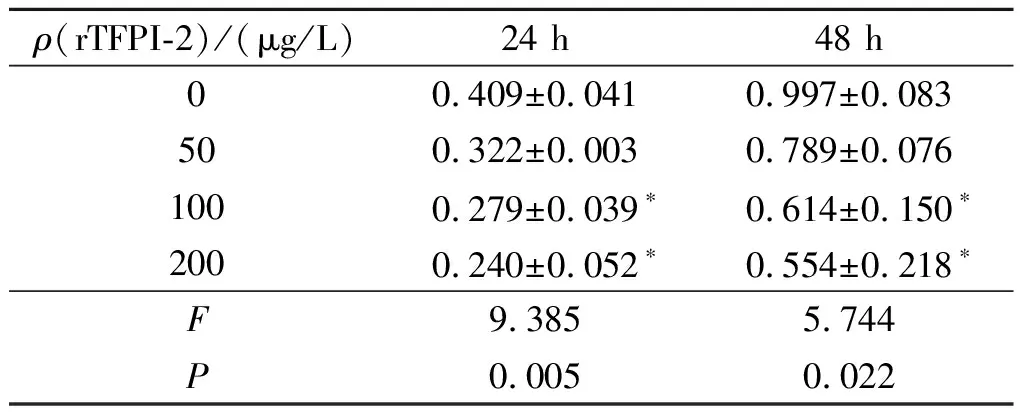
表2 不同浓度rTFPI-2对心房成纤维细胞增殖的影响(n=3)
2.4 rTFPI-2对心房成纤维细胞迁移、凋亡及相关蛋白表达的影响见图2、表3。与空白对照组相比,rTFPI-2处理组迁移细胞减少,细胞凋亡率升高,p-Erk1/2、MMP-9和MMP-2表达降低,PARP表达升高,Ⅲ型、Ⅰ型胶原表达下降。
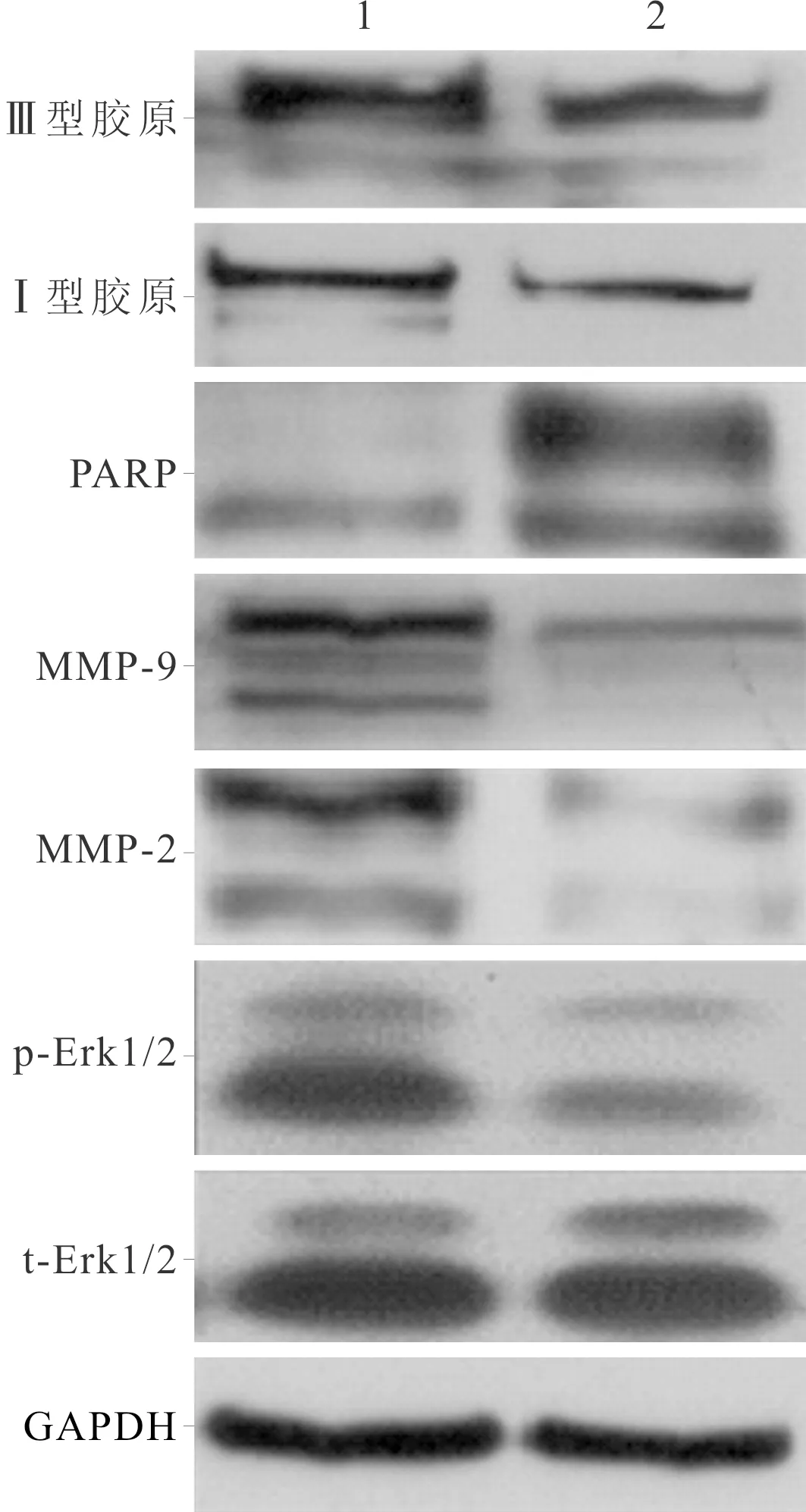
1:空白对照组;2:rTFPI-2处理组
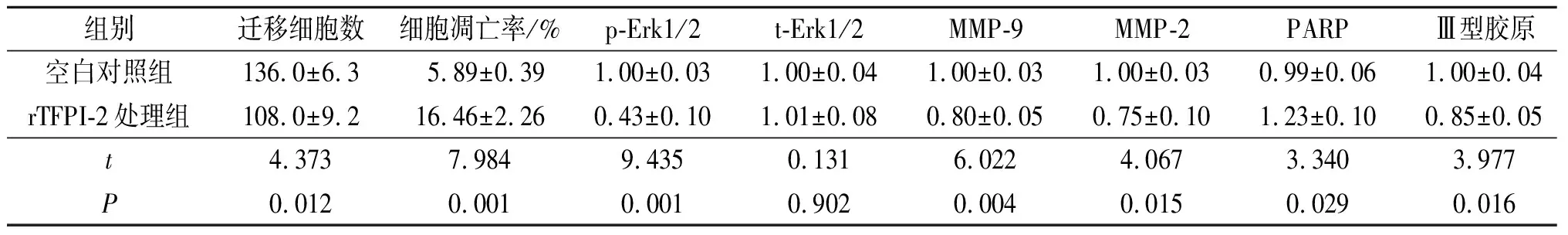
表3 rTFPI-2对心房成纤维细胞迁移、凋亡及相关蛋白表达的影响(n=3)
2.5 rTFPI-2对心房肌细胞凋亡及相关蛋白表达的影响与空白对照组比较,rTFPI-2处理组心房肌细胞凋亡率及PARP蛋白表达无显著改变,但Ⅲ型、Ⅰ型胶原表达下降(图3、表4)。
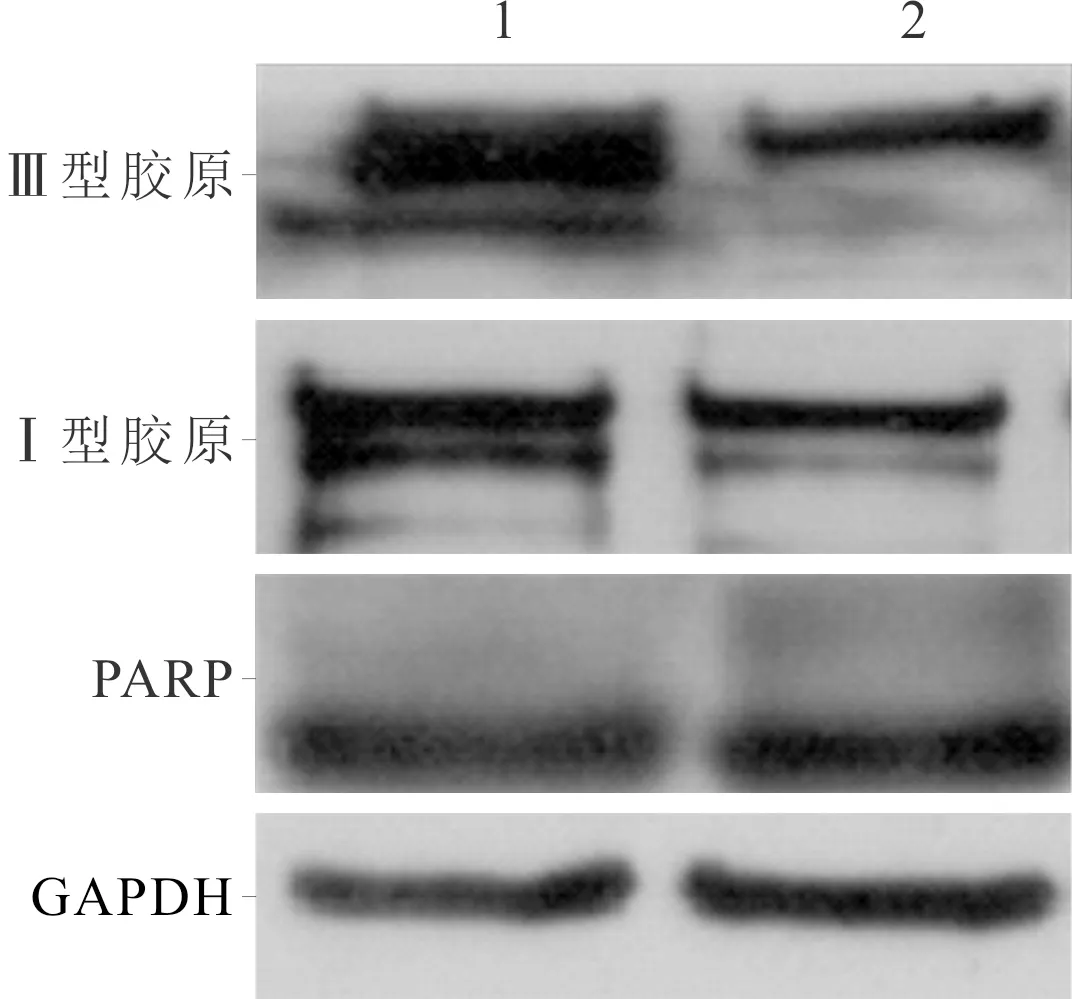
1:空白对照组;2:rTFPI-2处理组
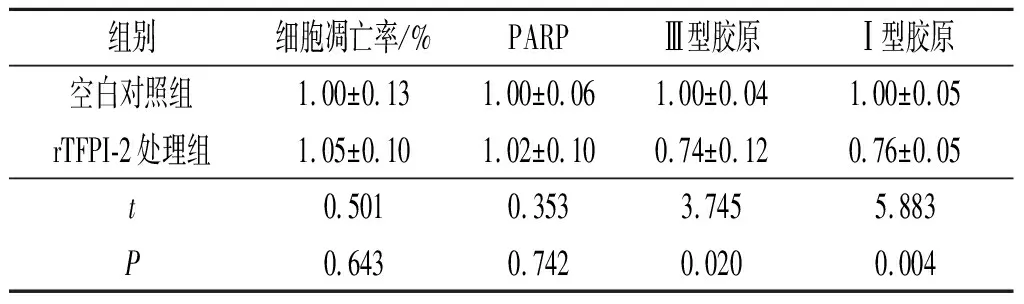
表4 rTFPI-2对心房肌细胞凋亡及相关蛋白表达的影响(n=3)
3 讨论
心房纤维化与AF密切相关,无论是器质性心脏病所致AF还是孤立性AF,心房组织标本中均存在心房纤维化[8]。心房纤维化是心房纤维组织形成及重新分布的过程,涵盖正常细胞丢失和结缔组织增生两方面[2],具体包括心房成纤维细胞增殖迁移、心房肌细胞凋亡丢失、ECM改建[9]。本研究发现AF患者血清TFPI-2较正常人降低,提示TFPI-2可能在AF发生、发展过程中发挥一定作用;后续结果证实TFPI-2可抑制心房成纤维细胞增殖及迁移,并促进心房成纤维细胞凋亡,从而减少心房成纤维细胞数量,有利于限制心房结缔组织增生、减少房内折返发生[10],最终可能预防或延缓AF发生。
既往研究[11]表明细胞增殖及迁移可由p-Erk1/2调控,TFPI-2可降低乳腺癌细胞p-Erk1/2表达从而抑制其增殖及迁移[12]。本研究发现TFPI-2可抑制心房成纤维细胞增殖及迁移,可能与TFPI-2介导的p-Erk1/2表达下调相关。同时细胞迁移过程需要MMP参与[2],而文献[4-5]报道TFPI-2能抑制MMP水解活化。本研究发现TFPI-2能减少MMP-9和MMP-2表达,推测是其抑制心房成纤维细胞迁移的重要机制。
本研究还发现在TFPI-2作用下,心房成纤维细胞凋亡增加,同时促凋亡蛋白PARP表达上调,与胶质瘤细胞凋亡机制的研究[13]结果一致。
另外,本研究结果显示虽然TFPI-2可促进心房成纤维细胞凋亡,但并不增加心房肌细胞凋亡,而心房肌细胞凋亡是心房重构的重要一环[2,9]。心房肌细胞为不可分裂细胞,凋亡越少则存活越多,TFPI-2不增加心房肌细胞凋亡有助于维持心房正常结构。这可能与TFPI-2对心房肌细胞凋亡相关蛋白PARP表达无显著影响有关。此外,有研究[14]发现PARP可抑制心肌细胞收缩,推测TFPI-2可能不会对心房肌细胞收缩功能产生影响,这有助于心房正常功能维持。
除以上细胞组分外,心房纤维化的过程还需要非细胞组分参与,其中以胶原纤维为代表。本研究发现TFPI-2处理后心房成纤维细胞和心房肌细胞产生Ⅲ型胶原和Ⅰ型胶原减少,这两种胶原是心脏ECM的主要成分[2]。在心肌细胞凋亡局部,纤维化的产生不仅需要胶原的填充,同时需要相协调的胶原降解,此时MMP及其抑制物起重要作用[2]。本研究结果显示,TFPI-2可抑制心房成纤维细胞和心房肌细胞MMP-9和MMP-2表达,从而抑制ECM改建,具有抗心房纤维化作用。
综上,TFPI-2对心房成纤维细胞和心房肌细胞存在差异作用,TFPI-2可抑制心房成纤维细胞增殖及迁移,促进其凋亡,但不增加心房肌细胞凋亡,其机制可能与TFPI-2对 p-Erk1/2、MMP-9、MMP-2、PARP的调控有关,TFPI-2还能抑制胶原合成,有可能通过多重机制产生抗心房纤维化作用,具有预防及治疗AF的潜在价值。

