肌电生物反馈结合虚拟现实康复训练治疗脑卒中偏瘫
高君强 冯慧丽 李君辉
三门峡市中医院,河南 三门峡 472000
脑卒中是临床常见脑血管疾病,是由于脑部血管突然破裂或血管阻塞致局部脑组织血液供应障碍,从而导致脑组织缺血损伤的一组疾病[1-5]。脑卒中包括缺血性脑卒中和出血性脑卒中,相对于出血性脑卒中,缺血性脑卒中的发病率较高,占脑卒中总数的60%~70%[6-9]。缺血性脑卒中由于伴随神经损伤,易产生肢体偏瘫,临床表现为身体一侧无法进行正常的活动、肌肉僵硬、肢体功能下降、患侧手脚麻木、步行能力、平衡能力失调等,严重影响患者生活质量,需及时给予治疗[10-15]。虚拟现实康复训练是通过计算机设计三维空间场景进行动态功能康复训练[16],肌电生物反馈是采用肌电活动刺激神经及肌肉,促进其康复的反馈方式,两者均可用于肢体康复治疗[17-22]。本次研究观察肌电生物反馈结合虚拟现实康复训练对脑卒中偏瘫患者平衡功能及生活质量的影响。
1 资料与方法
1.1 研究对象选取三门峡市中医院2020-02—2022-02治疗的脑卒中偏瘫患者128例。单一训练组64例,女27例,男37例;年龄52~84(65.23±3.15)岁,病程(2.54±0.26)个月;患侧:左侧41 例,右侧23 例。联合干预组64 例,女28 例,男36 例;年龄51~85(65.39±3.27)岁,病程(2.27±0.31)个月;患侧:左侧42例,右侧22 例。比较单一训练组及联合干预组一般资料差异无统计学意义(P>0.05),具有可比性,本研究经医院医学伦理委员会批准,患者知情并同意。
1.2 纳入与排除标准纳入标准:(1)符合缺血性脑卒中诊断标准[8],合并痉挛性偏瘫;(2)年龄50~85岁;(3)神志清楚,生命体征平稳,视听功能正常;(4)依从性良好者;(5)单侧肢体偏瘫;(6)患者及家属签署同意书。
排除标准:(1)合并恶性肿瘤、感染病、免疫系统病、凝血功能障碍、血液系统疾病、脏器功能不全者;(2)肢体骨折、关节脱位者;(3)无法进行本次相关量表评价者;(4)合并精神性疾病者;(5)妊娠期或哺乳期患者;(6)心脏起搏器植入者;(7)其他因素所致偏瘫者;(8)无法听从指令、不能完成干预者;(9)依从性差者。
1.3 治疗方法单一训练组患者采用虚拟现实康复训练,在系统中分别选取“驾船”“城市驾车”“小径遭遇”“吊桥步行”“跨步训练”“步行街道”等训练程序进行训练。(1)小径遭遇:患者脱鞋后于侧立板中间取站立位,双上肢前伸抬至肩高,Bobath 式握手,手背上固定球形标志物,使其能被摄像机捕捉,虚拟技术下设置背景为森林小径,小径蜿蜒曲折、高低起伏,引导患者行走,健侧手带动患肢将迎面而来的蚊虫及飞鸟等击落,可增加场景干扰视觉,根据患者状态加大游戏难度。(2)城市驾车:患者在侧立板中间站立,设置背景为驾驶汽车在城市公路上,由患者控制汽车,引导患者红绿灯停驶、转弯,行驶过程中避开周围汽车,通过人体压力前后移动控制速度,在规定时间内尽量行驶最远距离。(3)驾船:设置场景为大海,海面上有少数岛屿、21 个浮标球,患者控制船沿浮标球中指引的箭头航行,速度由前后移动控制,转弯通过左右倾斜控制,行驶期间需避开岛屿及漂浮球,尽量加速到达终点。(4)吊桥步行:患者在运动平台上行走,场景伴随斜坡、左右摇晃等多方位变化,桥下有海水,海面上有飞行的海鸥进行视觉干扰。(5)跨步训练:在系统中设定步行模式,场景中有灰色的方块,踩到灰色方块后方块会变成绿色,方块距离存在差异,患者需根据具体情况调整步伐踩亮方块,时间为1 min。(6)步行街道:对于步行能力较差的患者,对患者设置比较固定的训练模式,如设定固定方向、速度、视觉、音乐干扰等,设置后可出现汽车、皮球等视觉干扰,同时根据患者步速自动调节音乐,通过大脑皮质、脑神经刺激肢体进行运动,利于提升患者运动能力。2次/d,30 min/次,连续干预3个月。
联合干预组患者采用肌电生物反馈结合虚拟现实康复训练,虚拟现实康复训练同单一训练组。肌电生物反馈:患者取平卧位,选择力康生物医疗科技控股有限公司生产的HF3000肌电生物反馈仪,反馈电极置于患侧上肢腕背伸肌群、伸肘肌群,下肢置于胫骨前肌表面,在反馈仪发出信号指令时,引导患者完成翻转手掌、握拳-张开、屈伸肘等动作,让患者尽可能同步患侧肢体与健侧运动;引导患者做足背伸动作,协助肌肉收缩。每个动作重复50 次,每10 次间隔10 s,每次持续30 min,1 次/d,每周干预5 d,连续干预3个月。
1.4 观察指标(1)肌电图:干预前后给予患者表面肌电图仪(上海星宇电子仪器有限公司,JD-4A)检测,检测患侧上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌最大等长收缩时表面肌电图积分肌电值(integrated electromyography,iEMG)以及均方根值(root mean square,RMS),检测患肢M 波最大波幅(Mmax)、H 波最大波幅(Hmax),并计算其比值H/Mmax。(2)临床痉挛指数(clinic spastcity index,CSI)评估:该量表评价患者肌张力、腱反射、阵挛情况,总分16 分,评分与肢体痉挛的程度呈正相关。(3)简易上肢功能评价(simple test for evaluating hand function,STEF):包含手指抓、握,拇指捏、夹等10个检查项目,总分100 分,分数越高,患者上肢功能越好。(4)干预前后通过三维运动捕捉系统分析三维步态,记录患者步频及步速。(5)平衡能力:干预前后给予患者Berg 平衡量表(Berg balance scale,BBS)、脑卒中患者姿势评定量表(postural assessment scale for stroke patients,PASS)评价,BBS 包含站立、坐位站起、无靠背坐立、站立位坐下、转移等14 个动作,总分56 分,分数越高,患者平衡能力越好。PASS 用来评价患者无支持下保持坐位、用患侧下肢站立、从坐位站起、从站位回到坐位等,总分36分,分数越高,患者平衡能力越好。(6)生活质量:干预前后给予患者功能综合评定量表(functional comprehensive assessment,FCA)评价,其对躯体功能、交流、社会认知等进行评价,共18 题,总分108分,分数越高,患者日常生活能力越好。
1.5 临床疗效患者临床症状明显改善,肢体功能明显恢复,基本可独立生活为临床控制;患者临床症状好转,肢体功能好转,基本生活能自理为好转;未达到上述标准为无效[9]。总有效率(%)=(临床控制+好转)/总数×100%。
1.6 统计学方法将以上数据采用SPSS 23.0 软件进行分析,肌电图、各种量表评分、STEF、步频及步速以均数±标准差(±s)表示,若符合正态分布则采取配对t 检验,组间数据采取成组t 检验,不符合正态分布数据采取U 检验;临床疗效采取秩和检验。P<0.05为有统计学差异。
2 结果
2.1 上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌iEMG对比干预后2组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌iEMG 较干预前升高(P<0.05),联合干预组患者明显较单一训练组高(P<0.05),见表1。
表1 2组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌iEMG对比 (±s)Table 1 Comparison of iEMG of upper limb biceps and triceps,lower limb tibialis anterior and gastrocnemius in 2 groups (±s)

表1 2组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌iEMG对比 (±s)Table 1 Comparison of iEMG of upper limb biceps and triceps,lower limb tibialis anterior and gastrocnemius in 2 groups (±s)
注:与本组干预前相比,1)P<0.05;与对照组干预后相比,2)P<0.05
组别单一训练组联合干预组t值P值肱二头肌iEMG/(mV·s)干预前243.37±15.66 242.12±15.15 0.459 0.647干预后20.43±3.761)24.21±4.291,2)5.301<0.001干预后271.25±20.151)293.12±24.211,2)5.555<0.001肱三头肌iEMG/(mV·s)干预前36.23±5.31 36.55±5.23 0.343 0.732干预后62.34±15.151)87.13±17.151,2)8.667<0.001胫骨前肌iEMG/(μV·s)干预前21.13±4.25 20.85±4.68 0.354 0.724干预后33.42±6.491)46.17±8.561,2)9.495<0.001腓肠肌iEMG/(μV·s)干预前15.43±2.21 15.31±2.53 0.286 0.776
2.2 上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌RMS 对比干预后2 组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌RMS较干预前明显升高(P<0.05),联合干预组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌RMS明显较单一训练组高(P<0.05),见表2。
表2 2组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌RMS对比 (±s)Table 2 Comparison of RMS of upper extremity biceps and triceps,lower extremity tibialis anterior and gastrocnemius in 2 groups (±s)
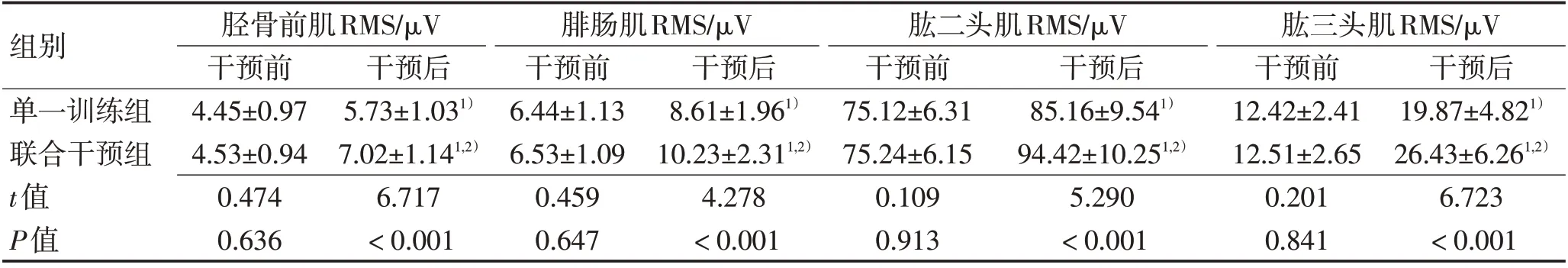
表2 2组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌RMS对比 (±s)Table 2 Comparison of RMS of upper extremity biceps and triceps,lower extremity tibialis anterior and gastrocnemius in 2 groups (±s)
注:与本组干预前相比,1)P<0.05;与单一训练组干预后相比,2)P<0.05
组别单一训练组联合干预组t值P值胫骨前肌RMS/μV干预前4.45±0.97 4.53±0.94 0.474 0.636干预后5.73±1.031)7.02±1.141,2)6.717<0.001腓肠肌RMS/μV干预前6.44±1.13 6.53±1.09 0.459 0.647干预后8.61±1.961)10.23±2.311,2)4.278<0.001肱二头肌RMS/μV干预前75.12±6.31 75.24±6.15 0.109 0.913干预后85.16±9.541)94.42±10.251,2)5.290<0.001肱三头肌RMS/μV干预前12.42±2.41 12.51±2.65 0.201 0.841干预后19.87±4.821)26.43±6.261,2)6.723<0.001
2.3 Mmax、Hmax、H/Mmax对比干预后2组患者Mmax、Hmax、H/Mmax较干预前降低(P<0.05),联合干预组患者Mmax、Hmax、H/Mmax 较单一训练组低(P<0.05),见表3。
表3 2组患者Mmax、Hmax、H/Mmax对比 (±s)Table 3 Comparison of Mmax,Hmax and H/Mmax between the two groups (±s)
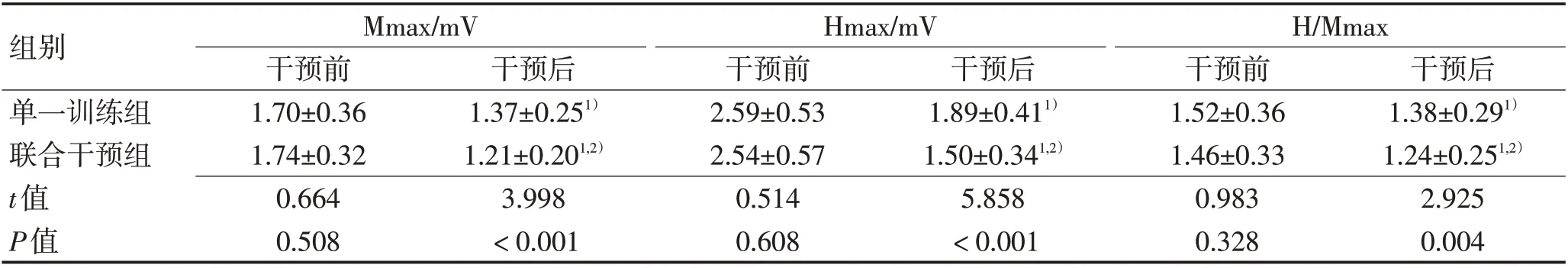
表3 2组患者Mmax、Hmax、H/Mmax对比 (±s)Table 3 Comparison of Mmax,Hmax and H/Mmax between the two groups (±s)
注:与本组干预前相比,1)P<0.05;与单一训练组干预后相比,2)P<0.05
组别单一训练组联合干预组t值P值Mmax/mV干预前1.70±0.36 1.74±0.32 0.664 0.508干预后1.38±0.291)1.24±0.251,2)2.925 0.004干预后1.37±0.251)1.21±0.201,2)3.998<0.001 Hmax/mV干预前2.59±0.53 2.54±0.57 0.514 0.608干预后1.89±0.411)1.50±0.341,2)5.858<0.001 H/Mmax干预前1.52±0.36 1.46±0.33 0.983 0.328
2.4 CSI、STEF 评分、步频、步速对比干预后2 组患者STEF 评分、步频及步速升高(P<0.05),联合干预组患者STEF 评分、步频及步速高于单一训练组(P<0.05)。2 组患者CSI 评分较干预前降低(P<0.05),联合干预组患者CSI 评分较单一训练组低(P<0.05)。见表4。
表4 2组患者CSI、STEF评分、步频、步速对比 (±s)Table 4 Comparison of CSI,STEF scores,step frequency and step speed between the two groups (±s)

表4 2组患者CSI、STEF评分、步频、步速对比 (±s)Table 4 Comparison of CSI,STEF scores,step frequency and step speed between the two groups (±s)
注:与本组干预前相比,1)P<0.05;与单一训练组干预后相比,2)P<0.05
组别单一训练组联合干预组t值P值CSI评分/分干预前11.22±2.31 11.04±2.03 0.468 0.640干预后7.13±1.041)5.19±1.051,2)8.709<0.001 STEF评分/分干预前57.67±5.05 58.12±5.12 0.501 0.618干预后62.17±6.591)73.12±8.061,2)8.414<0.001步频/(次/min)干预前58.79±6.21 57.93±5.26 0.853 0.396干预后75.46±10.481)86.05±12.641,2)5.160<0.001步速/(cm/s)干预前33.67±6.18 33.12±6.12 0.506 0.614干预后45.17±10.891)53.12±12.761,2)3.791<0.001
2.5 PASS、BBS、FCA 评分对比干预后2 组患者PASS、BBS、FCA 评分较干预前升高(P<0.05),联合干预组患者PASS、BBS、FCA评分较单一训练组明显高(P<0.05),见表5。
表5 2组患者PASS、BBS、FCA评分对比 (±s)Table 5 Comparison of PASS,BBS and FCA scores between the two groups (±s)
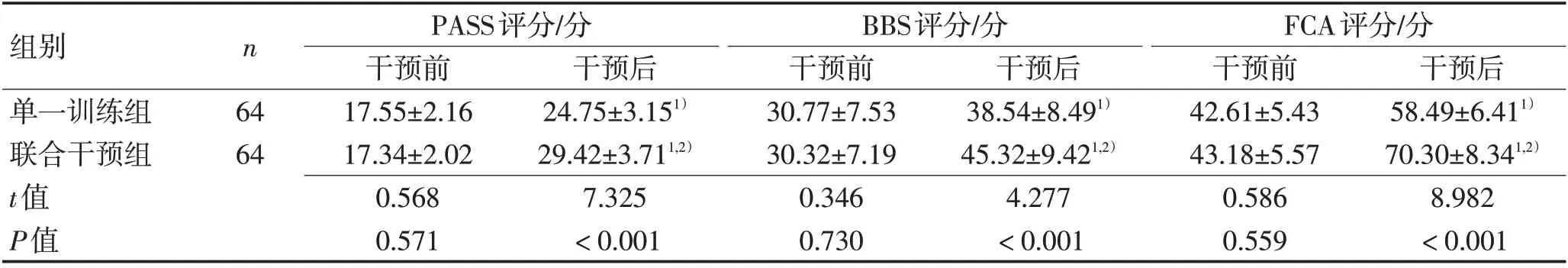
表5 2组患者PASS、BBS、FCA评分对比 (±s)Table 5 Comparison of PASS,BBS and FCA scores between the two groups (±s)
注:与本组干预前相比,1)P<0.05;与单一训练组干预后相比,2)P<0.05
组别单一训练组联合干预组t值P值n 64 64 PASS评分/分干预前17.55±2.16 17.34±2.02 0.568 0.571干预后24.75±3.151)29.42±3.711,2)7.325<0.001 BBS评分/分干预前30.77±7.53 30.32±7.19 0.346 0.730干预后38.54±8.491)45.32±9.421,2)4.277<0.001 FCA评分/分干预前42.61±5.43 43.18±5.57 0.586 0.559干预后58.49±6.411)70.30±8.341,2)8.982<0.001
2.6 2组临床疗效对比联合干预组患者总有效率高于单一训练组(P<0.05),见表6。
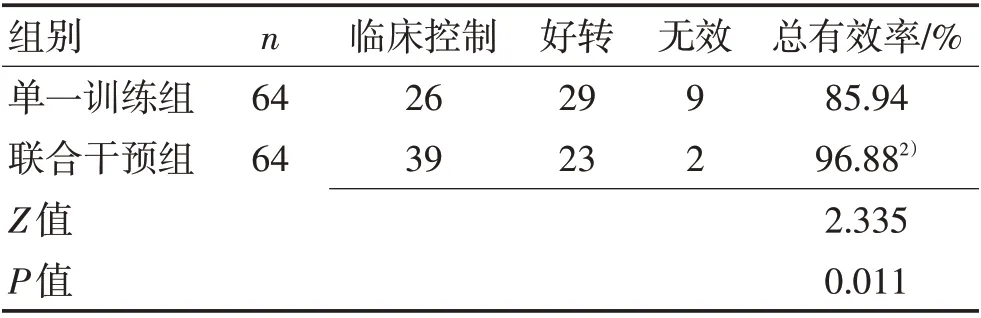
表6 2组临床疗效对比Table 6 Comparison of clinical efficacy between the two groups
3 讨论
缺血性脑卒中是动脉血管产生病变堵塞,致脑组织缺血、缺氧损伤,发病率及致残率高,85%~90%的脑卒中患者合并功能障碍,以偏瘫为主,严重影响患者生命质量[23-30]。缺血性脑卒中发病的常见原因是动脉粥样硬化斑块,斑块脱落可堵塞血管,导致脑组织血液、氧供应不足,损伤相应神经系统[31]。若伴随调控运动系统的中枢神经系统损伤,可促使皮层以下的中枢运动,影响肢体肌群间的协调性,减弱对脊髓牵张反射的脊髓运动神经元的抑制作用,脊髓中枢释放兴奋,肌肉张力增加,诱发肢体肌张力异常、肢体运动障碍,进而诱发偏瘫[32]。
虚拟现实康复训练主要通过逼真的三维听、触、视一体化的虚拟环境,患者借助相应设备与虚拟世界中的物体互动进行康复训练,互动期间自身感觉身临其境,提升训练趣味。虚拟现实康复含有双重任务训练、感觉干扰训练,增加虚拟现实技术平衡训练,进而提高偏瘫患者中枢组织能力、前庭觉信息的整合能力,提高患者姿势稳定性,还可增强患者肌肉力量、肢体运动功能[33]。肌电生物反馈是通过皮肤表面电极建立反馈通路,对神经肌肉刺激产生去极化、复极化过程,利于神经功能恢复,放大患者肌肉收缩时的微弱电信号,将可视听信号反馈给患者,能指导患者运动,提高患者治疗主观能动性,刺激其运动感知能力,提升机体运动功能、调节功能。电刺激脑神经细胞信号可反馈给患者进行联系,促进患者受损神经通路修复,促进肌肉收缩,改善痉挛,对患者异常的姿势及运动产生纠正作用[15]。
表面肌电图是一种记录肌肉活动时生物电信号,反映神经肌肉系统功能的无创检测手段。RMS反映肌肉活动时运动单位同步化程度、运动单位激活数量,iEMG 体现肌肉在单位时间内收缩特性,反应肌肉活动状态[34]。本研究中联合干预组患者上肢肱二头肌、肱三头肌,下肢胫骨前肌、腓肠肌iEMG、RMS 明显较单一训练组高,说明肌电生物反馈结合虚拟现实康复训练治疗脑卒中偏瘫,可调节患者上下肢肌电图指标。脑卒中后痉挛性偏瘫伴随脊髓α运动神经元兴奋,H 波、M 波可反映α运动神经元的兴奋性[17]。联合干预组患者Mmax、Hmax、H/Mmax较单一训练组低,说明肌电生物反馈结合虚拟现实康复训练治疗脑卒中偏瘫患者,可抑制脊髓运动神经元兴奋性。联合干预组患者STEF、PASS、BBS、FCA 评分,步频及步速高于单一训练组,CSI 评分较单一训练组低,总有效率高于单一训练组,说明肌电生物反馈结合虚拟现实康复训练治疗脑卒中偏瘫患者,可改善肢体痉挛状态,提升患者上下肢肢体功能,改善平衡能力,提升临床疗效及生活质量。

