应用CRISPR/Cas9技术构建fto基因敲除小鼠模型
华 卉,夏 静,贾慧婕,葛禹辰,汪小波*
(1.大理大学基础医学院,云南大理 671000;2.云南省高校细胞生物学重点实验室,云南大理 671000)
肥胖作为影响全世界居民健康和人口素质的严重社会问题之一,会导致一系列并发症或者相关疾病的发生,包括发病率极高的糖尿病、高血压病、冠心病等。在过去几十年的基础研究中发现,肥胖与遗传因素密切相关。2007年,通过全基因组关联研究首次发现fto基因与肥胖发生具有高度相关性〔1〕。肥胖基因相关蛋白(fat mass and obesity-associated protein,FTO)是一个依赖亚铁离子和2-氧戊二酸的核酸去甲基化酶,属于ALKB家族,可以催化N6-甲基腺嘌呤(N6-methyladenosine,m6A)去甲基化。m6A影响mRNA的稳定性〔2〕和mRNA的翻译效率〔3〕,在细胞分化〔4〕、胚胎发育〔5〕和肿瘤发生〔6〕等过程中起着重要的作用,作为m6A去甲基化酶的FTO对这些生物学功能的执行发挥着重要的调控作用。因此,构建fto基因敲除小鼠模型可为FTO生物学功能研究提供重要材料。
CRISPR/Cas9基因编辑技术来源于细菌和古细菌在不断演化过程中形成的适应性免疫防御功能。1987年,日本大阪大学Nakata实验室发现了一种与大肠埃希菌基因及其邻近序列高度同源的重复序列,将其命名为CRISPR序列。研究过程中还发现了许多与之相关的双链DNA核酸酶,并将其命名为Cas蛋白〔7〕。CRISPR/Cas9系统的简单原理如下:当病毒入侵细菌时,细菌体内的CRISPR会对病毒DNA进行转录,此时CRISPR就像一个数据库一样将很多病毒DNA记忆储存下来,当相同的病毒再次入侵时,细菌体内的Cas蛋白就会配合CRISPR将病毒的DNA剪切下来,随后细菌启动DNA重组修复机制进行自身遗传信息的恢复,从而沉默外源基因,达到免疫防御的作用。相比前几代基因编辑技术,CRISPR/Cas9系统基因编辑技术不仅能够特异性地识别及敲除靶向基因,介导基因修饰,而且更加快速、简便、准确,因此CRISPR/Cas9系统被开发成一种高效的基因编辑工具。2012年,J inek等在哺乳动物细胞模型中成功应用这一基因编辑技术〔8〕。CRISPR/Cas9基因编辑技术因其众多优点而广泛应用于生命科学的各个领域,表现出极大的应用价值。
本研究旨在通过CRISPR/Cas9基因编辑技术对fto基因进行修饰,构建fto基因敲除模型,并成功繁育出fto基因敲除的纯合子小鼠,对fto基因敲除小鼠从基因组和蛋白质水平进行鉴定,为后续FTO的生物学功能研究提供动物模型。
1 材料与仪器
1.1 材料 运用CRISPR/Cas9基因编辑技术,通过显微注射正常小鼠受精卵特异性敲除fto基因,对出生的小鼠进行聚合酶链式反应(polymerase chain reaction,PCR)和DNA测序鉴定,获得3只阳性F0代小鼠(1雄2雌)。小鼠品系均为C57BL/6J,由赛业(苏州)生物科技有限公司提供,生产许可证号:SCXK(苏)2018-0003,使用许可证号:SYXK(苏)2016-0011,SPF级条件饲养。本实验方案遵循动物福利和伦理原则,符合伦理规范要求。
1.2 主要试剂及仪器 乙二胺四乙酸(EDTA,索莱宝科技有限公司,批号:E1170);DNA提取液(0.2 mmol/L EDTA、25 mmol/L NaOH);Tris-HCl(40 mmol/L,pH=4.0,生工生物工程有限公司,批号:E402KA8103);1.1×Taq Master Mix(北京擎科新业生物技术有限公司,批号:TSE030);Antibody-GAPDH(Abcam,批号:AB181602);Antibody-FTO(Abcam,批号:AB92821);Secondaryantibodies(Abcam,批号:7076P2);PVDF膜(美国BIO-RAD公司,批号:D9160172);Primer F1、Primer R1、Primer R2(北京擎科新业生物技术有限公司,批号:T08629/T08630/T08631);琼脂糖(德国Biofroxx,批号:EZ3454B228);GenecolourⅡ型核酸染料(北京金博益生物技术有限公司,批号:J620161018-2);DNA Marker(北京S olarbio科技有限公司,批号:20160126);PCR扩增仪(Gene Company Limited);水平电泳仪(北京六一生物科技有限公司);美国伯乐bio-red电泳仪(美国BIO-RAD公司);化学发光凝胶成像系统(美国BIO-RAD公司)。
2 方法
2.1fto基因敲除小鼠模型的构建 小鼠fto基因全长355 066 bp,位于小鼠8号染色体。根据fto靶基因的设计原则,将fto基因片段的第3个外显子作为靶点。见图1。使用CRISPR Design软件筛选出2条所需的gRNA作为向导RNA指导剪切。见表1。将筛选得到的gRNA寡核苷酸单链经退火形成双链,连接退火产物与基本载体获得连接产物,继而转化为感受态并涂平板进行过夜培养;之后挑取单个菌落,通过PCR筛选阳性产物并进行扩增,最后通过测序来验证所得到的扩增产物,最终成功构建出CRISPR载体。制备Cas9转录模板,先将PX330质粒线性化,然后用体外转录试剂盒将线性化的DNA转录成RNA,之后PCR扩增gRNA,胶回收PCR产物,用体外转录试剂盒把PCR产物转录成RNA并用电泳鉴定转录的RNA是否降解,将电泳合格的RNA用RNA纯化试剂盒纯化,再次电泳鉴定纯化后的RNA,最后将体外转录纯化后的RNA显微注射入小鼠受精卵。选取合适年龄的雌鼠与结扎雄鼠合笼,获取代孕母鼠后,将注射RNA的受精卵移植入代孕母鼠的子宫内,最终得到F0代小鼠。
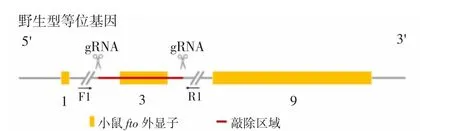
图1 小鼠fto基因敲除策略
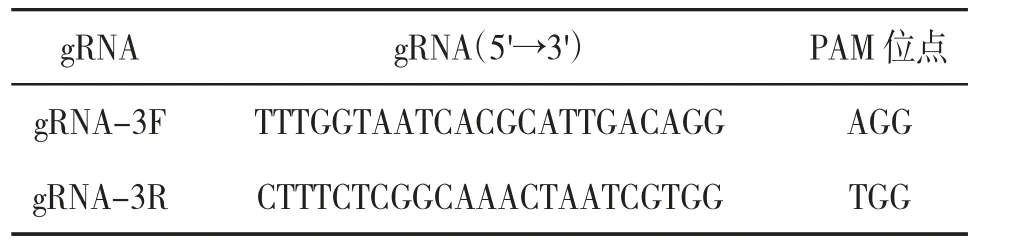
表1 gRNA序列信息
2.2fto基因敲除小鼠的饲养和繁殖 经CRISPR/Cas9技术编辑获得的F0代小鼠饲养于大理大学实验动物中心。F1代小鼠由阳性F0代小鼠(满8周)与同龄C57BL/6J野生型小鼠(wild type,WT)回交获得。通过PCR扩增和琼脂糖凝胶电泳显示的条带来鉴定所删除片段的大小,确定杂合F1代小鼠并保种建系,重复上述步骤以获得更多的F1代杂合小鼠。将上述获得的杂合F1代小鼠分笼饲养,待小鼠性成熟后进行合笼,最终得到需要的纯合子小鼠,即fto基因敲除小鼠。
2.3fto基因敲除小鼠基因型鉴定
2.3.1 小鼠基因组DNA提取 剪取小鼠尾尖2~5 mm,置于200μL PCR管中,将尾尖离心至管底,加25μL DNA提取液溶解组织,在PCR扩增仪中95℃加热40 min,冷却后加入25μL Tris-HCl进行中和,得到小鼠基因组DNA。
2.3.2 PCR扩增反应 未敲除fto基因,即野生型小鼠的凝胶成像结果显示为无条带,而删除的片段过大,阳性小鼠的凝胶成像结果也显示为无条带,故加入引物R2。见图2。引物序列如下,WT引物:F1:5′-GGGCAGTTACTCTCCTTACTCAG-3′,R2:5′-CAATCCGACTTGTTCCCTCTCAG-3′,野生型片段:554 bp;Mutant(突变型)引物:F1:5′-GGGCAGT TACTCTCCTTACTCAG-3′,R1:5′-CGGTTTGCACAG GAAGTTCTAATAC-3′,纯合子片段:729 bp。PCR反应体系为:17μL 1.1×Taq Master Mix;1.0μL F1+R1+R2;2.0μL小鼠基因组DNA模板。PCR程序见表2。
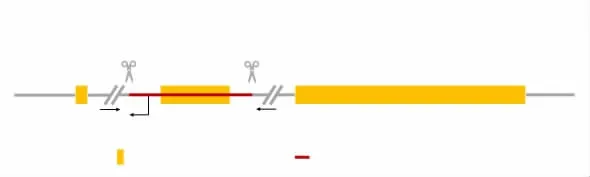
图2 小鼠fto基因上下游引物设计位点
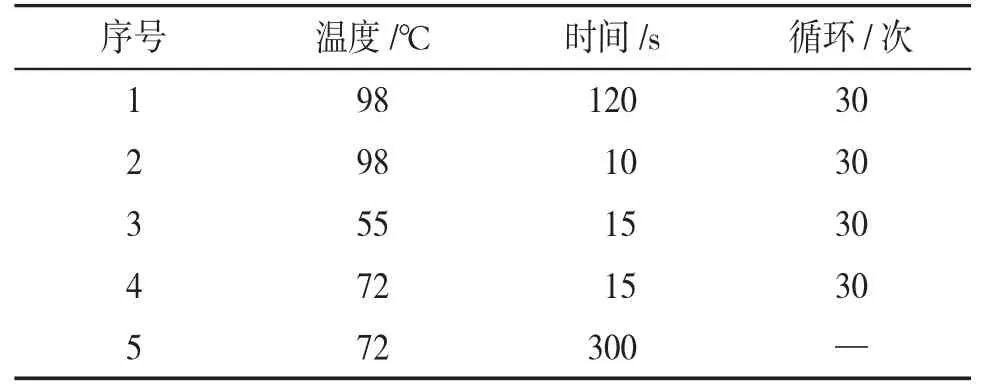
表2 降落PCR程序
2.3.3 基因型鉴定 在制备好的1.5%琼脂糖凝胶上加样:5μL PCR扩增产物,3μL DNA Marker,120 V恒压电泳至凝胶2/3处,通过凝胶成像仪获取条带,用BIO-RAD凝胶分析系统进行分析。
2.3.4 基因型结果判定标准 根据设计原则,野生型小鼠PCR产物片段大小为554 bp,经CRISPR/Cas9基因编辑技术处理后,小鼠fto基因位点发生突变导致异常表达,因此fto基因敲除纯合子小鼠电泳条带为729 bp,fto杂合子小鼠的电泳条带为554 bp与729 bp同时存在。
2.4 验证fto基因敲除 分别取fto纯合子小鼠肝脏、骨骼肌、心脏、脂肪和肾脏,提取组织总蛋白。浓缩胶使用80 V恒压电泳,分离胶使用110 V恒压电泳;转膜条件为150 mA,1.5 h。室温下用5%脱脂牛奶封闭1 h后,FTO一抗4℃冰箱孵育过夜,第2天室温下二抗孵育1 h。最后使用高灵敏ECL发光试剂通过BIO-RAD凝胶分析系统曝光检测蛋白表达情况。结果判定:若58 kDa处出现1条条带,说明FTO蛋白表达,为WT小鼠;若无条带出现,则为fto基因敲除小鼠。
3 结果
3.1 成功构建fto基因敲除的F0代小鼠 通过显微注射技术将CRISPR/Cas9载体成功注入正常小鼠(C57BL/6J)受精卵中,选取存活受精卵移植于已孕雌鼠体内,最终获得F0代小鼠。用琼脂糖凝胶电泳鉴定F0代小鼠基因型,结果表明,编号3、4、7的小鼠和C57BL/6J野生型小鼠经基因型比对碱基缺失,条带显示为729 bp,其余小鼠为554 bp,属WT基因型。见图3。初步证明小鼠fto基因发生突变,成功构建fto基因敲除小鼠。
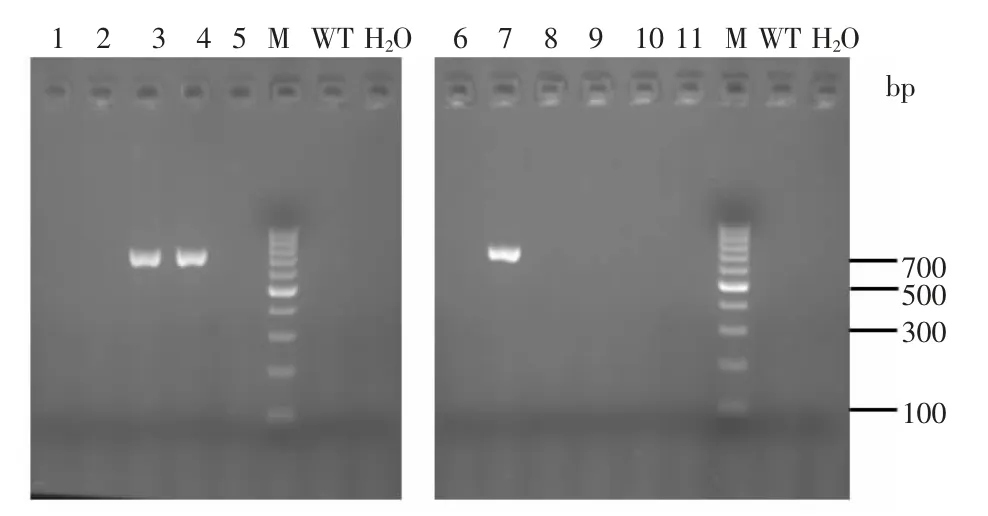
图3 F0代小鼠fto基因PCR产物电泳图
3.2 成功建立fto基因敲除小鼠模型 将F0代小鼠与C57BL/6J野生型小鼠回交以获得更多F1代小鼠,用于保种建系。将上述获得杂合的F1代小鼠合笼饲养,得到最终需要的纯合子小鼠。即fto基因敲除小鼠。见图4。
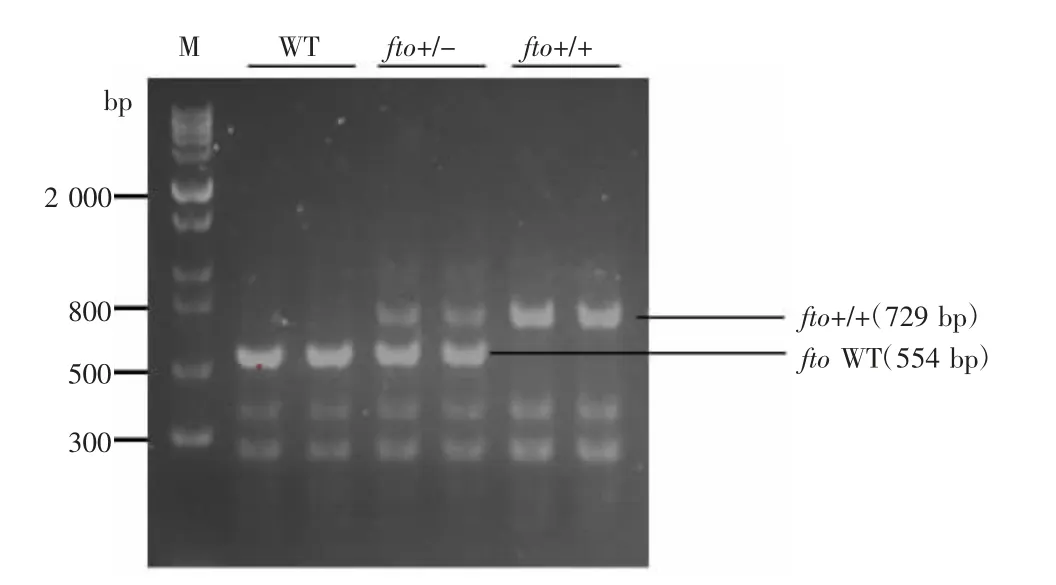
图4 小鼠基因PCR产物电泳图
3.3fto基因敲除小鼠蛋白表达情况 用蛋白质印迹法(Western Blotting)检测FTO蛋白在WT小鼠和fto基因敲除小鼠中的表达情况。FTO蛋白分子量为58 kDa,内参使用甘油醛-3-磷酸脱氢酶(GAPDH)分子量为37 kDa。在WT小鼠主要组织中可见分子量为58 kDa的FTO蛋白表达,而在fto基因敲除小鼠中未检测到FTO蛋白表达。见图5。表明fto基因敲除小鼠模型构建成功,可用来进行后续的动物实验。
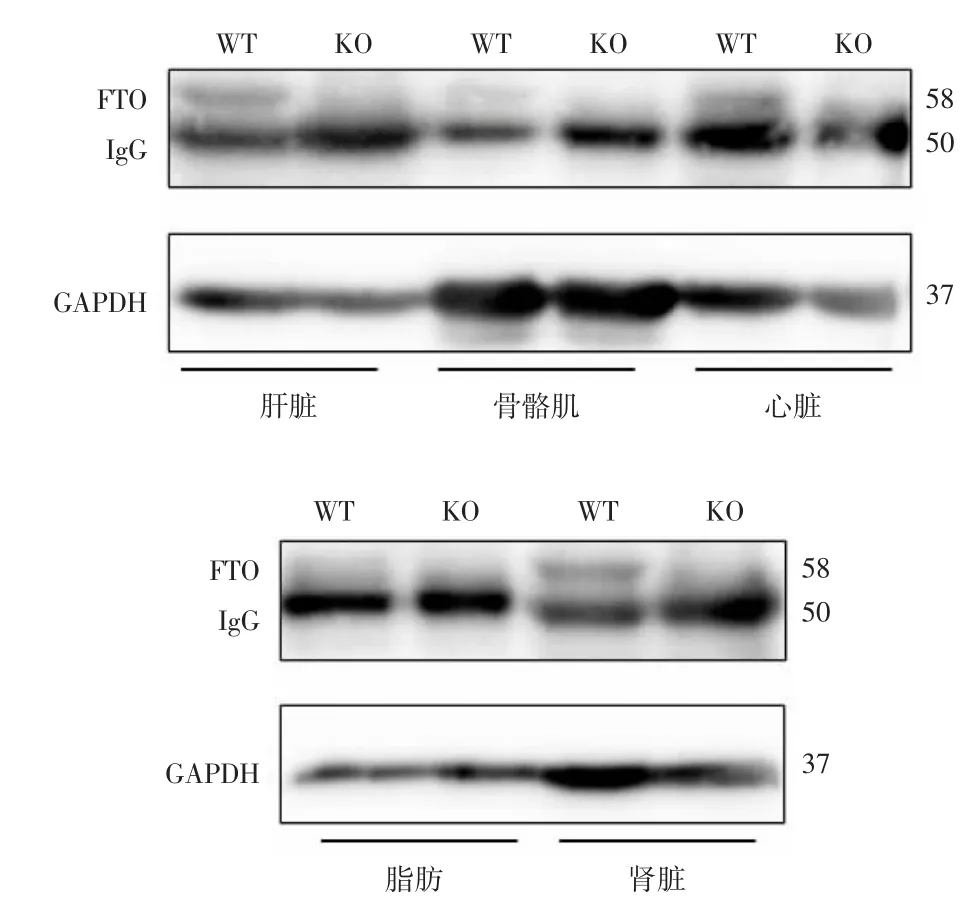
图5 Western Blotting检测FTO蛋白表达情况
4 讨论
经全基因组关联(genome-wide association,GWA)扫描发现,fto基因中常见的遗传变异与体质指数(body mass index,BMI)、臀围和体质量的实质性变化有关,并且怀疑这些变化可能与肥胖相关疾病的发生有关〔1〕。后来又针对极早发性肥胖症进行了GWA,证实了fto突变确实是导致早发性肥胖症的主要原因〔9〕。Church等〔10〕基于FTO是核酸去甲基化酶的特性,构建了FTO点突变(I367F)的小鼠,此位点突变会抑制FTO去甲基化酶活性,以此来验证FTO酶活性与肥胖的关系。他们发现FTO点突变的小鼠也表现出体质量减轻的表型,但只有脂肪组织质量下降,瘦体质量没有变化,对小鼠的摄食也没有影响。Fischer等〔11〕研究表明,fto基因缺失小鼠的脂肪组织质量和瘦体质量都明显下降,似乎说明抑制fto就可以达到减肥的效果;但是,fto基因缺失会造成小鼠较高围产期死亡率(约50%)和出生后发育滞后,提示fto基因对小鼠发育至关重要。除小鼠外,Osborn等〔12〕在fto基因缺失的斑马鱼体系中同样发现了明显的生长迟滞现象。在本研究中也同样发现fto纯合子小鼠具有较高的产后死亡率及出生后发育迟缓等特点。
虽然fto基因突变确实是导致早发性肥胖症的主要原因,但由于FTO对生长发育必不可少,因此将其作为m6A去甲基化酶成为学者新的相关研究热点〔13〕。研究发现FTO在神经发生、学习和记忆相关等方面发挥着重要的作用〔14〕;在衰竭小鼠的模型中使FTO过表达可以改善缺血诱导的m6A增加和心脏收缩功能,减少纤维化并增强血管生成〔15〕。FTO也被证明和骨骼肌的质量有关,在成肌细胞分化过程中,FTO的表达量增多;在进一步的机制研究中发现,FTO可以下调线粒体的生物发生和能量产生,并通过mTOR-pGC-1α通路参与成肌细胞分化,为FTO对骨骼肌分化的贡献提供了第一个证据〔16〕。通过对小鼠巨噬细胞fto基因的特异性敲除,发现巨噬细胞的活化被阻碍,为巨噬细胞极化相关疾病的分子机制开辟新的途径〔17〕。通过构建内皮fto基因缺陷小鼠,发现小鼠糖耐量异常和胰岛素抵抗作用减弱,还可以防止肥胖型高血压的发展;这一结果表明内皮fto基因在肥胖诱导的代谢和血管改变的发展过程中是一种未知的调节因子,该调节因子独立于其在肥胖调节中的已知功能发挥作用〔18〕。
FTO还参与肿瘤的发生发展。FTO产生的m6A去甲基化酶会促进黑色素瘤的生长,并降低抗PD-1阻断免疫疗法的反应,这表明FTO抑制剂和抗PD-1阻断剂的联合使用可能会降低黑色素瘤对免疫疗法的耐药性〔19〕。近年来,FTO抑制剂在多种癌症的治疗中起到了强大的抗肿瘤作用。研究发现,FTO在肿瘤干细胞自我更新和免疫逃逸中起着关键作用,靶向FTO用于癌症治疗具有广阔的潜力〔20〕。
fto基因已被证明不仅与脂肪和肥胖相关,还与神经、骨骼、心脏等各器官的发育以及肿瘤的发生发展密切相关,为预防和治疗临床相关疾病提供了新的契机。本研究通过使用CRISPR/Cas9技术对小鼠受精卵进行fto基因的特异性敲除,经基因和蛋白的测定确定已经成功构建fto基因全身敲除小鼠。将F0代fto基因敲除小鼠与同品系(C57BL/6J)野生型小鼠交配得到F1代小鼠用于保种建系,最后经杂合子杂交成功培育出fto纯合子后代。观察发现fto纯合子小鼠体型较野生型小鼠小,行动迟缓,生长发育缓慢;fto基因敲除小鼠的各个器官均未缺失,但将雌雄小鼠合笼后发现fto纯合子小鼠不能生育,其不孕不育的原因有待进一步研究。已有研究证明,FTO的表达与卵巢功能不全(premature ovarian insufficiency,POI)有关,在POI患者和POI小鼠模型中都检测到m6A含量升高,而m6A的表达与FTO有关〔21〕。FTO作为m6A去甲基化酶在生命发展过程中极其重要,本实验为以后临床疾病的研究提供了动物模型基础。

