薏苡仁提取物对糖尿病肾病大鼠肾功能的作用及机制研究
彭湘,陈丽,薛琳
(攀枝花市中心医院 肾病内科,四川 攀枝花617067)
糖尿病肾病是糖尿病的常见并发症之一,也是终末期肾病的主要原因[1]。临床以早期肾小球、肾小管肥大,晚期肾小球硬化、纤维化等复杂的结构改变为特点[2]。肾脏的氧化应激、炎症反应及代谢异常是肾功能恶化的主要原因[3]。肾脏活性氧过多和代谢异常会导致细胞蛋白激酶C 亚型活化[4],以及细胞核因子-κB(NF-κB)和转化生长因子-β1(TGF-β1)过度表达,这些异常的炎症反应最终导致肾小球硬化和肾间质纤维化[5]。TGF-β1作为一种与肾纤维化密切相关的细胞因子,可激活肾小管上皮细胞蛋白激酶C 和上皮间质转化,最终导致肾间质纤维化[6]。Toll 样受体在肾炎的发生、发展中也起着重要作用[7]。Toll 样受体可通过激活NF-κB和髓样分化因子88(myeloid differentiation factor, MyD88)产生炎症细胞因子,包括IL-8、IL-6等[8],在这个过程中,MyD88 起到了肾脏炎症的放大作用[9]。薏苡仁提取物(Coix seed extract, CES)为禾本科植物薏苡的干燥成熟种仁提取物,可有效促进新陈代谢,具有促进体内血液和水分的新陈代谢、利尿、消水肿等作用[10]。药理研究表明,CSE 对2 型糖尿病大鼠具有抗氧化和降血糖的生物活性。同时,还有利于糖尿病肾病的肾脏修复,其生物活性与其调节血糖、血脂水平及改善肾功能有关[11]。本研究通过复制糖尿病肾病大鼠模型,探讨CSE 保护糖尿病肾病大鼠肾脏功能的作用及相关机制。
1 材料与方法
1.1 实验动物、材料与试剂
本研究根据国家科学技术委员会颁布的《实验动物管理条例》进行。50 只雄性SPF 级Wistar 大鼠购自浙江省农业科学院[生产许可证:SCXK(浙)2017-0001]。薏苡仁标本由海南医学院田建平教授惠赠。兔抗鼠一抗TGF-β1购自英国Abcam 公司,兔抗鼠一抗MyD88 购自美国BioWorld 公司,山羊抗兔二抗IgG 购自英国Abcam 公司。
1.2 CSE的制备
用95%乙醇回流提取1.2 kg 干粉和磨碎的薏苡仁浸膏2 h,将浸出物合并在旋转蒸发器中浓缩,再将提取物在80℃真空干燥炉中干燥,获得102.3 g的薏苡仁提取物,4℃的冰箱中保存供实验使用。
1.3 实验方法
大鼠饲养环境室温(23±2)℃,相对湿度50%~60%,光照条件:12 h 昼/夜循环照明。采用单次腹腔注射50 mg/kg 链脲佐菌素(STZ)复制糖尿病大鼠模型,注射3 d 后,从大鼠尾静脉采集血样,检测血糖水平。血糖>250 mg/dL(13.88 mmol/L)的大鼠被认为是糖尿病模型复制成功。以10 只正常大鼠作为对照组(ND 组),剩余40 只糖尿病大鼠随机分为4 组:糖尿病组(STZ 组)、格列齐特组(GLI 组)、CSE 低剂量组(CSE-L 组) 及高剂量组(CSE-H组),每组各10 只。STZ 组模型复制后给予等量蒸馏水灌胃;GLI 组给予5 mg/kg 格列齐特灌胃;CSE-L组给予400 mg/kg 的CSE 灌胃;CSE-H 组给予800 mg/kg 的CSE 灌胃。将CSE 溶于10%吐温80溶液中,据预实验结果设定400 mg/kg 的CSE-L 组和800 mg/kg 的CSE-H 组,这两个剂量是中药药效学研究中常用的剂量。所有治疗间隔时间为3 d/次,干预6 周。实验期间所有动物均可自由进食标准大鼠饲料。6 周末将所有大鼠放入代谢笼中进行24 h 尿液采集。所有动物称重后麻醉,经股动脉采集血标本,颈椎脱臼处死大鼠。取右肾称重,用冷等渗盐水冲洗,置入-80℃冰箱冷冻保存,进行生化检测和Western blotting 分析,左肾置于10%甲醇固定,用做组织学检查。
1.4 肾脏组织学检查
处死大鼠后,完整取出肾脏并称重。肾组织用4%多聚甲醛溶液固定,石蜡包埋,制成4 μm 切片。烤片,冷却后低温冻存。经二甲苯脱蜡,乙醇梯度水化。苏木精染色30~60 s,冲洗5 min,伊红染色30 s,冲洗5 min;乙醇梯度脱水,干燥,二甲苯透明,中性树胶封固,晾干,光学显微镜下观察。
1.5 24 h尿蛋白和血液生化指标的检测
6 周末时,取每只大鼠24 h 尿液,3 000 r/min离心5 min,采用南京建成生物工程研究所试剂盒对尿蛋白进行测定。于1 周、3 周、6 周时取大鼠尾静脉血,用1906-05 血糖仪检测空腹血糖水平。血样在4℃、7 000 r/min 离心10 min,获取血浆样本。血清肌酐(Scr)、血尿素氮(BUN)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、谷胱甘肽(GSH)检测采用南京建成生物工程研究所试剂盒。酶联免疫吸附试验(ELISA)试剂盒检测大鼠肾组织中白细胞介素-6(IL-6)水平。
1.6 Western blotting检测
肾皮质用RIPA 缓冲液(pH=7.5)溶解。在10%SDS-PAGE 上(100 V,1.5 h)分离等量的蛋白质,在冰冷条件下转移到PVDF 膜上。用5%脱脂乳在含0.1%吐温20 的缓冲液中封闭1 h,并在4℃、兔抗鼠一抗TGF-β1(1∶500 稀释)和兔抗鼠一抗MyD88(1∶500 稀释)中孵育过夜。用含吐温20 的Tris 缓冲液洗涤后,与辣根过氧化物酶(HRD)偶联的山羊抗兔二抗IgG 共同孵育2 h。将膜放置在Bio-Rad Chemi Doc XRS +化学发光凝胶成像系统上,以GAPDH 作为内参。
1.7 统计学方法
数据分析采用SPSS 22.0 软件。计量资料均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较Dunnet-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 肾脏组织学检查结果
病理学检查结果显示,ND 组大鼠肾组织形态正常,肾皮质与髓质组织边界清晰。肾小管上皮细胞排列紧密,未见明显炎症反应。STZ 组大鼠肾小管上皮细胞胞浆内可见大量空泡和肿胀,肾小管周围有较多炎症细胞浸润和组织增生。GLI 组、CSE-L 组和CSE-H 组肾小球形态结构正常,肾皮质与髓质组织边界清晰,偶见肾小管上皮细胞胞浆空泡化。见图1。

图1 各组大鼠肾脏组织学检查结果 (苏木精-伊红染色×200)
2.2 各组大鼠不同时间空腹血糖的比较
各组大鼠不同时间空腹血糖水平的比较,经重复测量设计的方差分析,结果:①各组大鼠在1 周、3 周、6 周的空腹血糖水平差异有统计学意义(F=24.768,P=0.000),6 周时的空腹血糖水平低于1 周、3周时的空腹血糖水平(P<0.05)。②各组大鼠的空腹血糖水平差异有统计学意义(F=14.308,P=0.000),STZ组空腹血糖水平高于ND组(P<0.05),CSE-L组、CSE-H 组空腹血糖水平低于STZ 组(P<0.05)。③各组大鼠空腹血糖水平的变化趋势差异有统计学意义(F=32.253,P=0.000)。见表1。
表1 各组大鼠不同时间空腹血糖的比较(n=10,mmol/L,±s)

表1 各组大鼠不同时间空腹血糖的比较(n=10,mmol/L,±s)
组别ND组STZ组GLI组CSE-L组CSE-H组1周6.69±1.12 33.09±0.58 29.56±2.24 30.79±4.31 25.72±2.04 3周6.12±1.18 22.23±4.05 16.71±7.85 14.88±6.67 22.10±5.45 6周5.16±0.86 21.28±5.36 9.91±2.15 9.24±2.78 10.89±6.28
2.3 各组大鼠24 h尿蛋白含量、初始体重、最终体重和肾脏重量的比较
各组大鼠24 h 尿蛋白含量、初始体重、最终体重比较,经单因素方差分析,差异有统计学意义(P<0.05),STZ 组24 h 尿蛋白水平高于ND 组(P<0.05),初始体重、最终体重低于ND 组(P<0.05),CSE-L 组、CSE-H 组24 h 尿蛋白水平低于STZ 组,初始体重、最终体重高于STZ 组(P<0.05)。各组大鼠肾脏重量比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠24 h尿蛋白含量、初始体重、最终体重和肾脏重量的比较 (n=10,±s)
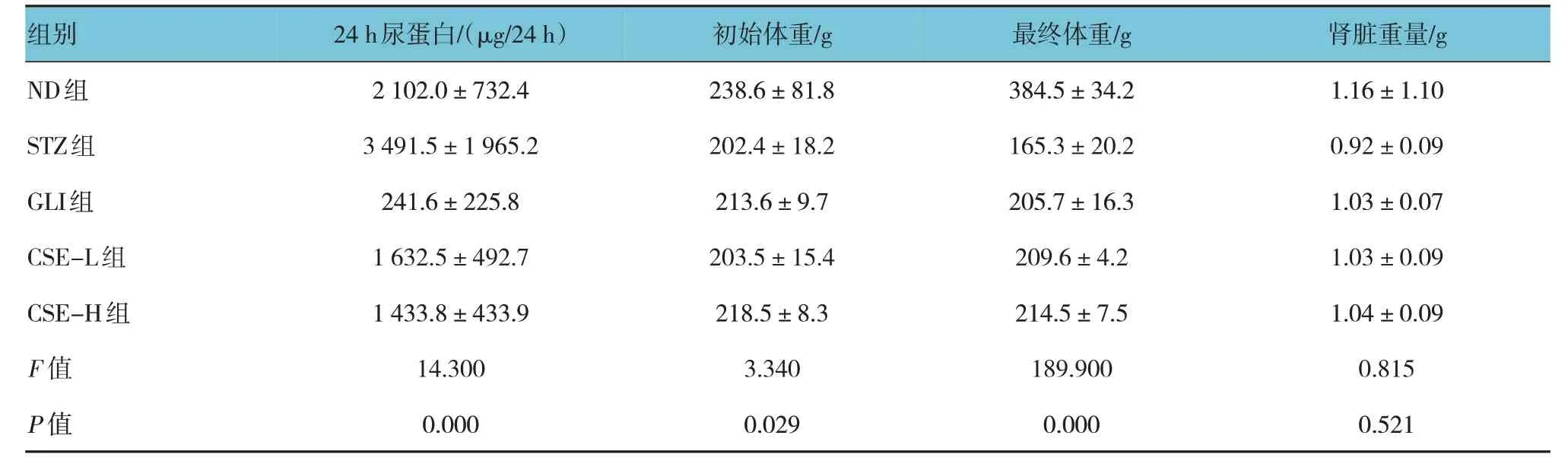
表2 各组大鼠24 h尿蛋白含量、初始体重、最终体重和肾脏重量的比较 (n=10,±s)
组别ND组STZ组GLI组CSE-L组CSE-H组F 值P 值24 h尿蛋白/(μg/24 h)2 102.0±732.4 3 491.5±1 965.2 241.6±225.8 1 632.5±492.7 1 433.8±433.9 14.300 0.000初始体重/g 238.6±81.8 202.4±18.2 213.6±9.7 203.5±15.4 218.5±8.3 3.340 0.029最终体重/g 384.5±34.2 165.3±20.2 205.7±16.3 209.6±4.2 214.5±7.5 189.900 0.000肾脏重量/g 1.16±1.10 0.92±0.09 1.03±0.07 1.03±0.09 1.04±0.09 0.815 0.521
2.4 各组大鼠肾功能参数的比较
各组大鼠肾功能参数的比较,经单因素方差分析,差异有统计学意义(P<0.05)。STZ 组Scr、BUN、TC、HDL-C 及IL-6 水平高于ND 组(P<0.05);CSE-H组Scr、BUN、TG、TC、HDL-C、GSH 及IL-6 水平低于STZ 组(P<0.05)。见表3。
表3 各组大鼠肾功能参数的比较 (n=10,±s)
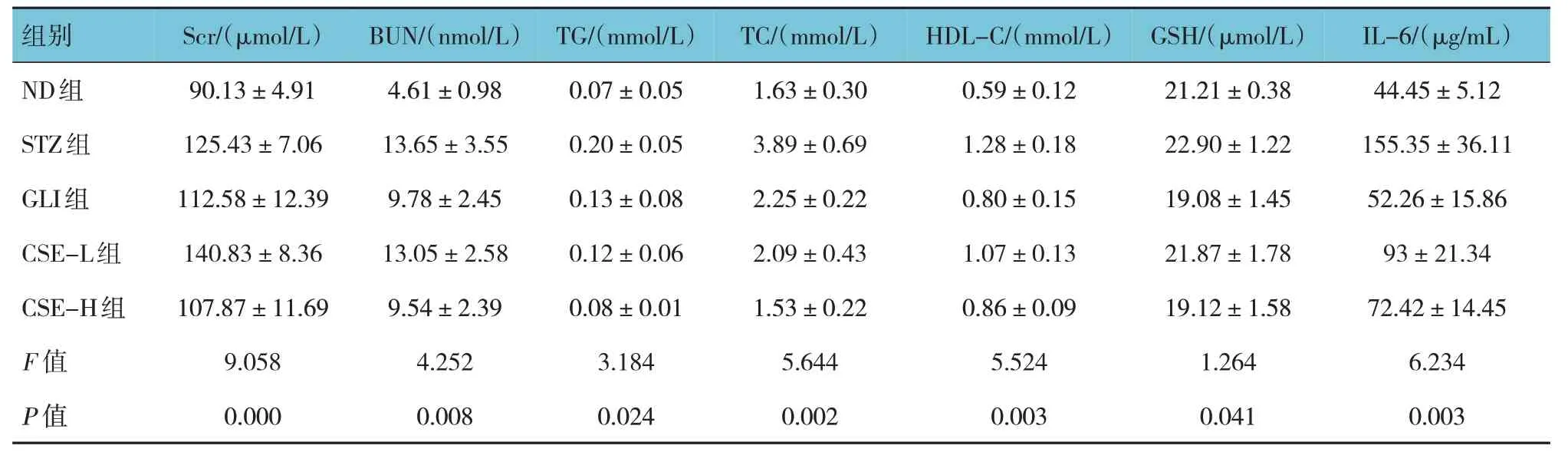
表3 各组大鼠肾功能参数的比较 (n=10,±s)
组别ND组STZ组GLI组CSE-L组CSE-H组F 值P 值Scr/(μmol/L)90.13±4.91 125.43±7.06 112.58±12.39 140.83±8.36 107.87±11.69 9.058 0.000 BUN/(nmol/L)4.61±0.98 13.65±3.55 9.78±2.45 13.05±2.58 9.54±2.39 4.252 0.008 TG/(mmol/L)0.07±0.05 0.20±0.05 0.13±0.08 0.12±0.06 0.08±0.01 3.184 0.024 TC/(mmol/L)1.63±0.30 3.89±0.69 2.25±0.22 2.09±0.43 1.53±0.22 5.644 0.002 HDL-C/(mmol/L)0.59±0.12 1.28±0.18 0.80±0.15 1.07±0.13 0.86±0.09 5.524 0.003 GSH/(μmol/L)21.21±0.38 22.90±1.22 19.08±1.45 21.87±1.78 19.12±1.58 1.264 0.041 IL-6/(μg/mL)44.45±5.12 155.35±36.11 52.26±15.86 93±21.34 72.42±14.45 6.234 0.003
2.5 各组大鼠肾组织中TGF-β1和MyD88 蛋白相对表达量的比较
各组大鼠肾组织中TGF-β1和MyD88 蛋白相对表达量的比较,经单因素方差分析,差异有统计学意义(P<0.05),STZ 组肾组织中TGF-β1蛋白相对表达量高于ND 组(P<0.05),MyD88 蛋白相对表达量低于ND 组(P<0.05);CSE-H 组肾组织中TGF-β1蛋白相对表达量低于STZ 组,MyD88 蛋白相对表达量高于STZ 组(P<0.05)。见表4 和图2。
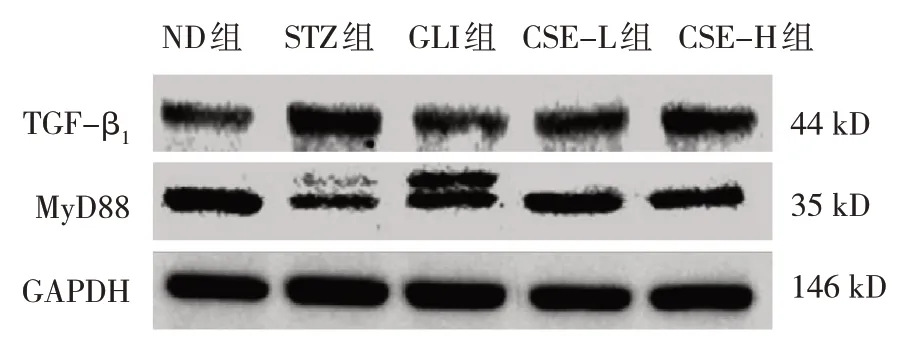
图2 各组大鼠的TGF-β1和MyD88蛋白相对表达量
表4 各组大鼠肾组织中TGF-β1和MyD88蛋白相对表达量的比较 (n=10,±s)

表4 各组大鼠肾组织中TGF-β1和MyD88蛋白相对表达量的比较 (n=10,±s)
组别ND组STZ组GLI组CSE-L组CSE-H组F 值P 值TGF-β1蛋白0.38±0.12 0.84±0.21 0.42±0.15 0.48±0.18 0.79±0.20 15.436 0.000 MyD88蛋白0.85±0.24 0.61±0.16 1.02±0.12 0.87±0.21 0.63±0.18 12.132 0.000
3 讨论
本研究采用STZ 复制糖尿病肾病模型,观察CSE 对糖尿病大鼠肾脏损伤的保护作用,并通过检测血清中多种生化指标及肾组织中TG-β1和MyD88蛋白的相对表达量,观察其对肾脏的生物学效应。结果发现,与非糖尿病大鼠相比,糖尿病大鼠的空腹血糖水平明显升高,体重明显下降。不同剂量的CSE 干预均能显著降低糖尿病大鼠的血糖和尿蛋白水平,改变Scr、BUN、TG、TC、HDL-C、GSH 及IL-6 水平。以上结果提示,CSE 降血糖的作用可能与其改善糖脂代谢有关。糖脂代谢紊乱可引起肾脏局部血流动力学改变,导致肾间质纤维化和肾小球硬化,发展为糖尿病肾病[12]。之前研究表明,CSE 可调节糖脂代谢异常,预防糖尿病及其并发症的发生[13]。进一步说明其在治疗高脂血症等领域的潜在临床价值。糖尿病肾病的早期症状主要表现为微量白蛋白尿,病理改变主要表现为肾小球肥大、肾小球细胞外基质积聚、基底膜增厚,最后发展为肾小球硬化和纤维化[14]。在临床研究中,糖尿病患者一旦出现持续性蛋白尿症状,将不可避免地进展为终末期肾病[15]。糖尿病肾病已成为糖尿病患者重要的死亡原因,因此,研究糖尿病肾病的发病机制和预防方法具有重要意义[16]。然而,由于糖尿病肾病病因的复杂性,糖尿病肾病发生的分子机制尚不清楚。CES 常被用来治疗消化不良、利尿、炎症和肠道疾病,主要利用其温肾、护精止尿、温脾止泻的作用。另有研究表明,CSE能降低DN 大鼠的血糖,改善肾功能[17]。
预防糖尿病肾病进展是一项具有挑战性的临床目标。细胞因子IL-6 在糖尿病的发病机制中起重要作用[18]。本研究中,糖尿病组大鼠IL-6 水平升高,CSE 治疗6 周后,CSE 组IL-6 水平下降。TGF-β信号通路与机体的各种病理变化密切相关,TGF-β被认为是慢性肾脏病的重要致病因素[19]。TGF-β 水平降低可减少DN 的基质降解,诱导足细胞、肾小管上皮细胞和内皮细胞凋亡[20]。糖尿病肾组织中TGF-β 的表达增加与肾纤维化有关,抑制其表达可减轻糖尿病动物模型的纤维化[21]。本研究发现TGF-β1在糖尿病肾病大鼠肾组织中的表达增加,CSE 800 mg/kg 可明显抑制DN 大鼠肾组织TGF-β1的上调,提示高剂量CSE 可能具有减轻DN 肾纤维化的潜在作用。TLR 介导的信号可诱导多种炎症因子,如IL-1、IL-6、TGF、TNF,从而导致糖尿病肾病大鼠肾小球系膜增生和细胞外基质的产生[22]。MyD88 是Toll 样受体信号通路中的一个关键配体[23],在传递上游信息和疾病发生、发展中具有重要的作用,本质上是一种胞质可溶性蛋白,其在先天性和适应性免疫应答中起关键作用[24]。同时在白细胞介素和Toll 样受体信号转导通路中起着至关重要的信号转导作用,该途径调节了许多促炎基因的激活[25]。本研究发现,CSE 可提高MyD88 水平,明显改善肾功能,抑制IL-6 的表达,降低血糖水平,减轻肾脏纤维化和炎症,这可能是其减轻肾脏炎症的原因之一[26]。Western blotting 结果显示,CSE激活肾脏中的TGF 和Toll 样受体信号通路。这两条信号通路可减轻肾间质纤维化和肾小管上皮细胞凋亡,从而减少炎症因子的产生,保护肾功能。
综上所述,CSE 可抑制糖尿病肾病大鼠肾脏纤维化进程和炎症反应,具有良好的肾脏保护作用。

