lncRNA TUG1吸附microRNA-144对狼疮肾炎小鼠肾小球系膜细胞炎症因子分泌与凋亡的影响及其机制研究
马洪波,董燕娇,孙琨,王硕,王洪云
(淄博市中心医院 肾内科,山东 淄博255036)
狼疮肾炎是系统性红斑狼疮最常见的并发症,临床主要表现为血尿、蛋白尿、肾功能不全等,是由肾内自身抗体与抗原结合形成的免疫复合物沉积在肾小球等不同部位造成的免疫损伤所致。现阶段狼疮肾炎的病因尚未完全明确,也缺乏根治性的治疗措施,新的靶向治疗或免疫抑制剂的开发为狼疮肾炎的治疗提供了更多选择[1-3]。
长链非编码RNA(long noncoding RNA, lncRNA)指的是长度>200 个核苷酸、缺乏蛋白编码能力的RNA,分子内部二级空间结构特定且复杂,有多个位点可与蛋白质结合,还能够通过碱基互补配对的原则与DNA、RNA 发生特异性的相互作用,使其适当的失活或激活,参与各类生物学进程[4]。竞争内源性RNA(ceRNA)可以通过竞争性地结合microRNA 来调节基因表达。有研究[5]发现,lncRNA就是作为ceRNA 竞争性结合细胞内大量microRNA,调控其表达,进而调控下游基因并参与到多种生物学行为中。
lncRNA 牛磺酸上调基因1(taurine upregulated gene 1, TUG1)位于染色体22q12,被证明与癌症有关[6-8]。研究发现,TUG1 在系统性红斑狼疮患者中表达降低[9]。MicroRNA-144(miR-144)与血红素和自身限制性炎症有关,血红素通过上调miR-144-3p的表达延缓自身限制性炎症的消退[10]。此外,一项关于IgA 肾病的研究[11]发现,来源于尿红细胞的miR-144-3p 在IgA 肾病患者尿沉渣中表达升高,其可作为IgA 肾病的诊断标志物。但目前尚未明确miR-144 与狼疮肾炎的进展是否有关。本研究从ceRNA 理论角度出发,通过生物信息学网站预测lncRNA TUG1 的下游靶点,并通过动物实验探讨其调控网络及在狼疮肾炎中的作用机制。
1 材料与方法
1.1 实验动物、试剂与仪器
10 周龄雄性B6.MRL-FaslprNju 系统性红斑狼疮模型小鼠20 只,体重(26.5±1.5)g;10 周龄C57BL/6健康雄性小鼠5 只,体重(26.5±1.6)g;均购自南京大学模式动物研究所[动物实验许可证号:SYXK(苏)2019-0056]。基础培养液、Annexin-V-FITC/PI 双标染色试剂盒购自北京索莱宝科技有限公司,Trizol试剂盒、实时荧光定量聚合酶链反应(qRT-PCR)试剂盒、逆转录试剂盒、裂解液均购自武汉默沙克生物科技有限公司, Ambion PARISTM试剂盒(AM1921)购自赛默飞世尔科技(中国)有限公司,HEK-293T 细 胞、 TUG1-3'-UTR-WT 和TUG1-3'-UTR-MUT 质粒购自湖南丰晖生物科技有限公司,双荧光素酶检测试剂盒购自上海汉恒生物科技有限公司,兔抗Ⅳ型胶原(Collagen Ⅳ, Col Ⅳ)抗体、纤连蛋白(Fibronectin, FN)抗体和GAPDH 抗体购自北京义翘神州科技有限公司,TBST 缓冲液购自大连美仑生物技术有限公司,酶联免疫吸附试验(ELISA)试剂盒购自武汉伊莱瑞特生物科技有限公司,噻唑蓝(MTT)购自广州锐博生物科技有限公司,Transwell 试剂盒购自江苏凯基生物技术股份有限公司。流式细胞仪购自美国贝克曼库尔特公司,酶联免疫检测仪、共聚焦显微镜均购自赛默飞世尔科技(中国)有限公司,倒置显微镜(Axio Vert.A1)购自德国卡尔蔡司公司。
1.2 方法
1.2.1 实验动物分组 B6.MRL-FaslprNju 系统性红斑狼疮模型小鼠和C57BL/6 小鼠在适应性条件下喂养5 d。每天收集B6.MRL-FaslprNju 系统性红斑狼疮模型小鼠24 h 尿量,试纸测定尿蛋白浓度>1 mg/L表明狼疮肾炎发病,为狼疮肾炎组(n=20)。C57BL/6 小鼠为正常组(n=5)。
1.2.2 肾小球系膜细胞分离纯化 将正常组和狼疮肾炎组小鼠麻醉后快速断颈处死,每只小鼠取1 g肾脏组织保存备用,同时分离肾小球系膜细胞并纯化。细胞分离纯化步骤:生理盐水清洗肾组织,然后将肾皮质剪碎,依次放入400 目、200 目、100 目共3 种不同孔径的筛网中轻轻碾压并用生理盐水冲洗,在最底层的筛网吸出一部分组织镜下观察,在组织中加入胶原酶消化30 min,当有完整的细胞散出时加入基础培养基使消化终止。将沉淀物分散均匀然后加入基础培养液置于37℃、5%二氧化碳培养箱中培养,每24 小时换新培养液,5 d 左右细胞传1 代,4~6 代细胞为纯化后的肾小球系膜细胞。
1.2.3 qRT-PCR 检测正常组和狼疮肾炎组小鼠肾小球系膜细胞中lncRNA TUG1 和miR-144 mRNA的相对表达量 Trizol 试剂盒提取正常组和狼疮肾炎组小鼠肾小球系膜细胞的总RNA,紫外线吸收法检测RNA 纯度和浓度。将RNA 逆转录为样品cDNA。依据qRT-PCR 试剂盒说明书扩增cDNA,将PCR 管置于DNA 扩增仪,94℃预变性5 min,94℃变性45 s,56℃退火30 s,72℃延伸30 s,共30 次循环,之后72℃延伸10 min。lncRNA TUG1 内参为GAPDH,miR-144 内参为U6。引物的设计和合成由上海吉玛制药技术有限公司完成,引物序列见表1。采用2-ΔΔCt法计算lncRNA TUG1 和miR-144 mRNA 的相对表达量。

表1 引物序列
1.2.4 lncRNA TUG1 亚细胞定位和双荧光素酶报告基因实验 使用PSORT 亚细胞定位网站(https://www.genscript.com/psort.html)预测TUG1 在细胞中表达的位置。采用Ambion PARISTM(AM1921)试剂盒分离狼疮肾炎组小鼠肾小球系膜细胞的细胞质和细胞核,严格按照试剂盒说明书操作;采用qRT-PCR 检测细胞质和细胞核中lncRNA TUG1 mRNA 相对表达量,具体过程同1.2.3。通过RNA22 网站(https://cm.jefferson.edu/rna22/)预测lncRNA TUG1 和miR-144 的结合位点,之后通过双荧光素酶报告基因实验检测两者的关系。狼疮肾炎组小鼠肾小球系膜细胞的培养、转染及分组:分离肾小球系膜细胞,将其置于37℃、5%二氧化碳培养箱中培养24 h 后进行转染并分为NC 组(肾小球系膜细胞转染阴性对照序列)、TUG1 过表达组(肾小球系膜细胞转染TUG1)、sh-TUG1 组(肾小球系膜细胞转染sh-TUG1)、miR-144 mimic 组(肾小球系膜细胞转染miR-144 mimic)、TUG1 过表达+miR-144 mimic 组(肾小球系膜细胞转染TUG1 和miR-144 mimic)。
1.2.5 ELISA 法检测各组细胞培养液中炎症因子的表达 NC 组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic 组、TUG1过表达+miR-144 mimic组细胞转染48 h 后,采用ELISA 法检测培养液中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)水平,实验严格按照试剂盒说明书操作,使用酶联免疫检测仪测定450 nm 波长处的吸光度值。
1.2.6 Western blotting 法检测各组细胞Col Ⅳ、FN蛋白相对表达量 收集NC 组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic 组、TUG1 过表达+miR-144 mimic 组转染后的肾小球系膜细胞,加入裂解液冰上裂解30 min,3 000 r/min 离心10 min,收取上清液,行SDS-PAGE 电泳,加热使蛋白变性。转膜加入兔抗Col Ⅳ、FN 和GAPDH 抗体,常温摇床封闭过夜孵育后TBST 洗膜,再加入辣根酶标记山羊抗兔IgG。以GAPDH 抗体为内参。常温摇床孵育2 h,收集显色发光图像,采用Image J 软件计算Col Ⅳ、FN 蛋白相对表达量。
1.2.7 MTT 实验检测各组细胞相对增殖活力 配置NC 组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic 组、TUG1 过表达+miR-144 mimic 组单个细胞悬液,以每孔2×105个细胞接种到96 孔板,将培养基放置于培养箱中培养,分别于24 h、48 h、72 h取出培养板,每孔加入15 μL MTT 溶液,继续在37℃环境中培养4 h。停止培养后,2 000 r/min 离心5 min,抽吸弃孔内上清液。每个孔内加150 μL 二甲基亚砜(DMSO),震荡孵育10 min。最后使用酶联免疫检测仪检测570 nm 波长处的吸光度值。
1.2.8 Transwell 实验检测各组细胞侵袭数将Transwell 小室置于24 孔板,PBS 冲洗,胰酶消化后收集NC 组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic 组、TUG1 过表达+miR-144 mimic 组细胞,3 000 r/min 离心10 min。重悬细胞后取200 μL 细胞悬液,铺板并培养。24 孔板下室加入500 μL 含趋化因子的培养基,常规培养24 h 后采用5%结晶紫染液染色2 min,采用光学显微镜观察染色情况,拍照后采用Image J 软件统计细胞侵袭数。
1.2.9 流式细胞术检测各组细胞凋亡率 采用Annexin-V-FITC/PI 双标染色试剂盒,转染后悬浮生长的细胞中加Annexin-V-FITC 结合液,避光孵育15 min 后低温2 000 r/min 离心3 min,弃去上清液,再加入Annexin-V-FITC 结合液和配置好的PI染色液,暗室冰浴5 min,采用流式细胞仪检测NC组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic组、TUG1 过表达+miR-144 mimic 组细胞凋亡情况。液体配置和步骤按试剂盒说明书操作。细胞凋亡率=细胞早期凋亡率+细胞晚期凋亡率。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)或中位数(上四分位数,下四分位数)[M(P25,P75)]表示,两组间比较采用t检验或Wilcoxon 符号秩检验或Kruskal-Wallis 检验,多组间比较采用方差分析或重复测量设计的方差分析,进一步两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 成功分离纯化肾小球系膜细胞
使用倒置显微镜观察肾小球系膜细胞的形态发现,细胞的体积大,形态为成纤维细胞状,胞体多为不规则的梭形、多角形;胞质具有多个突起,向四周延伸;胞核则位于细胞的中央,呈卵圆形或圆形。见图1。

图1 肾小球系膜细胞 (倒置显微镜×400)
2.2 狼疮肾炎组小鼠肾小球系膜细胞中lncRNA TUG1表达被抑制而miR-144表达增强
正常组小鼠肾小球系膜细胞中lncRNA TUG1 mRNA 相对表达量为(1.00±0.09),miR-144 mRNA相对表达量为(1.00±0.07);狼疮肾炎组小鼠肾小球系膜细胞lncRNA TUG1 mRNA 相对表达量为(0.56±0.04),miR-144 mRNA 相对表达量为(1.62±0.20)。正常组和狼疮肾炎组小鼠肾小球系膜细胞lncRNA TUG1 和miR-144 mRNA 相对表达量比较,差异有统计学意义(t=9.526 和4.896,P=0.011 和0.008),狼疮肾炎组小鼠肾小球系膜细胞lncRNA TUG1 mRNA相对表达量降低,miR-144 mRNA 相对表达量升高。见图2。

图2 正常组和狼疮肾炎组小鼠肾小球系膜细胞lncRNA TUG1和miR-144 mRNA相对表达量比较 (±s)
2.3 lncRNA TUG1能够作为ceRNA吸附miR-144
通过亚细胞定位网站发现,lncRNA TUG1主要定位于细胞质中。细胞质中lncRNA TUG1 mRNA 相对表达量为(1.42±0.13),细胞核为(1.00±0.09),两者比较,差异有统计学意义(t=4.601,P=0.010),细胞质中lncRNA TUG1 mRNA 相对表达量较高。通过RNA22 网站发现lncRNA TUG1 和miR-144 存在结合位点,双荧光素酶报告基因实验发现,两者有靶向关系:TUG1-3'-UTR-WT 中,与NC 组(1.00±0.11)比较,miR-144 mimic 组(0.52±0.03)的HEK-293T 细胞荧光素酶活性显著降低(t=7.292,P=0.002);在TUG1-3'-UTR-MUT 中,NC 组与miR-144 mimic 组的HEK-293T 细胞荧光素酶活性比较,差异无统计学意义(P>0.05)。见图3。

图3 lncRNA TUG1和miR-144的靶向关系
2.4 lncRNA TUG1抑制狼疮肾炎组小鼠肾小球系膜细胞炎症因子的分泌且能被miR-144阻断
NC 组、TUG1 过表达组、sh-TUG1 组、miR-144 mimic组、TUG1过表达+miR-144 mimic组细胞TNF-α、IL-1β、IL-6 水平比较,差异有统计学意义(P<0.05)。进一步两两比较,结果:与NC 组比较,TUG1过 表达组的TNF-α、IL-1β、IL-6 水平 降低(q=4.087、4.380 和5.583,均P=0.000),sh-TUG1 组的TNF-α、IL-1β、IL-6 水平升高(q=4.065、9.432 和3.970,均P=0.000),miR-144 mimic 组的TNF-α、IL-1β、IL-6 水平升高(q=8.066、5.933 和8.840,均P=0.000);TUG1 过表达+miR-144 mimic 组TNF-α、IL-1β、IL-6 水平与NC 组比较,差异无统计学意义(q=0.670、0.276 和0.310,均P>0.05)。见表2。
表2 各组TNF-α、IL-1β、IL-6水平比较 (pg/mL,±s)
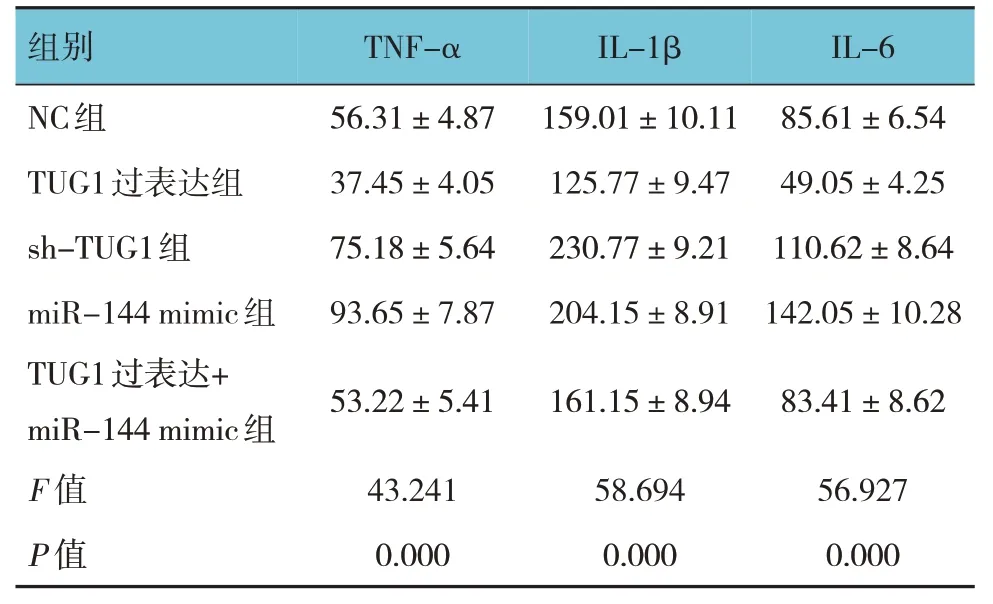
表2 各组TNF-α、IL-1β、IL-6水平比较 (pg/mL,±s)
组别NC组TUG1过表达组sh-TUG1组miR-144 mimic组TUG1过表达+miR-144 mimic组F 值P 值TNF-α 56.31±4.87 37.45±4.05 75.18±5.64 93.65±7.87 53.22±5.41 43.241 0.000 IL-1β 159.01±10.11 125.77±9.47 230.77±9.21 204.15±8.91 161.15±8.94 58.694 0.000 IL-6 85.61±6.54 49.05±4.25 110.62±8.64 142.05±10.28 83.41±8.62 56.927 0.000
2.5 lncRNA TUG1抑制狼疮肾炎组小鼠肾小球系膜细胞Col Ⅳ、FN蛋白的表达且能被miR-144阻断
NC 组、TUG1 过 表达组、sh-TUG1 组、miR-144 mimic 组、TUG1 过表达+miR-144 mimic 组的Col Ⅳ、FN 蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,结果:与NC 组比较,TUG1 过表达组的Col Ⅳ、FN 蛋白相对表达量降低(P<0.05),sh-TUG1 组和miR-144 mimic 组Col Ⅳ、FN 蛋白相对表达量升高(P<0.05);TUG1 过表达+miR-144 mimic 组Col Ⅳ、FN 蛋白相对表达量与NC组比较,差异无统计学意义(P>0.05)。见表3和图4。

图4 各组肾小球系膜细胞Col Ⅳ与FN蛋白的表达
表3 各组Col Ⅳ与FN蛋白相对表达量的比较 (±s)

表3 各组Col Ⅳ与FN蛋白相对表达量的比较 (±s)
?
2.6 lncRNA TUG1 抑制狼疮肾炎组小鼠肾小球系膜细胞增殖、侵袭,促进细胞凋亡且能被miR-144 阻断
各组不同时间点的肾小球系膜细胞增殖活力比较,采用重复测量设计的方差分析,结果:①不同时间点的肾小球系膜细胞增殖活力有差异(F=1 389.000,P=0.000);②各组肾小球系膜细胞增殖活力有差异(F=148.300,P=0.000);③各组的细胞增殖活力变化趋势有差异(F=12.430,P=0.000);进一步两两比较,与NC 组48 h 和72 h 比较,TUG1 过表达组48 h 和72 h 细胞增殖活力降低(q=4.687 和7.169,均P=0.000),sh-TUG1 组48 h 和72 h 细胞增殖活力增强(q=4.685 和8.823,均P=0.000),miR-144 mimic 组48 h 和72 h 细胞增殖活力增强(q=7.444 和12.130,均P= 0.000)(见表4)。各组肾小球系膜细胞侵袭数和细胞凋亡率比较,差异有统计学意义(P<0.05);进一步两两比较,结果:与NC 组比较,TUG1 过表达组的细胞侵袭数减少(q=2.828,P=0.047),细胞凋亡率升高(q=13.450,P=0.000);sh-TUG1 组细胞侵袭数增多(q=4.108,P=0.000),细胞凋亡率降低(q=2.781,P=0.000);miR-144 mimic 组细胞侵袭数增多(q=4.768,P=0.000)、细胞凋亡率降低(q=3.252,P=0.006);TUG1 过表达+miR-144 mimic 组的细胞侵袭数和细胞凋亡率与NC 组比较,差异无统计学意义(q=0.355 和1.318,P=0.682 和0.189)。见 表5 和图5、6。

图5 各组肾小球系膜细胞侵袭结果 (共聚焦显微镜×400)
表4 各组不同时间点的肾小球系膜细胞增殖活力比较(±s)

表4 各组不同时间点的肾小球系膜细胞增殖活力比较(±s)
组别NC组TUG1过表达组sh-TUG1组miR-144 mimic组TUG1过表达+miR-144 mimic组24 h 0.43±0.03 0.36±0.02 0.53±0.04 0.62±0.05 0.46±0.03 48 h 0.72±0.04 0.55±0.02 0.89±0.05 0.99±0.06 0.77±0.04 72 h 1.21±0.04 0.95±0.02 1.53±0.07 1.65±0.07 1.28±0.05
表5 各组肾小球系膜细胞侵袭数和细胞凋亡率比较 (±s)

表5 各组肾小球系膜细胞侵袭数和细胞凋亡率比较 (±s)
组别NC组TUG1过表达组sh-TUG1组miR-144 mimic组TUG1过表达+miR-144 mimic组F 值P 值细胞侵袭数/个204.23±19.14 162.35±17.08 285.11±29.32 298.15±32.07 211.33±20.26 16.803 0.000细胞凋亡率/%11.25±0.91 26.53±2.44 8.21±0.96 7.53±0.82 12.71±1.32 88.492 0.000
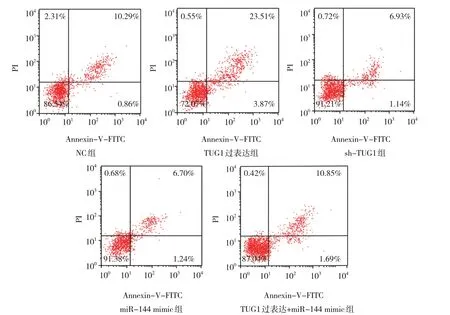
图6 各组细胞凋亡实验结果
3 讨论
肾损伤并发症仍被认为是继感染位居第二的死亡原因,大约40%~70%的系统性红斑狼疮患者都会并发狼疮肾炎,是系统性红斑狼疮患者重要的死亡因素[12]。狼疮肾炎主要病变特点为肾小球系膜细胞的过度增殖,系膜细胞的过度增殖可以释放大量的炎症因子,加剧炎症和引起肾小球硬化[13]。
lncRNA 与人类疾病的发生、发展和防治都有着密切联系[14]。TUG1 作为lncRNA 的一员,GU 等[15]的研究证实在慢性阻塞性肺疾病中上调TUG1可以调控细胞炎症分子分泌;同样CAO 等[16]证明在系统性红斑狼疮小鼠肾组织中TUG1 表达降低;XU 等[17]也发现,在狼疮肾炎中,TUG1 在抑制细胞损伤和诱发炎症等方面起重要的调节作用。因此本研究关注TUG1 在狼疮肾炎中的作用和具体调控机制并探究其下游调控网络。MicroRNA 是一种编码长度约22 nt 的RNA,广泛存在于真核细胞中,在许多生理和病理过程中,都发挥着重要的作用[18]。miR-144 以往被发现在IgA 肾病中表达增强并且可以在IgA 肾病的分子诊断中发挥作用[11]。而本研究进一步证实了miR-144 在狼疮肾炎组小鼠肾组织中表达升高,表明miR-144 与狼疮肾炎发病有很大关系。
肾小球系膜细胞是肾脏的主要功能细胞,肾小球系膜细胞炎症因子大量分泌是狼疮肾炎的重要病变表现,狼疮肾炎发病时,TNF-α、IL-1β、IL-6 等炎症因子分泌增强,进一步使肾组织其他细胞损伤,导致肾小球纤维化,而肾小球纤维化是肾脏由健康到损伤、最后到功能丧失的早期标志[19]。本研究通过ELISA 法检测各组肾小球系膜细胞中TNF-α、IL-1β、IL-6 的水平,发现TUG1 过表达或抑制miR-144 表达都会使TNF-α、IL-1β、IL-6 的水平降低。FN 为一种高分子血浆糖蛋白,在肾脏中的主要功能是通过结合纤维蛋白、纤维蛋白原及胶原,使其他胶原沉积在肾小管和间质。FN在肾损伤早期显著增加,随着疾病发展,后期呈现显著升高趋势,加剧肾脏纤维化病变,是肾脏纤维化病变的主要标志物之一[20]。Col Ⅳ是细胞外基质的主要成分,构成基膜并调控细胞黏附,可以作为检测脏器纤维化的标志蛋白[21]。本研究发现纤维化因子标志蛋白FN 与Col Ⅳ的表达可以被TUG1 抑制且能被miR-144 逆转。在健康状态下,肾小球系膜细胞更新很缓慢,但在病理状态下,系膜细胞增殖活跃,功能亢进,系膜细胞凋亡减少,过度增殖会导致肾小球纤维化,进一步导致肾小球硬化,影响肾脏功能[22-24],本研究通过MTT、Transwell 法及流式细胞术对各组肾小球系膜细胞的增殖、侵袭及凋亡情况进行观察,发现TUG1 过表达能够抑制肾小球系膜细胞的增殖和侵袭,促进凋亡。
综上所述,相对于正常健康小鼠,狼疮肾炎小鼠肾小球系膜细胞中TUG1 表达低,miR-144 表达高,TUG1 能够靶向调控miR-144 进而抑制肾小球系膜细胞炎症因子水平及细胞增殖活性。TUG1和miR-144 为狼疮肾炎的治疗提供了新的靶点和依据,但需进一步研究证实更多的机制。

