腐食酪螨第3 组分过敏原的分子结构、理化性质及抗原表位分析
王楠,白雪强,陈文艳,李圆圆,张晓金
江苏医药职业学院基础医学部,江苏盐城224005
腐食酪螨(T.putrescentiae)是全球常见的一种贮藏性螨类,常见于各种贮藏物上,尤其是在高脂肪和富含蛋白质的贮藏物中[1]。腐食酪螨可导致人体发生过敏性哮喘、过敏性鼻炎等螨类过敏性疾病中国、韩国、印度等亚洲国家均较为常见[2-3]。目前,临床过敏原的诊断和免疫治疗主要依靠过敏原的粗提浸液。但过敏原粗提浸液中的成分复杂,可能会导致假阳性、过敏反应等。因此深入研究腐食酪螨过敏原及其抗原表位已成为过敏性疾病诊断和治疗领域的研究热点[4-5]。目前,WHO/IUIS 过敏原命名小组委员会公布的腐食酪螨过敏原一共有14 个组分,包括第1 组分、第2 组分、第3 组分、第7 组分、第8 组分、32 组分、第10 组分、第11 组分、第13 组分、第20 组分、第28组分、第34 组分、第35 组分及第36 组分。通过研究粉尘螨第3 组分过敏原和屋尘螨第3 组分过敏原后发现,第3 组分过敏原是螨类粪便的主要成分,同时也是导致螨类过敏性疾病的一个常见过敏原种类,可诱导机体产生过敏毒素C3a 和C5a。C3a和C5a 是补体C3 和C5 的裂解产物,在过敏性疾病中发挥重要作用[6]。有学者[6]于2009 年首次采用同源建模法获得重组Tyr p 3 蛋白,并通过ELISA 法检测后发现,52%腐食酪螨过敏人群对Tyr p 3 过敏,说明Tyr p 3 是腐食酪螨的常见过敏原组分。2019 年1 月—2021 年6 月,我们采用生物信息学手段对腐食酪螨第3 过敏原组分(Tyr p 3)的分子结构、理化特性、T/B 细胞表位进行分析,旨在为设计基于Tyr p 3 表位的疫苗和肽-ELISA 检测方法的研发奠定理论基础。现将结果报告如下。
1 材料与方法
1.1 Tyr p 3蛋白分子结构分析
1.1.1 Tyr p 3 蛋白的一级结构分析 Tyr p 3 蛋白序列(accession no.ABZ81991)从NCBI 核酸数据库获得。采用网络在线服务器InterPro v56.0 在线网站(https://www.ebi.ac.uk/interpro/)分析Tyr p 3所属的蛋白质家族组成。通过网络在线服务器ProtScale tools(https://web.expasy.org/protscale/)分析Tyr p 3 蛋白的相对分子量、氨基酸残基数及氨基酸组成。
1.1.2 Tyr p 3 蛋白的二级结构分析 使用SOPMA网络在线服务器(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.plpage=npsa_sopma.html)对Tyr p 3 蛋白的α 螺旋、β 转角、β 折叠、延伸链和无规则卷曲进行分析预测。
1.1.3 Tyr p 3 蛋白的三级结构分析 通过网络在线服务器SWISS-MODEL(https://www.swiss model.expasy.org/)寻找建模模板,发现肝胰蛋白酶的三级结构(PDB accession No.4BNR)与Tyr p 3 蛋白具有较高的序列同源性(44.84%),因此以肝胰蛋白酶(PDB accession No.4BNR)作为构建Tyr p 3 蛋白三级结构的模板,进行同源建模。利用SPDBV 软件对Tyr p 3 蛋白的三级结构进行能量优化。利用QMEAN(利用结晶学评估蛋白质三维结构)(swissmodel.expasy.org/qmean)、ERRAT(services.mbi.ucla.edu/SAVES)、VERIFY_3D(检测三级结构,进行残基评分)(services.mbi.ucla.edu/SAVES)和ProSA-Web(检测蛋白结构能量常用的工具)(https://prosa.services.came.sbg.ac.at/prosa.php)软件评估构建的Tyr p 3三级结构[1]。蛋白质分子中的信号肽是引导新合成肽链转移到内质网上的一段多肽。运用网络在线服务器SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP)预测Tyr p 3 的信号肽。利用网络在线服务器TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测Tyr p 3的跨膜结构域的氨基酸位置。
1.2 Tyr p 3 蛋白的理化性质预测 通过网络在线服 务 器ProtScale tools(https://web.expasy.org/protscale/)进行Tyr p 3 蛋白的的理化性质进行预测分析,包括Tyr p 3 蛋白的带负电荷残基、带正电荷的残基、理论等电点(pI)、亲水性总平均值(GRAVY)和不稳定性指数等。使用NetPhos3.1 服务器预测分析Tyr p 3蛋白的磷酸化位点。
1.3 Tyr p 3蛋白的抗原表位分析
1.3.1 Tyr p 3 蛋白的B 细胞表位分析方法 采用DNASTAR Lasergene 软件中的Protean 软件、网络在线服务器BCPreds(ailab.ist.psu.edu/bcpred)和网络在线服务器IEDB(http://www.iedb.org/)分析Tyr p 3 的B 细胞表位。其中,Protean 软件主要分析Tyr p 3的亲水区域分析、抗原指数分析、氨基酸位于分子表面可能性分析、柔性区域分析。
1.3.2 Tyr p 3 蛋白的T 细胞表位分析方法 螨类诱导引起的过敏性哮喘与等位基因HLA-DRB1*0301 和HLA-DRB1*0401 相关联[7]。因此,通过鉴定与MHC 分子结合的肽进而预测T 细胞表位。选取与人哮喘相关的等位基因HLA-DRB1*0301 和HLA-DRB1*0401[7],利用网络服务器NetMHC Ⅱ 2.2和NetMHCⅡpan-3.1 分 析Tyr p 3 的T 细胞表位。
2 结果
2.1 Tyr p 3 蛋白分子结构 由网络在线服务器InterPro v56.0 分析,Tyr p 3 是一种胰蛋白酶(IPR001254)。成熟Tyr p 3蛋白含有269个氨基酸,其中甘氨酸(Gly)最多(占比10.8%)其分子式为C1247H1980N338O395S11,分子量为28 380.13 Da。
Tyr p 3 的二级结构中包含α 螺旋(氨基酸占比19.65%)、β 转角(氨基酸占比5.96%)、延伸链(氨基酸占比25.61%)和无规则卷曲(氨基酸占比50.19%),Tyr p 3的二级结构见图1。
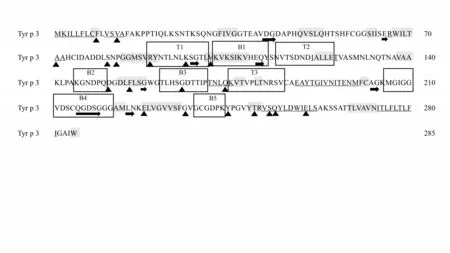
图1 Tyr p 3蛋白的二级结构及B、T细胞表位情况
建模得到的Tyr p 3 三级结构经ERRAT 评分为93.06,表明Tyr p 3 的三级结构具有高分辨率;经VERIFY 3D验证,得到Tyr p 3残基评分为96.63%,表明Tyr p 3 的三级结构合理;QMEAN Zscore 评分为0.4,说明蛋白质模型变异率较低,整体的折叠和局部结构准确率较高,立体化学结构合理。ProSA 数值-7.11,说明残基之间的能量合理。第1~16位氨基酸为Tyr p 3蛋白的信号肽。Tyr p 3蛋白跨膜区域的氨基酸起始位置到终止位置是第247~268氨基酸。
2.2 Tyr p 3 蛋白的理化性质 Tyr p 3 蛋白的理论等电点pI 5.63,Tyr p 3 的氨基酸构成中Gly(G)最多(占比10.8%),其中带负电残基(Asp+Glu)23个,带正电残基(Arg+Lys)18 个;GRAVY 为-0.008,说明Tyr p 3 为亲水性蛋白;不稳定指数为24.41,说明蛋白性质稳定。蛋白质磷酸化是一种重要的蛋白质翻译后的修饰,是调控蛋白质活力和功能的重要机制。Tyr p 3 蛋白的磷酸化位点结果为,Tyr p 3 蛋白含有9 个丝氨酸激酶(第9、13、71、81、89、101、235、244、248 位氨基酸S),7 个苏氨酸激酶(第83、151、155、165、250、251、258 位氨基酸T)及3个酪氨酸激酶(第96、174、227位氨基酸Y)。
2.3 Tyr p 3蛋白的B、T细胞表位 Tyr p 3 蛋白的B细胞表位有5 个肽序列,其氨基酸位置分别为第102~113位氨基酸、第145~150位氨基酸、第161~170 位氨基酸、第207~221 位氨基酸和237~242 位氨基酸,Tyr p 3蛋白的B细胞表位结果见图1、图2A。
Tyr p 3 的T 细胞表位 用NetMHC Ⅱ2.2 服务器和NetMHC Ⅱpan 3.0 服务器对Tyr p 3 蛋白的T 细胞表位预测得到3 个肽序列,其氨基酸位置分别为第89~100 位氨基酸,第114~125 位氨基酸和第175~185位氨基酸),Tyr p 3蛋白的T细胞表位结果见图1、图2B。
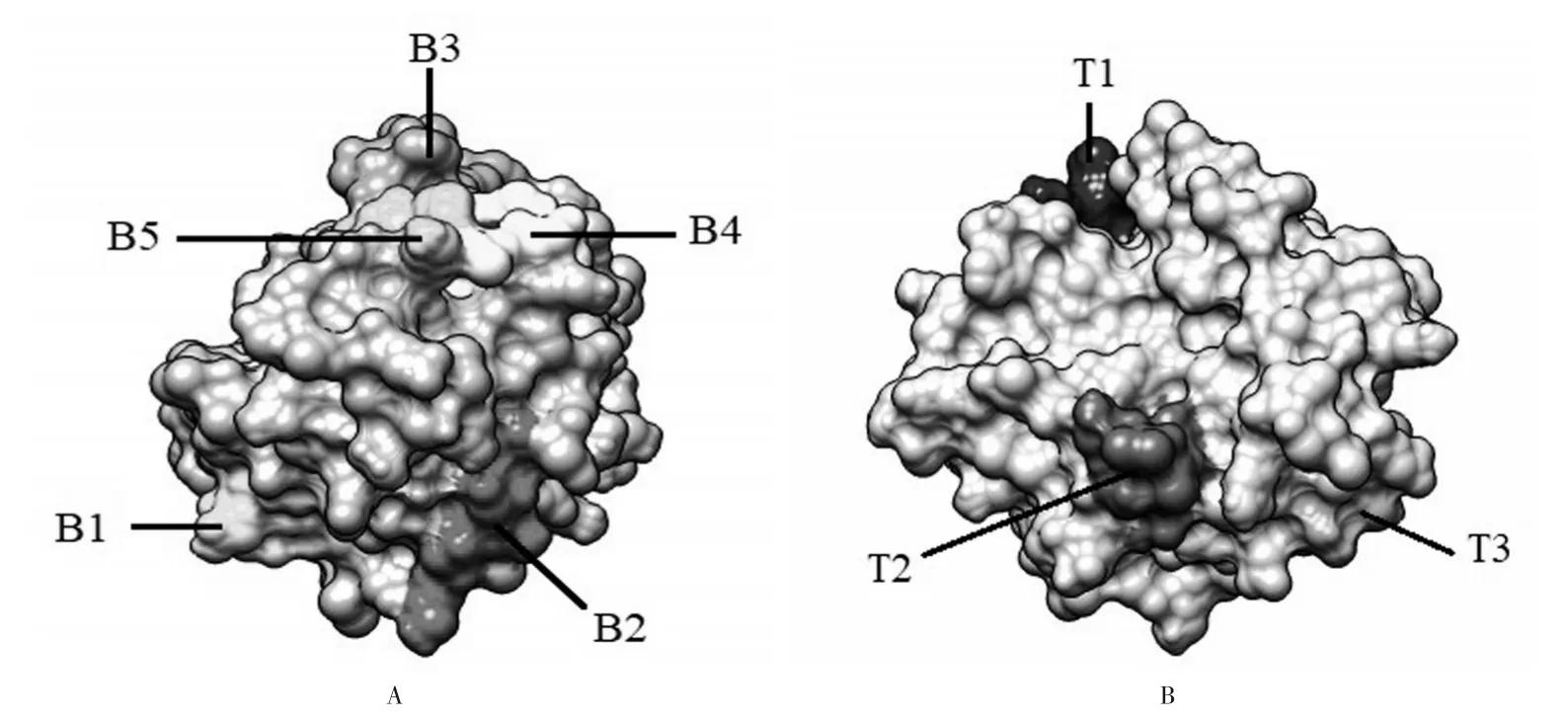
图2 Tyr p 3蛋白的B、T细胞表位示意图
3 讨论
由腐食酪螨引起的过敏性疾病在全球很多国家都非常常见[8]。有文献[3]报道,通过皮肤点刺试验,腐食酪螨在中国广东省人群中的阳性率为63%。在韩国和欧洲,对腐食酪螨过敏的人群占22%~43%[9-10]。过敏原的粗提浸液在螨类过敏性疾病的诊断治疗中存在诸多缺点,例如会导致假阳性、过敏反应等[7,11-12]。但使用单一组分过敏原在临床过敏性疾病的诊治方面能很好避免上述问题的出现。因此,现阶段越来越多的研究[13-14]目光聚焦在单一组分过敏原的研究。
蛋白质分子中的信号肽是引导新合成肽链转移到内质网上的一段多肽,位于新合成肽链的N端,一般由15~30个氨基酸残基组成[15]。信号肽的分析对蛋白质的定位有着非常重要的作用。SignalP 4.1是基于多种人工神经网络算法,可预测细菌和真核生物氨基酸序列中的信号肽切割位点。通过SignalP 4.1 分析Tyr p 3 的信号肽,结果显示,第1~16 位氨基酸残基为信号肽序列;通过跨膜结构预测分析发现Tyr p 3 具有1 个完整跨膜结构域,上述分析说明Tyr p 3 是一种分泌型蛋白。利用ProtScale tools 分析Tyr p 3 的理化性质说明Tyr p 3 是一种亲水性稳定的蛋白质。对Tyr p 3 的功能位点进行分析,表明Tyr p 3 含有9 个丝氨酸激酶、7 个苏氨酸激酶及3 个酪氨酸激酶,具有1次跨膜结构域,其跨膜氨基酸的起始位置到终止位置是247~268。上述结果初步明确了腐食酪螨第3 组分的基本分子特征,为进一步开展实验工作提供了方向。
目前,蛋白质结构的测定可通过X-射线晶体衍射、核磁共振技术和三维电镜重构获得。但是蛋白质的表达、纯化及结晶给蛋白质结构的测定增加了困难。随着生物信息学的快速发展,各种生物信息学软件对蛋白质结构和功能的预测结果与实际偏差越来越小。对蛋白质结构可利用蛋白质相关的数据库信息进行高效、快速的生物信息学分析。通过SOPMA 服务器预测Tyr p 3 的二级结构,结果显示Tyr p 3 的二级结构中包含了α 螺旋(氨基酸占比19.65%)、β 转角(氨基酸占比5.96%)、延伸链(氨基酸占比25.61%)和无规则卷曲(氨基酸占比50.19%)。利用SWISS-MODEL 同源建模,通过ERRAT、VERIFY 3D、QMEAN 和ProSA 评估,建模得到Tyr p 3蛋白的三级结构是合理的。
抗原表位是抗原分子中决定免疫应答特异性的特殊化学基团,表位通常由5~15 个氨基酸残基组成。抗原表位的特性、数量和空间构型决定了抗原特异性。根据T 细胞和B 细胞所识别的抗原表位的不同,表位可分为T 细胞表位和B 细胞表位。传统抗原表位可通过的实验方法确定,如T 细胞表位可通过重叠肽法或酸洗脱法确定,但实验过程非常耗时且工作效率较低[7]。利用计算机预测过敏原蛋白的抗原表位与实验结果具有很好的相关性[5]。因此,可先利用生物信息学技术进行预测分析T 细胞表位和B 细胞表位,再通过有效的免疫学实验对预测结果进行验证,不仅可保证结果的准确性,而且能大幅度提高工作效率,有效地节约研究成本。
本研究中运用DNAStar 软件中的Protean、网络在线服务器BCPreds、IEDB 对Tyr p 3 蛋白质的B 细胞表位进行预测。在B 细胞表位的研究中发现,α-螺旋和β-折叠具有高化学键、结构不易改变且大多位于蛋白质内部难以与抗体接触结合,因此α-螺旋和β-折叠成为抗原表位序列的可能性相对较低[16-17]。相比之下,β-转角和无规卷曲凭借良好的柔韧性,且其一般位于蛋白质的表面暴露区域,通常可含有表位序列[16-17]。此外,当蛋白质亲水性>0、抗原指数>0和表面可及性>1时,形成抗原表位的可能性大[1]。因此,在本研究中我们通过DNAStar 分析了Tyr p 3 的亲水性、表面可及性、抗原指数;利用SOPMA 服务器预测Tyr p 3 的二级结构。在DNAStar 和SOPMA 服务器分析的基础上,结合BCPreds、IEDB 对Tyr p 3 的B 细胞表位进行预测,结果显示:Tyr p 3 蛋白的B 细胞表位有5 个肽序列,氨基酸位点分别为102-113、145-150、161-170、207-221 和237-242,上述肽序列具有较好的亲水性、可及性、柔韧性和抗原性指数。
过敏性哮喘是腐食酪螨引起的一种常见的螨类过敏性疾病,其发病机制与遗传、环境、免疫等因素都相关。有研究[7]发现,螨类诱导引起的过敏性哮喘与等位基因HLA-DRB1*0301 和HLA-DRB1*0401 相关联。因此,本研究通过鉴定与MHC 分子结合的肽进而预测T 细胞表位。我们选用NetMHCⅡ2.2 和NetMHC Ⅱpan 3.0 数据库分析T 细胞表位。根据NetMHC Ⅱ2.2 和NetMHC Ⅱpan 3.0 对Tyr p 3 的T 细胞表位的分析结果显示,Tyr p 3 蛋白的T 细胞表位预测得到3 个肽序列,分别为89-100、114-125 和175-185。通过计算机预测抗原表位,能大幅度后续实验的工作效率、准确性,有效节约了研究成本,并为接下来Tyr p 3 蛋白的T 细胞表位和B细胞表位的筛选和鉴定提供了数据支持,能更有针对性的去验证各个表位的免疫原性。
综上所述,Tyr p 3 蛋白含有269 个氨基酸,分子式为C1247H1980N338 O395S11,分子量为28 380.13 Da,是一种亲水且理化性质稳定的蛋白,含有9 个丝氨酸激酶、7 个苏氨酸激酶及3 个酪氨酸激酶,具有1次跨膜结构域,其跨膜氨基酸的起始位置到终止位置是247~268。Tyr p 3 蛋白的二级结构有α 利用螺旋、β 转角、延伸链和无规则卷曲,同源建模预测得到的Tyr p 3 蛋白的三级结构经验证结构合理且稳定。Tyr p 3 B 细胞表位的肽序列有5个,其氨基酸位置分别为102~113、145~150、161~170、207~221 及237~2425,具有较好的亲水性、可及性、柔韧性和抗原性指数。T 细胞表位的肽序列有3 个,其氨基酸位置分别为89~100、114~125、和175~185。

