中药中生物碱类化学成分的毒性作用研究进展
胡增美,黄露,侯佳华,王小莹(天津中医药大学,天津 301617)
生物碱是一类具有显著药理活性的碱性含氮化合物,常与酸类化合物结合以生物碱盐的形式广泛存在于罂粟科、茄科、豆科、茜草科等植物中。随着现代科学技术的不断发展,国内外学者在研究和使用生物碱的过程中,发现其在抗肿瘤、抗炎、抗病毒、抗菌、降血糖、调节机体自身免疫以及治疗心血管系统疾病方面显示了突出的疗效。然而,随着研究的不断深入,研究人员发现部分生物碱在发挥药理活性的同时对机体的消化系统、中枢神经系统、呼吸系统、免疫系统等产生一定的毒性,这极大地限制了生物碱在临床的应用。因此,如何使生物碱发挥增效减毒的作用,是研究人员重点关注并亟需解决的问题。本文对近20年发表的与生物碱毒性相关的文献进行归纳分析,并就其中研究热度较高的生物碱的毒性剂量、临床表现和机制展开论述。
1 文献计量学分析
利用CiteSpace 软件分析Web of Science 核心文集中近20年与生物碱毒性相关的文献,从而对该领域的研究方向、研究热点进行预测。关键词共现图谱(见图1A)中高频率的关键词有:metabolic activation、pyrrolizidine alkaloid、hepatotoxicity、neurotoxicity、oxidative stress、apoptosis、cytochrome p450、glutathione、monocrotaline、chemotherapy、aconite、cardiotoxicity、paclitaxel等。关键词聚类图谱(见图1B)显示的9 个聚类群分别为:#0 pyrrolizidine alkaloid(吡咯嗪核生物碱),#1 chemotherapy-induced peripheral neuropathy(化疗引起的周围神经病),#2 neuroprotective effect(神经保护效应),#3 cisplatin-induced renal injury(顺铂引起的肾损伤),#4 ephedra sinica stapf(麻黄),#5 striatal dopaminergic transmission(纹状体多巴胺能传输),#7 tetradium ruticarpum(吴茱萸),#9 protopine alkaloid(原阿片碱型生物碱),#10 alkaloid dioncophylline(薯蓣碱)。根据共现图和聚类图的结果,研究方向可大致归为两类:① 从机制和代谢方面对生物碱的毒性进行深入研究;② 生物碱对神经系统的毒性依然是未来的关注方向。研究热点主要集中在以下三个方面:① 脂质过氧化与生物碱毒性之间的联系;② 生物碱对肝脏的毒性;③ 生物碱对脑和神经的毒性。
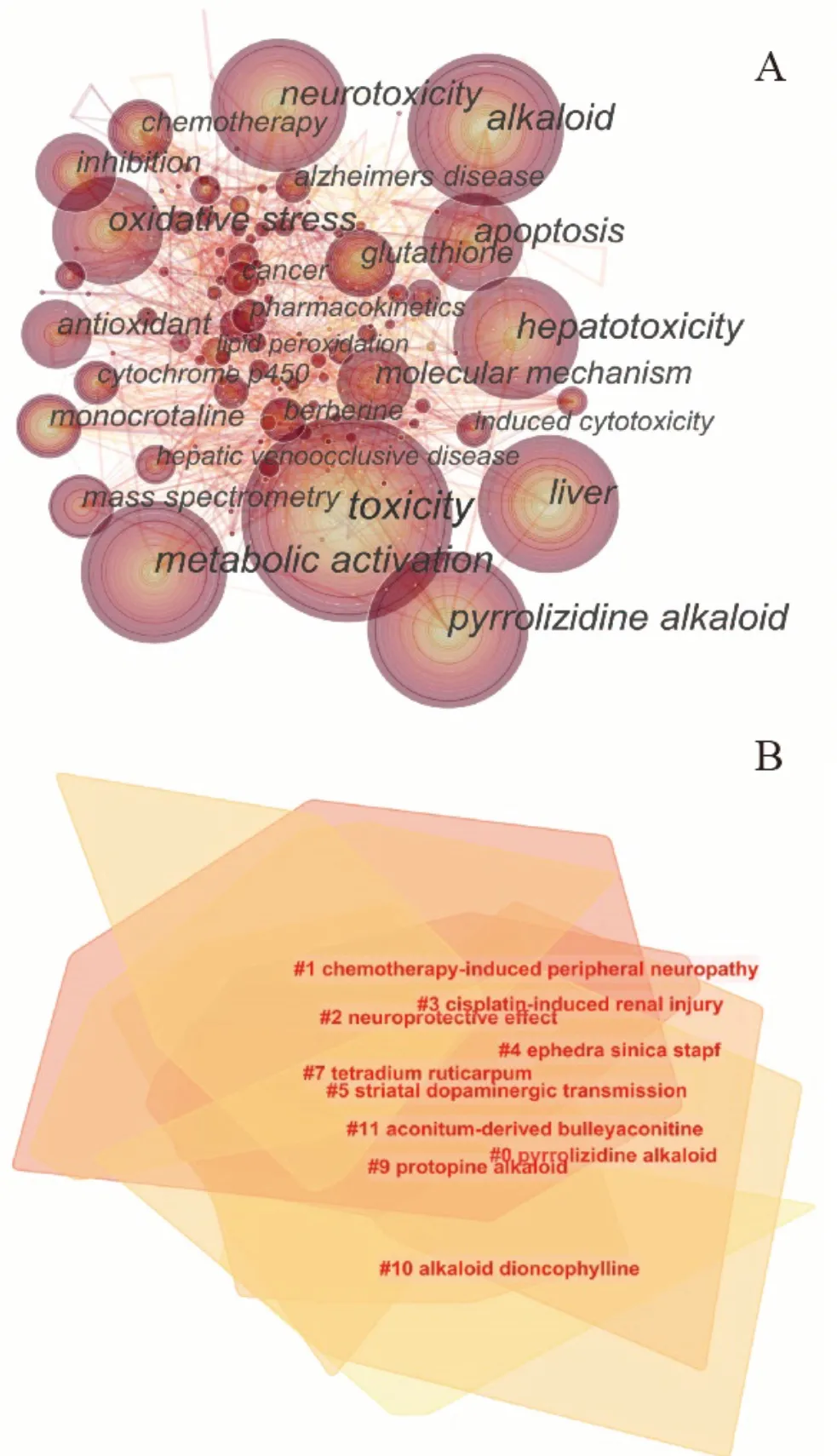
图1 关键词共现图谱(A)及聚类图谱(B)Fig 1 Co-occurrence mapping(A)and clustering map(B)of keyword
从文献分析结果看,长春花生物碱、吡咯嗪生物碱、紫杉烷类生物碱、乌头类生物碱是研究热度较高的生物碱(见表1)。它们在发挥着显著药理作用的同时也伴随着严重的毒副反应。从夹竹桃科长春花属植物长春花中分离出的长春碱、长春新碱、去甲长春碱等多种双聚吲哚生物碱已被广泛运用于肿瘤的治疗中,但同时也伴随着严重的神经毒性。吡咯嗪生物碱多存在于紫草科、菊科、豆科等植物中,肝毒性吡咯嗪生物碱(如千里光碱、毛果天芥菜碱、野百合碱等)会导致肝窦阻塞综合征(HSOS)的发生。紫杉烷类生物碱是从植物短叶红豆杉的树皮中提取出的一种活性成分,研究人员对已取得的活性成分进行结构修饰,合成了一系列如decinnamoytaxinine E、taxine、docetaxel 类的衍生物,这些化合物广泛运用于临床抗肿瘤治疗的同时也会造成一定程度的免疫系统损伤。乌头类生物碱是以乌头碱为代表的一类双酯型生物碱,广泛存在于毛茛科乌头属植物乌头中,其中乌头碱、次乌头碱、新乌头碱等具有较强的心脏和肝脏毒性。
表1 四类研究热度较高的生物碱
Tab 1 Four alkaloids with high research enthusiasm
生物碱类别基本结构常见成分英文名称分子式长春花生物碱images/BZ_167_543_426_1039_835.png长春瑞滨vinorelbineC45H54N4O8长春碱vinblastineC46H58N4O9去甲长春碱N-demethyl VLBC45H56N4O9长春新碱vincristineC46H56N4O10羟基长春碱vincadiolineC46H58N4O10images/BZ_167_673_858_909_1031.png吡咯嗪生物碱千里光碱senecioineC18H25NO5倒千里光碱retrorsineC18H25NO6千里光宁碱senecionineC18H25NO5野百合碱monocrotalineC16H23NO6毛果天芥菜碱lasiocarpineC21H33NO7紫杉烷类生物碱images/BZ_167_585_1143_998_1401.png紫杉醇paclitaxelC47H51NO14三尖杉宁碱cephalomannineC45H53NO14 7-表-10-去乙酰基紫杉醇10-deacetyltaxolC45H49NO13紫杉碱taxineC35H47NO10多烯紫杉醇docetaxelC43H53NO14乌头类生物碱images/BZ_167_543_1428_1039_1831.png乌头碱aconitineC34H47NO11次乌头碱hypoaconitineC33H45NO10新乌头碱mesaconitineC33H45NO11附子灵fuzilineC24H39NO7宋果灵zongorineC22H31NO3
2 生物碱的临床毒性表现
长春花生物碱、吡咯嗪生物碱、紫杉烷类生物碱和乌头类生物碱的毒性主要表现为对心脏、肝脏、神经系统和呼吸系统的损伤。
2.1 长春花生物碱
长春瑞滨作为一种具有剂量依赖性的小分子抗肿瘤药物,其在杀伤肿瘤细胞的同时也具有损伤正常组织的特性,这使得长春瑞滨的使用剂量受到限制。临床研究发现,长春瑞滨的最大耐受量为35.4 mg·m,而剂量在20 mg·m以下无效,临床推荐剂量为25 ~30 mg·m。其剂量限制性毒性主要为神经毒性,使用长春瑞滨4 个周期后,患者会出现踝关节抽动减少或消失、下肢远端感觉异常的轻度神经病变症状;使用12 个周期后,患者还会出现手脚感觉异常、深部肌腱反射减退、踝周感觉减退等症状。长春瑞滨的常见毒副作用还包括静脉炎,与一般静脉炎相比,其皮肤坏死程度、疼痛感都较为严重:一开始穿刺处出现静脉局部红肿现象,沿静脉走向条束状改变,进而出现静脉处皮肤水疱、溃烂,直至结痂愈合。其他不良反应还包括中性粒细胞减少、发热、疲劳、胸痛、肿瘤部位疼痛等。
2.2 吡咯嗪生物碱
吡咯嗪生物碱是来源于鸟氨酸的一类生物碱,其毒性主要来源于肝脏中的代谢产物——代谢性吡咯,因此,肝脏是吡咯嗪生物碱毒性的主要靶器官。2016年,欧洲药品监管局规定肝毒性吡咯嗪核生物碱(HPAs)的每日摄入量不得超过0.007 μg·kg,这也是近年来国外对HPAs最严格的规定。吡咯嗪生物碱中毒分为急性、亚急性和慢性。急性中毒的主要特征是出血性坏死、肝肿大和腹水;亚急性中毒时会出现肝静脉阻塞,导致HSOS;而慢性中毒则会造成胆管上皮坏死、纤维化、肝硬化,严重时可导致肝功能衰竭。吡咯嗪生物碱中毒对肺和心血管也具有不同程度的损伤,可造成肺血管重构、弹性近端肺动脉硬化、肌肉动脉内膜或中层增厚、内皮增生、动脉平滑肌扩散到无肌肉化的区域、正常肌肉化区域的平滑肌肥大、毛细血管闭塞等病变,而闭塞的毛细血管会增加流动阻力引起肺动脉压升高,进而增加右心的工作量,造成右心室肥大,最终导致肺心病。
2.3 紫杉烷类生物碱
紫杉烷类生物碱作为一种有效的抗肿瘤药物,在发挥药效的同时也伴随着严重的毒副作用。临床研究表明当紫杉醇的化疗剂量>170 mg·m时会出现轻微肌痛;当化疗剂量>250 mg·m时可致近端肌无力;当累积剂量超过600 mg·m时可能会出现严重的神经病变。其不良反应主要包括超敏反应、周围神经病变、肌痛、关节痛、骨髓抑制、心动过缓、恶心、腹泻、黏膜炎和脱发。Ⅰ型超敏反应表现为轻度低血压、呼吸困难伴支气管痉挛、荨麻疹、腹部和四肢疼痛、血管神经性水肿,这些反应与输注速度有关。而紫杉烷类生物碱引起的周围神经病变是一个累积的过程,紫杉烷类生物碱能影响微管的组装和拆卸,减少正常的轴突运输,导致长度依赖性感觉运动轴突神经病变。临床上化疗引起的周围神经病(CIPN)表现为不同强度的感觉、运动或自主神经功能障碍。感觉障碍的症状包括麻木、刺痛、触摸感觉改变、振动减弱,还时常伴随痛感,包括自发性燃烧、射击或电击样疼痛,以及机械性或热敏性痛觉,甚至发展为感官知觉丧失。肌痛可在输注过程或使用高剂量的紫杉醇治疗后观察到,但通常在5 d 内消退。在输注剂量为135 ~250 mg·m的紫杉醇Ⅲ期临床试验中发现紫杉醇剂量达到250 mg·m时肌水肿发生率更高。而肌病或由肌纤维功能障碍引起的神经肌肉疾病很少被注意到,仅在接受高剂量紫杉醇(300 ~350 mg·m)联合其他抗肿瘤药物的患者中出现时引起关注。
2.4 乌头类生物碱
乌头碱是附子中的一种双酯型二萜生物碱,其毒性主要作用于中枢神经系统、心脏和肝脏等器官。口服乌头碱0.2 mg 可引起中毒,其致死量是2 ~4 mg,死亡原因主要为心律失常和呼吸衰竭。患者发病时间多为服药后30 min ~1 h,绝大多数附子中毒患者同时具有神经系统、心血管和胃肠道反应。神经毒性表现为口舌麻木、四肢肌肉无力、触觉减弱或消失、肌肉强直不能屈伸,严重者出现体温下降、二便失禁的情况。心脏毒性表现为低血压、心悸、胸痛、心动过缓、窦性心动过速、心室异位、尖端扭转型室速、心室颤动。胃肠道反应表现为流涎、恶心、呕吐、腹痛、腹泻、胃部灼热、肠鸣音亢进。根据临床表现,中毒的程度可分为轻、中、重度。轻度仅有口咽灼痛、唇舌、肢体麻木、头昏眼花、恶心呕吐、腹痛腹泻、胸闷等症状;中重度中毒者表现为全身发麻、语言不清、流涎、多汗、烦燥不安、心慌气促、抽搐、昏厥、瞳孔缩小、视物模糊、缺氧征、心律不齐等,严重者会出现循环衰竭休克状态。表2 列出了部分研究热度较高的生物碱毒性的相关临床研究。
表2 生物碱毒性的相关临床研究
Tab 2 Clinical research on alkaloid toxicity
生物碱毒性剂量给药方式出现不良反应时间毒性表现参考文献长春瑞滨 25 mg·m-2静脉推注 8个周期,(7 d/次,28 d/周期) 血小板减少、中性粒细胞减少、白细胞减少[23]40 mg 溶于100 mL 0.9%氯化钠注射液静脉滴注 6 ~10 d骨髓抑制、胃肠道反应、神经毒性、注射部位红肿[24]千里光碱 0.015 ~3 mg/(kg·d) 口服2 周至数月肝坏死、肝纤维化、肝硬化、高胆红素血症、疼痛性肝脏肿大、腹腔积液[25]紫杉醇150 ~175 mg·m-2静脉滴注 8 d 后(3 ~4 周/次,2 ~3 周期为一疗程)恶心呕吐、肌肉关节酸痛、周围神经毒性、脱发、血红蛋白下降、白细胞下降、血小板下降、静脉炎[26-27]240 mg 溶于500 mL 0.9%氯化钠注射液静脉滴注 10 min 后呕吐、肢体不自主抽搐、心悸、胸闷、大小便失禁[28]135 ~200 mg·m-2静脉滴注 8 d 后(3 ~4 周/次)骨髓抑制、过敏反应、手足麻木、恶心呕吐、脱发、腹泻[16-17][29-30]乌头碱含有乌头碱的药酒5 ~50 mL口服0.5 ~3 h 后口咽灼痛,唇舌、肢体麻木,头昏眼花,恶心呕吐,腹痛腹泻,胸闷[31]单方煎服生草乌20 g口服10 ~40 min口周、四肢麻木、恶心、呕吐、心悸、血压下降 [32]乌头炮制的药酒150 mL口服1 h 后晕厥、胸闷、四肢麻木、呕吐、大汗、血压60/40 mmHg[18]乌头粉12 g口服10 min 后头晕、口唇麻木、四肢乏力伴恶心呕吐[21]
3 生物碱毒性的相关基础研究
正如生物碱临床应用中所表现出的毒性症状,动物实验也得到相应的证实。裴天仙等给予大鼠静脉滴注酒石酸长春瑞滨(NVB)4 个周期后,涂片结果显示骨髓细胞稀疏,各系造血细胞均减少,粒细胞比例明显降低,显示NVB 可抑制造血系统。祁乃喜等研究表明吡咯嗪生物碱以100 g/(kg·d)的剂量给予大鼠连续灌胃7 d,尿液中内源性小分子代谢物(如氧化三甲胺、牛磺酸)含量上升,表明吡咯嗪生物碱能对大鼠的肝肾造成损伤。Flatters 等在大鼠实验中发现,紫杉烷类生物碱所致的神经病变与轴突中线粒体肿胀呈空泡状的显著增加有关,紫杉烷类生物碱使线粒体通透性转换孔(mPTP)开放,引起线粒体内钙离子外流,影响钙介导的神经元兴奋性,最终诱发神经毒性。雷怀成等发现给予大鼠1.46 mg·kg乌头碱进行一次性灌胃染毒后,HE 染色结果显示心肌间质淤血,部分心肌细胞出现嗜酸性变、核浓缩;而免疫组化结果显示染毒后第2日心肌细胞凋亡数最多,但是第3日、第5日呈下降趋势,可能是因为乌头碱在体内的消除速度快,对器官和组织的作用时间短,心肌中的凋亡细胞逐渐被巨噬细胞吞噬。表3 列出了热度较高的生物碱毒性的相关基础研究。
表3 生物碱毒性的相关基础研究
Tab 3 Basic research on the toxicity of alkaloids
生物碱动物类型受试剂量毒性剂量给药方式给药时间毒性表现参考文献长春瑞滨 Beagle 犬6,12,24 mg·m-2 24 mg·m-2静脉注射 7 d/次,21 d/周期,[37]给药4 个周期,末次给药后为停药恢复期,约2个给药周期精神沉郁、活动减少、俯卧、呕吐、腹泻、形体消瘦斑马鱼0.167,0.25,0.5 mg·mL-1>0.167 mg·mL-1静脉注射 单次,24 h 后观察 抑制红细胞和中性粒细胞[38]家兔5 mg 溶于3 mL 0.9%氯化钠注射液5 mg 溶于3 mL 0.9%氯化钠注射液皮下注射 单次,24 h 后观察 真皮层纤维碎裂、毛囊周期性生长中断、部分区域毛囊结构完全丧失、薄壁血管较少[39]新西兰白兔 1.2 mg·kg-11.2 mg·kg-1静脉注射 3 d,末次给药24 h后观察耳静脉高度扩张充血、血管周围疏松结缔组织水肿伴大量淋巴细胞和嗜中性粒细胞、吞噬细胞浸润[40]SD 大鼠5,10,20 mg·kg-1 20 mg·kg-1静脉注射 每周给药2 次,持续3 周或6 周,末次给药24 h 后观察体重减轻、食欲减退、消瘦脱毛、粪便干燥、粪便中有白色颗粒、白细胞和红细胞均减少、胸腺和脾脏萎缩、睾丸轻度萎缩、曲细精管退化、淋巴结损伤[41]千里光碱 C57BL/6 小鼠50 mg·kg-150 mg·kg-1灌胃单次给药,48 h 后观察活动减少、精神畏缩、毛发竖立、肝细胞大面积坏死、细胞核固缩明显、肝窦内有大量瘀血、内皮细胞脱落[42]8.5 d ICR小鼠胚胎12.5,25,50,100 μg·mL-1>25 μg·mL-1共孵育48 h尿囊、心、脑、尾神经管、视听嗅系统、腮弓、颌突及肢芽等胚胎器官形态分化指标评分较低[43]KM 小鼠含生药60,120 g·kg-1 的药液>含生药60 g·kg-1 的药液灌胃单次给药,14 d 后观察肝脏中央静脉扩张、中央静脉周围的肝细胞出现轻度水样变性、局灶性肝窦轻度扩张[44]C57BL/6 小鼠15,30,45,60 mg·kg-1>45 mg·kg-1灌胃单次给药,30 h 后观察血液中ALT 和AST 增加、肝脏中心周围区域坏死[45]Wistar 大鼠86,104,125,150,180,215 mg·kg-1>104 mg·kg-1 腹腔注射 单次给药,2 ~3 d后观察肝小叶中心出血性坏死、肺内膜部分坏死、肺泡间隔增厚程度不同、支气管和支气管上皮发育不良[46]紫杉醇SD 大鼠38,50,65,85 mg·kg-1 85 mg·kg-1静脉注射 单次给药,5 d 后观察胸腺髓质萎缩、骨髓再生不良、脾内淋巴组织衰竭[47]SD 大鼠1,3.3,10 mg·kg-1 10 mg·kg-1静脉注射 5 d/次,给药6 次后观察红细胞、血红蛋白、嗜中性白细胞均下降、胸腺萎缩、骨髓再生不良、附睾萎缩[48]CBA 小鼠50 mg·kg-150 mg·kg-1静脉注射 单次给药,24 ~72 h 后观察微核个体变大、形状各异[49]乌头碱斑马鱼3,10,30 μmol·L-1>10 μmol·L-1共孵育 48 h 后观察心包明显肿胀、心脏舒展和收缩功能发生障碍[50]KM 小鼠1.299,1.856,2.532,3.788,5.412,7.732 mg·kg-1>3.788 mg·kg-1 灌胃单次蜷缩、呕吐、身体拉长、毛发湿润、部分出现惊厥、弹跳[51]斑马鱼5,10,30,60 mg·L-1>10 mg·L-1共孵育 24 h 后观察心脏区域心包囊水肿、心膜出血、血细胞在心区堆积、心跳微弱甚至停止、血液循环受阻甚至停止[52]
续表3
生物碱动物类型受试剂量毒性剂量给药方式给药时间毒性表现参考文献9.5 d 的SD大鼠胚胎1,2.5,5,10 mg·mL-1>2.5 mg·mL-1 共孵育 48 h 后观察顶臀长和头部长度减少、体细胞数量减少、卵黄囊循环、屈曲、心脏、视神经系统、肢芽等器官的发育受到影响[53]
4 生物碱的毒性机制
4.1 长春花生物碱的毒性机制
长春瑞滨是亲脂性药物,可直接引起血管内皮细胞损伤,因此静脉炎是长春瑞滨临床使用中最常见的毒副反应。长春瑞滨增强了体内外p38 蛋白的磷酸化,并促进了细胞内活性氧(ROS)的生成和下游NF-κ
B 信号通路中炎症介质(如TNF-α
、ILs、iNOS)的过度释放。而ROS 水平的增加又加速了p38/NF-κ
B 信号通路的激活,最终造成静脉内皮细胞丢失、高渗透性反应、间质水肿、炎性细胞浸润等现象。此外,长春瑞滨诱导的血管损伤与氧化应激也有一定的联系。细胞在各种刺激下产生的防御反应导致ROS 不断产生,进而引起线粒体内促凋亡蛋白(如Bax、Bak)由内膜向外膜的迁移,线粒体膜破裂,细胞色素C 进入胞质。胞质中的细胞色素C 与凋亡蛋白酶激活因子1(Apaf-1)结合并产生凋亡体,该凋亡体可以结合并裂解pro-caspase-9 蛋白,使caspase-9 活化。活化的caspase-9 进一步加工和裂解caspase-3,导致后续一系列细胞凋亡级联反应的发生。而长春花生物碱的外周神经毒性是由于其与微管蛋白结合抑制有丝分裂纺锤体动力学,干扰轴突运输,诱导轴突微管螺旋化,最终引起轴突损伤。4.2 吡咯嗪生物碱的毒性机制
4.2.1 肝毒性机制 吡咯嗪生物碱经肝脏中细胞色素P450(CYP450)氧化后可生成具有肝毒性的代谢产物,如吡咯嗪生物碱氮-氧化物和脱氢吡咯嗪生物碱。研究发现,吡咯嗪生物碱氮-氧化物可在体内通过代谢活化实现生物学转化,最终形成的吡咯-蛋白加合物可导致HSOS 的发生。虽然脱氢吡咯嗪生物碱可与细胞中的酶、蛋白质、DNA 等亲核基团发生烃化反应,最终造成肝损伤。但是脱氢吡咯嗪生物碱的化学性质不稳定,在体内可进一步水解为几乎无毒的脱氢吡咯生物碱6,7-二氢-7-羟基-1-羟甲基-5H-吡咯嗪(DHP)。研究发现吡咯嗪生物碱所造成的肝损伤主要集中于肝腺泡分区的第三区带,其原因在于该区带的肝细胞有含量丰富的CYP450,但谷胱甘肽(GSH)的含量较少,而肝窦内皮细胞中的GSH 含量更少。因此,吡咯嗪生物碱经氧化应激作用后更容易造成肝窦和肝小静脉内皮的损伤。吡咯嗪生物碱还可以通过泛素/蛋白酶体和钙蛋白酶体系统诱导抗凋亡蛋白Bcl-xL降解,使释放到胞浆的细胞色素C 在ATP 的作用下与Apaf-1 形成复合物激活caspase-9,导致caspase-9/caspase-3 信号级联的激活,最终导致肝细胞凋亡。
4.2.2 肺毒性机制 肺动脉平滑肌细胞(PASMC)的异常增殖、迁移和凋亡与肺动脉高压(PAH)中的血管重塑密切相关。过度的增殖促进PASMC 群体扩张,PASMC 的迁移又进一步导致动脉肌肉化、血管狭窄和血管张力增加,最终造成肺动脉压力升高,促进了PAH 的发生。PASMC 中Ca稳态的变化是PAH 中肺血管收缩和重建的重要影响因素。钙离子内流(SOCE)是PASMC 调节Ca内流的主要Ca通道之一,调控着PASMC 的增殖、凋亡和迁移。而钙调神经磷酸酶(CaN)/活化T 细胞核因子(NFAT)通路是SOCE 最重要的下游信号通路,参与吡咯嗪生物碱诱导的PAH 中PASMC 的异常增殖、迁移和凋亡。吡咯嗪生物碱可诱导CaN 和NFAT 对接,使NFAT 去磷酸化并启动转录程序,最终造成SOCE 诱导的Ca内流增加。另一方面,吡咯嗪生物碱诱导的肺毒性也被认为是由脱氢吡咯嗪生物碱引起的,其在肝脏中产生并随血流进入肺小动脉,使肺血管壁增厚且血栓增多,导致肺动脉血管闭塞和血管周围炎症。这些改变伴随着心肌神经体液因子(BNP、ET-1)和参与心脏发育的转录因子(HOP、Islet1)的mRNA 水平的增加,这些转录因子可能参与心脏重构。
4.3 紫杉烷类生物碱的毒性机制
紫杉烷类诱导CIPN 的机制如下:紫杉烷类可引起微管破坏,并通过损害轴突运输激活背根神经节神经元内多种受体(如N
-甲基-D
-天冬氨酸受体)和电压门控离子通道(如电压门控钙通道亚基α
2δ
-1、钠通道Nav1.7)来改变外周神经元的电生理特性,导致周围神经元的过度兴奋。紫杉烷类还可诱导有髓和无髓感觉神经纤维肿胀,加速线粒体空泡化,改变线粒体膜电位,增加钙离子释放,而线粒体损伤又进一步促进ROS 的生成,导致轴突内氧化应激和神经元内钙稳态失调,造成周围神经细胞凋亡和脱髓鞘,最终改变周围神经元的兴奋性。研究表明,紫杉烷类生物碱会导致小鼠体内Nrf2 抗氧化反应元件(Nrf2-ARE)功能受损并降低Nrf2 反应基因(如HO-1
、γ
-GCLC
和NQO1
)的表达,这些基因均与神经性疼痛相关。此外,紫杉烷影响小胶质细胞和星形胶质细胞活化的同时还会导致免疫细胞的激活和促炎细胞因子(白介素和趋化因子)的释放,造成周围神经元伤害性感受器的敏化和过度兴奋。4.4 乌头类生物碱的毒性机制
4.4.1 心脏毒性机制 乌头碱类生物碱的心脏毒性是由于它们作用于心肌细胞膜的电压敏感钠通道所致。研究表明,乌头碱和新乌头碱对体外钠通道的亲和力与大鼠的LD
相关,乌头碱和新乌头碱以高亲和力结合位点2 的电压敏感钠通道使其处于开放状态,从而引起钠通道的持续激活,有利于Na内流,再通过Na-Ca交换系统使细胞内Ca增加,细胞内钠钙失衡造成的Ca超载会提高异位起搏点的自律性,最终造成心律失常。心室肌中钙超载还可以增加兰尼碱受体2(RYR2)的开放频率,造成钙泄漏,增加胞浆中钙离子浓度,当持续性升高的钙离子不能被有效的消除将引发肌浆网对钙离子的过度释放,引起钙震荡和钙波,最终造成心室肌的颤动或扑动,心脏无法有效泵血。线粒体功能障碍在乌头碱的毒性机制中也起着至关重要的作用,乌头碱可导致线粒体内超氧化物和ROS 的水平升高,ATP的含量下降。ROS 的积累可致线粒体肿胀,mPTP开放,从而使细胞色素C 等内容物流向胞质,最终引发心肌细胞凋亡。ROS 还可以诱导线粒体内膜脂质的过氧化损伤,导致ATP 和线粒体呼吸链复合物的活性下降,最终造成线粒体功能障碍。4.4.2 神经毒性机制 乌头的神经毒性与氧化应激、离子转运通道活性改变和能量代谢相关。越来越多的证据表明多巴胺可能是ROS 的内源性来源,多巴胺的酶促和非酶促代谢均可导致ROS的产生。在生理状态下,代谢过程中产生的ROS或其他自由基可以被超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)及时清除。但在病理状态下,过多的多巴胺代谢会导致ROS 无法及时清除,最终造成细胞内ROS 的激增。研究表明,PC12 细胞中抗氧化酶系统的功能障碍在乌头的细胞毒性中起重要作用,乌头可诱导PC12细胞中多巴胺过度释放,并显著降低PC12 细胞中SOD 和GPx 的活性,造成细胞内自由基增加,从而诱导氧化应激的发生。乌头碱和钙离子竞争结合细胞膜上的磷脂会改变钠转运通道的活性,阻止钠离子内流,抑制神经冲动的传导。同时乌头碱还影响与疼痛相关的中枢内源性神经递质(如5-羟色胺、儿茶酚胺、乙酰胆碱、内啡肽)与相应的受体结合,最终造成感觉神经和中枢神经的麻痹。此外,乌头碱还会破坏星形间质细胞膜的完整性,使细胞内钙离子外流,细胞呼吸链中断,无氧呼吸增加,糖原大量分解,最终导致神经细胞能量代谢障碍。
4.4.3 肝毒性机制 乌头碱类生物碱引起肝毒性的机制涉及多种成分、靶点和途径的联合作用。研究表明,乌头碱可能通过调节关键靶标AKT1、EGFR、HRAS 和IGF1 来抑制PI3K 和Akt 的磷酸化,降低HIF-1 和mTOR 的表达,破坏氧化还原稳态和能量平衡,最终造成自噬障碍和细胞凋亡,降低肝细胞的耐受性。当大鼠服用乌头碱类生物碱时可降低体内葡萄糖六磷酸脱氢酶(G6PD)、谷胱甘肽还原酶(GSR)、谷氨酰胺(GLH)的表达,造成GSH 的含量显著下降,机体抗氧化能力减弱,细胞内ROS 的含量升高,细胞膜磷脂过氧化,最终破坏细胞和线粒体膜结构,影响能量代谢。且服用乌头碱类生物碱的部分大鼠肝脏病理切片还出现了脂肪变性现象,说明脂质代谢异常,而脂质代谢紊乱会通过炎症介质的形成和异常分泌来加剧炎症反应。
5 小结与展望
本文对近20年研究热度较高的长春花类、吡咯嗪类、紫杉烷类和乌头类生物碱的毒性剂量、毒性表现和毒性机制进行了归纳总结,分析发现,这四类生物碱的毒性主要体现在心脏、肝脏、神经系统和呼吸系统方面,且毒性机制包含氧化还原稳态的失衡、炎症因子的释放、细胞凋亡、离子通道的异常表达和线粒体功能障碍。生物碱的毒副作用大大限制了其研究开发和临床应用,开展生物碱增效减毒的研究对于其更广泛的临床应用具有非常重要的意义。配伍是中医用药的主要形式,通过适当配伍可达到增效减毒的目的。生物碱类有毒中药多辛香,常配伍味酸之白芍、白及、乌梅、赤石脂,味甘之甘草、黄芪、人参、生地黄、何首乌,味苦之防己、黄芩、佛手、秦艽等。研究发现,SD 大鼠给予乌头碱前用甘草水提取物预处理一周后与未经处理组相比,大鼠体内乌头碱的含量减少,原因可能是甘草通过上调CYP 酶和外排转运蛋白(P-gp)的表达来参与附子中二酯二萜生物碱和单酯二萜生物碱的转运,使毒性较大的生物碱代谢成毒性较小的化合物,降低附子的毒性。除药物配伍减毒外,发酵、制霜去毒、水火共制减毒等炮制方法也能达到相应的效果。然而,生物碱的成分多样,毒性机制复杂,基础研究并不能完全模拟生物碱在人体内的作用,故如何使生物碱发挥增效减毒的作用还需进一步研究和探讨。

