基于UHPLC-LTQ-Orbitrap MSn的苦碟子醇提物不同洗脱部位化学成分分析
赵媛媛,任一冉,刘兆薇,刘洁,刘珍清*,刘颖,3*(.北京中医药大学中药学院,北京 0009;.北京中医药大学北京中医药研究院,北京 0009;3.北京市科委中药生产过程控制与质量评价北京市重点实验室,北京 0009)
苦碟子,来源于菊科植物抱茎苦荬菜Ixeris sonchifolia
(Bunge)Hance 的全草,又名苦荬菜、满天星,为多年生草本植物,产于我国东北、华北等地。据《内蒙古中草药》记载,苦碟子味苦、性寒,具有清热解毒、凉血、活血、排脓之功效。苦碟子含有多种类型化学成分,主要活性成分为核苷类(腺苷等)、有机酸类(绿原酸、阿魏酸等)、黄酮类(芹菜素、木犀草素等)、倍半萜内酯类(Ixerin Z、Sonchifoliasolide B 等)以及三萜类(抱茎苦荬菜皂苷、齐墩果酸等)化合物等。现代药理学研究表明,苦碟子具有增加脑血流量、增加冠脉血流量、镇痛镇静、抗病毒、抗肿瘤、保肝、调节血脂代谢等多种药理活性。目前,以其水提物制备的苦碟子注射液在临床上被广泛用于治疗脑梗死、冠心病、肺源性心脏病、脑出血、糖尿病及其并发症等,且其化学物质基础的研究相对清晰和深入。而有研究表明,活性成分在苦碟子醇提物中含量更高,且研究者发现苦碟子醇提物中分离出的三萜皂苷类和倍半萜内酯类化合物具有良好的抗肿瘤活性,其黄酮和木脂素类化合物有成为天然抗氧化剂的潜力。因此,苦碟子醇提物的化学物质基础亟待被阐明。超高效液相色谱-线性离子阱串联静电场轨道阱质谱(UHPLC-LTQ-Orbitrap MS)具有良好的分离效果及强大的结构表征能力,已广泛应用于中药复杂成分的研究中。本研究利用LTQ-Orbitrap串联质谱将LTQ 的灵敏快速和Orbitrap 的高分辨、高质量准确度结合起来,阐明苦碟子提取物经大孔树脂分离的30%、50%、70%和95%乙醇洗脱部位的化学成分及其差异,表征苦碟子醇提物复杂系统的化学物质基础,为其活性部位的筛选提供依据。
1 材料
Ultimate 3000 超高效液相色谱仪,LTQ-Orbitrap XL 质谱仪,配有电喷雾离子源(ESI)、Xcalibur 2.1化学工作站(美国Thermo Scientific 公司);R200D型分析天平(十万分之一,德国Satorius 公司)。
3-咖啡酰奎宁酸(批号:18030620)、4-咖啡酰奎宁酸(批号:18031001)、5-咖啡酰奎宁酸(批号:18032403)、阿魏酸(批号:18032601)、原儿茶醛(批号:18031305)、3,4-二咖啡酰奎宁酸(批号:18031602)、3,5-二咖啡酰奎宁酸(批号:18031610)、4,5-二咖啡酰奎宁酸(批号:18031604)、咖啡酸(批号:18032003)、芹菜素(批号:18032605)、木犀草素(批号:18012605)、芹菜素-7-O
-β
-D
-葡萄糖苷(批号:18012505)、木犀草-7-O
-β
-D
-葡萄糖苷(批号:17121210)、鸟苷(批号:18031603)、腺苷(批号:18022801)对照品(成都曼斯特生物科技有限公司,纯度均>98%),木犀草素-7-O
-β
-D
-葡萄糖醛酸苷对照品(广州绿百草生物科技有限公司,批号:HN156300U,纯度>98%)。苦碟子药材购自通云联商贸保定有限公司,经北京中医药大学北京中医药研究院刘颖副研究员鉴定为菊科植物抱茎苦荬菜Ixeris sonchifolia
(Bunge)Hance 的全草。乙醇(北京化工厂,分析纯),娃哈哈纯净水(杭州娃哈哈集团有限公司),甲酸、乙腈(赛默飞世尔科技有限公司,质谱纯)。2 方法
2.1 色谱条件
采用 Waters Acquity UPLC BEH C色谱柱(2.1 mm×100 mm,1.7 μm),柱温35℃,流动相乙腈(A)-0.1%甲酸-水溶液(B),流速0.3 mL·min,进样量2 μL,不同洗脱部位采用不同洗脱梯度:30%乙醇部位洗脱程序(0 ~1 min,5%A;1 ~4 min,5% ~10%A;4 ~28 min,10% ~30%A;28 ~30 min,30%~90%A;30 ~31 min,90%A;31 ~33 min,90%~5%A;33 ~35 min,5%A);50%乙醇部位洗脱程序(0 ~1 min,5%A;1 ~4 min,5% ~20%A;4 ~28 min,20% ~40%A;28 ~30 min,40%~90%A;30 ~31 min,90%A;31 ~33 min,90%~5%A;33 ~35 min,5%A);70%乙醇部位洗脱程序(0 ~1 min,5%A;1 ~4 min,5% ~40%A;4 ~28 min,40% ~60%A;28 ~30 min,60%~90%A;30 ~31 min,90%A;31 ~33 min,90%~5%A;33 ~35 min,5%A);95%乙醇部位洗脱程序(0 ~1 min,5%A;1 ~2 min,5% ~50%A;2 ~30 min,50% ~90%A;30 ~31 min,90%A;31 ~33 min,90% ~5%A;33 ~35 min,5%A)。
2.2 质谱条件
负离子检测模式,电喷雾离子源(ESI),鞘气和辅助气均为氮气,纯度>99%;鞘气流速40 个单位,辅助气流速20 个单位;碰撞气为氦气,纯度>99.99%;电离源电压3.0 kV;离子源温度350℃;管透镜电压110 V;干燥气流速 15 L·min;碰撞电压6 ~10 V;一级质谱图谱采用傅里叶变换高分辨全扫描(FT),质量扫描范围m/z
100 ~1200;检测分辨率30 000;二级质谱数据采用数据依赖型扫描(DDS),选取一级丰度最高的3个离子进行碰撞诱导解离(CID)碎片扫描,CID 激活单位0.25 q,激活时间30 ms,归一化碰撞能量为35%。对于未产生二级碎片的母离子采取具有针对性的母离子列表扫描(PL)。2.3 溶液的制备
2.3.1 供试品溶液 苦碟子药材中加入70%乙醇回流提取3 次:第一次10 倍量2 h,第二次8 倍量1 h,第三次8 倍量1 h,药液过滤,合并3 次滤液,回收乙醇,浓缩至无醇味,得浓缩药液。D101 大孔树脂预处理后,湿法装柱,上样。分别经3 倍柱体积的30%、50%、70%和95%乙醇洗脱,收集各部位洗脱液,浓缩、干燥,得苦碟子药材醇提物的30%、50%、70%和95%乙醇洗脱部位干膏。分别称取各洗脱部位干膏适量,置10 mL 量瓶中,分别加对应洗脱溶剂定容,混匀,制成质量浓度为24 mg·mL的苦碟子不同洗脱部位的溶液,超声处理10 min,放冷,13 000 r·min离心15 min,过0.22 μm 微孔滤膜,滤过,滤液即为苦碟子醇提物不同洗脱部位供试品溶液。
2.3.2 混合对照品溶液 分别称取3-咖啡酰奎宁酸、4-咖啡酰奎宁酸、5-咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸、咖啡酸、阿魏酸、芹菜素、芹菜素-7-O
-β
-D
-葡萄糖苷、木犀草素、木犀草素-7-O
-β
-D
-葡萄糖苷、木犀草素-7-O
-β
-D
-葡萄糖醛酸苷、鸟苷、腺苷和原儿茶醛对照品适量,置10 mL 量瓶中,分别加入30%、50%、70%和95%乙醇溶解,制成对照品溶液。分别精密量取上述各对照品溶液0.5 mL,置10 mL 量瓶中,加入对应浓度的乙醇制成各成分质量浓度为30 μg·mL的混合对照品溶液。2.4 质谱数据分析
分别从国内外专业数据库(PubMed,知网等)相关研究文献中获得苦碟子药材中130 个成分的信息,建立苦碟子药材化学成分数据库。采用高分辨数据处理软件QualBrowser of Xcalibur 2.1(Thermo Fisher Scientific),根据各成分碳、氢、氧原子的个数计算精确相对分子质量,依据测定相对分子质量与理论精确相对分子质量的偏差小于5 的原则,确定各色谱峰对应化合物的分子式,在已建立的苦碟子药材化学成分数据库中检索匹配的化合物。根据对照品确定每类化合物的裂解规律和诊断离子,结合特征性多级质谱裂解碎片信息、相对丰度或参考文献等,进一步推测化合物结构。对于裂解规律一致的同分异构体,采用ChemBioDraw Ultra 14.0 软件给出的有机化合物疏水常数(ClogP)对极性进行判断,同时结合化合物的保留时间进行推测。
3 结果
采用上述经优化的液相色谱、质谱检测条件,采集苦碟子醇提物不同洗脱部位负离子模式下的UHPLC-LTQ-Orbitrap MS数据,分别在30%、50%、70%和95%乙醇洗脱部位中鉴定出化合物36、56、33 和 15 个,共计80 个,见表1。各化合物的位置分别在基峰离子流图(BPI)中进行了标记,见图1。

图1 苦碟子醇提物不同洗脱部位的负离子模式BPI 离子流图Fig 1 Based peak ion chromatogram of four different elution parts from Ixeris sonchifolia(Bunge)Hance alcohol extract at negative ion mode
表1 苦碟子醇提物中化学成分的UHPLC-LTQ-Orbitrap MS 鉴定
Tab 1 Identification of chemical constituents in (Bunge)Hance alcohol extract by UHPLC-LTQ-Orbitrap MS
误差(δ)MS2 碎片离子信息理论值[M-H]-(m/z)不同极性部位化合物分类实测值[M-H]-(m/z)化合物tR/min鉴定成分分子式参考文献A B C D 1* 0.95鸟苷C10H13O5N5 282.0832 282.08371.58 149.9625,132.9389+ - - - 核苷 [14]2 1.03胸苷C10H14O5N2 241.0818 241.08190.01 125.02448+ - - - 核苷 [14]3* 1.25腺苷C10H13O4N5 266.0883 266.08850.21 134.0472,119.0342+ - - - 核苷 [14]4* 4.78咖啡酸C9H8O4179.0338 179.03470.83 134.9064,149.0669- + - - 有机酸[17-18]5* 3.753-咖啡酰基奎宁酸C16H18O9353.0867 353.0867 -0.01 190.9723,178.9535,135.0316,126.9852,173.0044+ - - - 有机酸[17-18]6* 5.745-咖啡酰基奎宁酸C16H18O9353.0867 353.0865 -0.16 190.9367,172.9447,178.9389,134.8889,126.9735 7* 6.31,4.984-咖啡酰基奎宁酸C16H18O9353.0867 353.0864 -0.79 173.0088,179.0653,190.9670,134.8661,126.9032 8* 14.74,7.28 3,4-二咖啡酰基奎宁酸C25H24O12 515.1184 515.11891.08 353.1740,335.2506,172.9343,190.9932,178.9199 9* 15.03,7.44 3,5-二咖啡酰基奎宁酸C25H24O12 515.1184 515.11921.55 353.1416,335.2243,178.9913,190.9797 10* 17.42,8.15 4,5-二咖啡酰基奎宁酸C25H24O12 515.1184 515.11890.97 353.1524,335.2575,172.9678,191.0606 11 6.22咖啡酸酐C18H14O7341.0655 341.06580.74 323.2537,297.2859,135.0569,179.0239+ - - - 有机酸[17-18]+ + - - 有机酸[17-18]+ + - - 有机酸[17-18]+ + - - 有机酸[17-18]+ + - - 有机酸[17-18]- - + - 有机酸[17-18]12* 6.72阿魏酸C10H10O4193.0495 193.04971.22 148.9787,178.0009- + - - 有机酸[17-18]13 5.923-阿魏酰基奎宁酸C17H20O9367.1023 367.1022 -0.19 192.9945,172.8985,149.0632,178.0346- + - - 有机酸[20]14 10.035-阿魏酰基奎宁酸C17H20O9367.1023 367.10250.58 190.9325,193.0605,173.0560,148.9353 15 2.36香草酸C8H8O4167.0338 167.03464.52 151.9472,138.9520,148.8305 16 10.39,6.36 菊苣酸C22H18O12 473.0714 473.07170.63 311.0013,293.0808,178.9905,148.9752- + - - 有机酸[20]+ - - - 有机酸[21]+ + - - 有机酸[22]17 13.224-羟基肉桂酸C9H8O3163.0389 163.03964.41 118.8751,134.9474+ - - - 有机酸[15]18 4.10,8.69原儿茶酸乙酯C9H10O4181.0495 181.05034.67 162.9411,134.9533+ + - - 有机酸[16]19 23.80棕榈酸C16H32O2255.2318 255.23304.60 237.2862,212.9304,150.8556,187.0291,145.0186,168.9726- - - +有机酸[23]20 20.83亚油酸C18H32O2279.2318 279.23304.42 162.982,261.220- - - +有机酸[23]21* 21.41,11.11,6.00,4.16木犀草素C15H10O6285.0393 285.03992.05 242.9833,241.1196,217.0558,199.0383,174.9084,150.9541,257.1585,132.8712+ + + +黄酮 [24]22* 25.53,14.05,6.52,4.40芹菜素C15H10O5269.0444 269.04491.86 240.9628,225.1033,227.0105,182.8081,201.0117,151.0273,148.9479 23* 13.21,6.81,5.02,3.74木犀草素-7-O-β-D-葡萄糖苷 C21H20O11447.0921 447.09260.97 285.0740,151.0812,132.8881 24* 15.88,8.37,5.32,3.83芹菜素-7-O-β-D-葡萄糖苷C21H20O10 431.0972 431.09791.67 269.0475,150.9182,183.0488,149.0275+ + + +黄酮 [24]+ + + +黄酮 [25]+ + + +黄酮 [25]25* 13.06木犀草素-7-O-β-D-葡萄糖醛酸苷C21H18O12 461.0714 461.07170.71 285.1198+ - - - 黄酮 [25]
3.1 核苷类化合物的结构鉴定
苦碟子醇提物中共鉴定出3 个核苷类化合物,即化合物1 ~3。核苷类为水溶性成分,仅在30%乙醇洗脱部位被检测到。通过与对照品的保留时间和质谱数据比对,化合物1 和3 分别鉴定为鸟苷和腺苷。鸟苷和腺苷准分子离子分别为m/z
282.0837 [M-H],m/z
266.0885 [MH],丢失一分子核糖后,分别得到碎片离子m/z
150 [M-H-Rib],m/z
134 [M-H-Rib]。 腺苷的裂解方式见图2。化合物2 的准分子离子为m/z
241.0819 [M-H],丢失一分子脱氧核糖得到碎片离子m/z
125 [M-H-Derib]。结合参考文献,推断化合物2 为胸苷。
图2 负离子模式下腺苷的裂解途径Fig 2 Fragmentation pathways of adenosine at negative ion mode
续表1
误差(δ)MS2 碎片离子信息理论值[M-H]-(m/z)不同极性部位化合物分类实测值[M-H]-(m/z)化合物tR/min鉴定成分分子式参考文献A B C D 26 13.63芹菜素-7-O-β-D-葡萄糖醛酸苷C21H18O11445.0765 445.07690.88 269.1153+ - - - 黄酮 [25]27 16.74木犀草素-7-O-β-D-葡萄糖醛酸苷甲酯C22H20O12 475.0871 475.08740.753 299.1416,285.1337+ - - - 黄酮 [26]28 16.10芹菜素-7-O-β-D-葡萄糖醛酸苷甲酯C22H20O11459.0921 459.0901 -4.50 327.1983,269.3598+ - - - 黄酮 [26]29 16.89,10.09 木犀草素-7-O-β-D-葡萄糖醛酸苷乙酯C23H22O12 489.1027 489.10331.12 285.0047,313.0936+ + - - 黄酮 [26]30 10.86,6.11,4.73木犀草素-7-O-龙胆二糖苷C27H30O16 609.1450 609.1446 -0.59 285.0360+ + + - 黄酮 [26]31 22.60刺槐素-7-O-芸香糖苷C28H32O14 591.1708 591.1706 -0.31 283.1177,267.9120,576.4531 32 15.66异鼠李素-3-O-β-D-葡萄糖苷 C22H22O12 477.1027 477.10321.09 315.1221,300.1449,462.1204,341.1961,179.1619 33 14.59,7.51 ixerin ZC21H26O9421.1493 421.14990.59 241.0850,259.0318,215.0639,197.0843,200.1062,187.0686 34 14.34,7.33 sonchifoliactone AC21H26O9421.1493 421.15020.94 215.1326,241.3954,259.2861,197.9326,35 5.61ixerin Z1C30H34O10 553.2068 553.2053 -2.61 421.2558,241.0537,259.0528,215.1886 36 10.89苦荬菜内酯BC29H32O11555.1860 555.18610.02 421.2998,241.2181,215.1785,258.8739+ - - - 黄酮 [27]+ - - - 黄酮 [28]+ + - - 倍半萜内酯[30]+ + - - 倍半萜内酯[31]- + - - 倍半萜内酯[32]- + - - 倍半萜内酯[32]37 11.76,6.68,8.68苦荬菜内酯D C21H28O10 439.1598 439.16010.23 160.9871,261.2146,421.2809,241.0379,259.0194,215.0575+ + + - 倍半萜内酯[32]38 7.5,8.833-hydroxydehydroleucodinC15H16O4259.0964 259.09700.54 215.0912,186.9824,197.0114,200.0792 39 5.47,6.69苦荬菜内酯EC15H18O5277.1070 277.10760.55 233.101,259.076,215.152,203.103,205.1730+ + - - 倍半萜内酯[32]- + + - 倍半萜内酯[32]40 6.76,5.0611,13-dihydro-13-prolyl-ixerin Z C26H35O11N 536.2126 536.21270.07 421.2335,241.0443,215.0615,259.1382,377.2057+ + - - 倍半萜内酯[32]41 15.14ixerin Z2C30H34O12 585.1966 585.19720.62 259.0314,325.1713,215.0910 42 8.01,5.55苦荬菜内酯CC21H28O11455.1547 455.1529 -1.84 409.2302,293.1419,248.9942,231.2059,275.0718,257.1704,239.1034,437.2281 43 9.15,5.829α-hydroxyzaluzalin CC15H18O4261.1121 261.11270.65 243.1606,187.0282,217.0922,198.9852,201.9225- + - - 倍半萜内酯[32]+ + - - 倍半萜内酯[32]- + + - 倍半萜内酯[33]44 9.69,6.82sonchifoliasolide DC15H18O4261.1121 261.11250.44 162.8843,217.0017- + + - 倍半萜内酯[33]45 10.98,7.37 sonchifoliasolide FC15H18O4261.1121 261.11270.56 217.1900,243.0818,199.1300,233.0455- + + - 倍半萜内酯[33]46 14.90,7.56 11-epi-8-desoxyartelinC15H18O4261.1121 261.11220.38 162.9197,199.1335 - + + - 倍半萜内酯[33]47 15.59,7.73 苦荬菜内酯AC15H18O4261.1121 261.11230.16 163.0399,217.1230 - + + - 倍半萜内酯[33]
续表1
误差(δ)MS2 碎片离子信息理论值[M-H]-(m/z)A B C D实测值[M-H]-(m/z)不同极性部位化合物分类化合物tR/min鉴定成分分子式参考文献48 6.87,5.06ixerin XC21H28O9423.1649 423.16550.57 261.078,217.0214,199.0085,243.0502,187.1177,160.9234- + + - 倍半萜内酯[33]49 11.13,6.19 11,13α-dihydroixerin ZC21H28O9423.1649 423.16510.20 261.0785,217.0791,198.9445,243.1490,160.9787,379.2991 50 12.15,6.61 sonchifoliasolide MC21H28O9423.1649 423.16570.83 217.0997,261.0827,199.0487,243.0825,160.9739 51 13.03,7.19 ixerinosideC21H28O9423.1649 423.16590.99 160.8899,178.8956,261.2669 52 9.25ixerin ZAC30H34O11569.2017 569.1999 -0.44 245.0634,198.9803,217.0734- + + - 倍半萜内酯[33]- + + - 倍半萜内酯[33]- + + - 倍半萜内酯[33]- + - - 倍半萜内酯[34]53 8.7615-hydroxy-2-oxo-1α,5α,6β,7α,10α,11βH-3-ene-12,6-carbolactone isomer1 54 9.1715-hydroxy-2-oxo-1α,5α,6β,7α,10α,11βH-3-ene-12,6-carbolactone isomer 2 55 10.6415-hydroxy-2-oxo-1α,5α,6β,7α,10α,11βH-3-ene-12,6-carbolactone isomer 3 56 11.2215-hydroxy-2-oxo-1α,5α,6β,7α,10α,11βH-3-ene-12,6-carbolactone isomer 4 57 15.3315-hydroxy-2-oxo-1α,5α,6β,7α,10α,11βH-3-ene-12,6-carbolactone isomer 5 C15H20O4263.1277 263.12810.38 219.1249,201.0794,204.0703,245.1068 C15H20O4263.1277 263.12830.60 219.0506,201.0217,204.0535,245.1414 C15H20O4263.1277 263.12850.78 152.9410,219.0904,245.2025,200.9324 C15H20O4263.1277 263.12881.06 219.0418,245.0872,200.9820 C15H20O4263.1277 263.12810.35 219.1623,201.2621,204.2135,245.0675- + - - 倍半萜内酯[35]- + - - 倍半萜内酯[35]- + - - 倍半萜内酯[35]- + - - 倍半萜内酯[35]- + - - 倍半萜内酯[35]58 6.4211,13-dihydro ixerinosideC21H30O9425.1806 425.18120.60 381.2223,407.2079,160.9069,425.3787- + - - 倍半萜内酯[36]59 7.121(10)E-4Z-3α-hydroxygermacra-1(10),4,11(13)-trien-6,12-olide-14-Oβ-D-glucopyranoside C21H30O9425.1806 425.18130.73 263.1763,381.2719,219.1718,160.9699,201.0607,191.0788- + - - 倍半萜内酯[36]60 8.45sonchifoliasolide NC21H30O9425.1806 425.18070.18 217.0802,397.3383,381.4176,160.9103,263.1326,218.9423- + - - 倍半萜内酯[36]61 8.73,7.43,5.16 62 9.08,8.46,6.07 63 9.32,8.86,6.53 11β,13-dihydrosantamarine isomer 1 11β,13-dihydrosantamarine isomer 2 11β,13-dihydrosantamarine isomer 3 C15H22O3249.1485 249.14860.75 231.0644,205.0952,112.8087,187.1413 C15H22O3249.1485 249.14920.71 231.1215,204.9694,112.8748,187.0670 C15H22O3249.1485 249.1485 -0.01 231.0803,112.8321,205.0531,187.0425- + + +倍半萜内酯[37]- + + +倍半萜内酯[37]- + + +倍半萜内酯[37]64 9.67,9.75,10.37 11β,13-dihydrosantamarine isomer 4 C15H22O3249.1485 249.14890.47 231.1137,205.1126- + + +倍半萜内酯[37]65 10.00,19.22,13.41 11β,13-dihydrosantamarine isomer 5 C15H22O3249.1485 249.14880.31 231.0367,112.8120,205.0866,187.1329- + + +倍半萜内酯[37]66 29.07,17.57 齐墩果酸C30H48O3455.3519 455.35260.66 407.4558,392.8099,246.9978,207.0420,201.9056,188.8137- - + +三萜 [38-39]67 9.16抱茎苦荬菜皂苷AC41H66O13 765.4419 765.4408 -1.17 603.2392,471.4506- - + - 三萜 [32]
续表1
注:表示与对照品比对后鉴定( indicates the compound was identified by comparison with reference standards);极性部位A ~D 分别为30%、50%、70%、95%乙醇洗脱部位(polar part A ~D represent 30%,50%,70%,95% ethanol elution part respectively)。
误差(δ)MS2 碎片离子信息理论值[M-H]-(m/z)不同极性部位化合物分类实测值[M-H]-(m/z)化合物tR/min鉴定成分分子式参考文献A B C D 68 6.69抱茎苦荬菜皂苷BC54H88O23 1103.5632 1103.5627 -0.53 -- - + - 三萜 [32]69 6.46抱茎苦荬菜皂苷CC48H78O19 957.5053 957.50580.50 -- - + - 三萜 [32]70 5.28抱茎苦荬菜皂苷DC53H86O23 1089.5476 1089.55052.93 -- - + - 三萜 [32]71 6.05,5.06,6.00,5.04七叶内酯C9H6O4177.0182 177.01900.81 132.8155,148.9030,159.0455+ + + +苯丙素[40]72 15.88,7.70,6.31丁香脂素C22H26O8417.1543 417.1541 -0.25 349.3329,387.5605,181.4032,166.0541+ + + - 苯丙素[41]73 7.04,23.86 1β,2α,3β,4α-1,2-二甲基-3,4-二苯基(2、4、5-三甲氧基苯)-环丁烷C24H32O6415.2115 415.21320.72 329.2530,351.4585,268.2189,296.0988- - + +苯丙素[41]74 10.48,6.96,4.79苦荬菜木脂素AC26H36O12 539.2123 539.21381.57 493.2413,509.3674,377.0742,152.8578+ + + - 苯丙素[41]75 10.85,7.48,5.13苦荬菜木脂素BC26H36O12 539.2123 539.21331.02 377.2081,508.3366+ + + - 苯丙素[41]76 12.894,8-(3’-甲氧基,4’-羟基)-二苯基-2,6-二羟基双四氢呋喃木脂素C20H22O8389.1230 389.12411.09 313.2358,374.3616,150.5052 77 30.18胡萝卜苷C35H60O6575.4306 575.4303 -0.26 295.2923,278.3095,412.7796 78 4.98东莨菪素C10H8O4191.0338 190.02630.28 175.9004,147.0115,159.0661 79 31.45,22.37 6,10,14-三甲基-2-戊烷酮 C18H36O267.2682 267.26861.41 223.1161,249.1018,216.9640,98.8270- + - - 苯丙素[41]- - + - 其他 [42]- + - - 其他 [43]- - + +其他 [44]80* 4.52,4.30原儿茶醛C7H6O3137.0233 137.02441.08 108.8475,121.9829,92.9162,74.7270+ + - - 其他 [45]
3.2 有机酸类化合物的结构鉴定
苦碟子醇提物中共鉴定出17 个有机酸类成分,即化合物4 ~20,基本结构为苯丙酸,如咖啡酸、阿魏酸、4-羟基桂皮酸、咖啡酸酐。此类化合物易丢失中性碎片CO(44 Da)分别产生二级碎片离子m/z
135,m/z
149,m/z
119,m/z
297;与奎宁酸结合易缩合为酯类化合物,如3-咖啡酰奎宁酸,5-咖啡酰奎宁酸,4-咖啡酰奎宁酸,3,4-二咖啡酰奎宁酸,3,5-二咖啡酰奎宁酸,4,5-二咖啡酰奎宁酸,3-阿魏酰奎宁酸,5-阿魏酰奎宁酸,此类化合物容易脱去咖啡酰基(caffeoyl)或阿魏酰基(feruloyl)产生碎片离子m/z
191,脱去奎宁酸(quinic acid)产生碎片离子m/z
179 或m/z
193,继续丢失中性碎片CO(44 Da),HO(18 Da),CO(28 Da),产生碎片离子m/z
135,m/z
173,m/z
127。如化合物13、14 互为同分异构体,具有相同的准分子离子m/z
367.10 [M-H]和碎片离子m/z
149 [M-H-quinic acid-CO],m/z
178 [M-H-quinic acid-CH],在二级质谱图中,化合物13 产生基峰离子m/z
193[M-H-quinic acid],化合物14 产生基峰离子m/z
191 [M-H-feruloyl],结合参考文献和碎片离子的相对丰度,推断化合物13 和14 分别为3-阿魏酰奎宁酸、5-阿魏酰奎宁酸。5-阿魏酰奎宁酸的裂解途径见图3。
图3 负离子模式下5-阿魏酰奎宁酸的裂解途径Fig 3 Fragmentation pathways of 5-feruloylqunic acid at negative ion mode
3.3 黄酮类化合物的结构鉴定
苦碟子醇提物中共鉴定出12 个黄酮类化合物,即化合物21 ~32,均在30%乙醇洗脱部位被检测到,分为黄酮类和甲氧基取代黄酮类。
黄酮类包括木犀草素、芹菜素和以其为苷元的黄酮苷类化合物,即化合物21 ~30。该类化合物均给出显著的分子离子峰 [M-H],其主要裂解特征通常为C 环开环,丢失中性碎片CO(28 Da),CO(44 Da),HO(18 Da)。碎片离子m/z
285,m/z
151,m/z
133 和碎片离子m/z
269,m/z
151,m/z
149 可以分别作为以木犀草素和芹菜素为苷元的黄酮类化合物的特征诊断离子。木犀草素-7-O
-β
-D
-葡萄糖醛酸苷,木犀草-7-O
-β
-D
-葡萄糖苷和芹菜素-7-O
-β
-D
-葡萄糖苷C-7 位的糖苷键易断裂,分别得到稳定的母核碎片离子,即苷元木犀草素和芹菜素。如化合物25 的准分子离子为m/z
461.0717 [M-H],丢失一分子葡萄糖醛酸取代基(GlcA,176 Da)后产生碎片离子m/z
285 [M-H-GlcA]。化合物25 与对照品的保留时间比对后,鉴定为木犀草素-7-Oβ
-D
-葡萄糖醛酸苷,裂解方式见图4。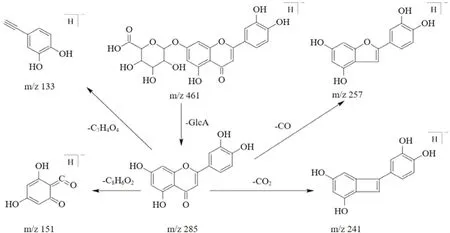
图4 负离子模式下木犀草素-7-O-β-D-葡萄糖醛酸苷的裂解途径Fig 4 Fragmentation pathways of luteolin-7-O-β-D-glucuronide in negative mode
化合物31 和32 为甲氧基取代黄酮类化合物,此类化合物易丢失甲基自由基(15 Da)。化合物31 的准分子离子为m/z
591.1706 [M-H],丢失端基脱氧六碳糖基(146 Da)和葡萄糖基(162 Da)后产生二级碎片离子m/z
283 [M-H-CHO-Glc],进一步脱去甲基(15 Da)生成碎片离子m/z
268 [M-H-146-Glc-CH]。结合参考文献,推断化合物31 为刺槐素-7-O
-芸香糖苷。化合物32的准分子离子为m/z
477.1032 [M-H],脱去葡萄糖基(162 Da)产生碎片离子m/z
315 [M-H-Glc],脱去甲基(15 Da)后生成碎片离子m/z
300 [M-HGlc-CH],黄酮母核C 环开环产生开环离子m/z
341 [A +Glc],继续产生碎片离子A。与文献比对,推断化合物32 为异鼠李素-3-Oβ
-D
-葡萄糖苷。3.4 倍半萜内酯类化合物的结构鉴定
苦碟子醇提物中共鉴定出33 个倍半萜内酯类化合物,即化合物33 ~65。苦碟子中倍半萜内酯类化合物种类与数量较多,根据相关文献,该类化合物母核以愈创木烷型和桉烷型为主。
化合物33 ~60 是以愈创木烷型为母核的倍半萜内酯类化合物。在负离子模式下其主要准分子离子有m/z
421,m/z
423,m/z
555,m/z
553,m/z
259,m/z
261,常丢失中性碎片CO(44 Da)产生γ
-内酯环特征碎片离子m/z
217,m/z
219,m/z
215,丢失HO(18 Da),CO(28 Da),Glc(162 Da),CH(15 Da)产生以m/z
259,m/z
261,m/z
217,m/z
197,m/z
241 为主的特征诊断离子。如化合物33 在负离子模式下,其准分子离子峰为m/z
421.1499 [M-H]。二级碎片离子有:m/z
259[M-H-Glc],m/z
241 [M-H-Glc-HO],m/z
215[M-H-Glc-CO],m/z
200 [M-H-Glc-CO-·CH],m/z
187 [M-H-Glc-CO-CO],裂解方式见图5。结合参考文献及质谱数据分析,推断化合物33 为ixerin Z。化合物34 和33 具有相同的准分子离子和二级碎片离子,但化合物33 的ClogP 值高于化合物34,ClogP 值越小,在反相色谱上的保留时间越短,结合参考文献,推断化合物34为sonchifoliactone A。
图5 负离子模式下ixerin Z 的裂解途径Fig 5 Fragmentation pathways of ixerin Z at negative ion mode
化合物61 ~65 是以桉烷型为母核的倍半萜内酯类化合物。在负离子模式下主要产生以m/z
249,m/z
231,m/z
205 为主的特征离子。此类化合物均产生γ
-内酯环特征碎片m/z
205 [M-H-CO],化合物61 ~65 具有相同的准分子离子m/z
249[M-H]和二级碎片离子m/z
231 [M-H-HO],m/z
205 [M-H-CO],m/z
187 [M-H-CO-HO],结合参考文献,推测其为11β
,13-dihydrosantamarine的5 个同分异构体。3.5 三萜类化合物的结构鉴定
苦碟子醇提物中共鉴定出5 个三萜类成分,即化合物66 ~70。化合物66 在负离子模式下,准分子离子为m/z
455.3526 [M-H]。二级质谱中,碎片离子为m/z
407 [M-H-HCOOH-2H],由于分子中存在C双键,具环己烯结构,C 环发生RDA 裂解,产生碎片离子m/z
207[M-H-CHO]、m/z
247 [M-H-CHO]。 根据以上裂解方式,结合参考文献及质谱数据分析,推断化合物66 为齐墩果酸。化合物67 的准分子离子为m/z
765.4408 [M-H],二级质谱中,丢失一分子葡萄糖基产生碎片离子m/z
603[M-H-Glc],再丢失一分子阿拉伯糖基(Ara)形成碎片离子m/z
471 [M-H-Glc-Ara],结合参考文献,推断化合物67 为抱茎苦荬菜皂苷A,裂解方式见图6。化合物68 ~70 分别产生准分子离子m/z
1103.5627 [M-H],m/z
957.5058 [MH]和m/z
1089.5505 [M-H],未检测到二级质谱信号,结合参考文献,推断化合物68 ~70分别为抱茎苦荬菜皂苷B、C、D。
图6 负离子模式下抱茎苦荬菜皂苷A 裂解途径Fig 6 Fragmentation pathways of ixeris saponin A at negative ion mode
3.6 苯丙素类化合物的结构鉴定
苦碟子醇提物中共鉴定出6 个苯丙素类成分,即化合物71 ~76。化合物71 为香豆素类化合物,在负离子模式下,准分子离子为m/z
177.0190 [M-H]。二级质谱中,碎片离子有:m/z
133 [M-H-CO],149 [M-H-CO],159 [M-HHO],结合参考文献,推断化合物71 为七叶内酯。化合物72 ~76 均为木脂素类化合物。在负离子模式下,分别产生准分子离子m/z
417.1541[M-H],415.2132 [M-H],539.2138 [M-H],539.2133 [M-H],389.1241 [M-H]。此类化合物易丢失甲基或甲氧基,并发生苄基裂解。以化合物72 为例,二级碎片离子为m/z
387 [M-H-2CH],181 [M-H-CHO],166 [M-H-2CH-CHO-CH],结合参考文献,推断化合物72 为丁香脂素,裂解途径见图7。
图7 负离子模式下丁香脂素的裂解途径Fig 7 Fragmentation pathways of syringaresinol at negative ion mode
3.7 其他类化合物的结构鉴定
苦碟子醇提物中共鉴定出4 个其他类成分,即化合物77 ~80。化合物77 在负离子模式下,准分子离子为m/z
575.4303 [M-H]。二级质谱中,碎片离子有:m/z
295 [M-H-CHOGlu]、278 [M-H-CH]、413 [M-H-Glu],结合参考文献,推断化合物77 为胡萝卜苷。化合物78 的准分子离子为m/z
190.0263 [M-H]。二级质谱中,碎片离子有:m/z
176 [M-H-CH],147 [M-H-CO],159 [M-H-CH-OH],结合参考文献,推断化合物78 为东莨菪素。化合物79 的准分子离子为m/z
267.2686 [M-H],产生碎片离子m/z
223 [M-H-CH],249 [M-H-HO],结合参考文献,推断化合物79 为6,10,14-三甲基-2-戊烷酮。化合物80 的准分子离子为m/z
137.0244 [M-H],产生m/z
109 [M-H-HO]的碎片离子,结合参考文献并经对照品比对,化合物80 鉴定为原儿茶醛。3.8 苦碟子不同洗脱部位成分比较
苦碟子醇提物中共鉴定出80 个化学成分,其中核苷类化合物3 个,有机酸类化合物17 个,黄酮类化合物12 个,倍半萜内酯类化合物33 个,三萜类化合物5 个,苯丙素类化合物6 个,其他类成分4 个。各洗脱部位存在5 个共有成分,分别为木犀草素、芹菜素、木犀草素-7-O
-β
-D
-葡萄糖苷、芹菜素-7-O
-β
-D
-葡萄糖苷和七叶内酯,其特有成分的数量在30%、50%、70%、95%乙醇洗脱部位中分别为13、21、7、2 个,详细分布见图8。由于逐级系统溶剂洗脱的缘故,化合物主要分布在前3 个洗脱部位,核苷类和黄酮苷类化合物主要存在于30%乙醇洗脱部位中,倍半萜内酯类化合物主要存在于50%乙醇洗脱部位中,三萜类和苯丙素类化合物主要存在于70%乙醇洗脱部位中,棕榈酸和亚油酸仅存在于95%乙醇洗脱部位中。
图8 苦碟子醇提物不同洗脱部位化合物数量维恩图分析Fig 8 Venn diagrams of different elution parts in Ixeris sonchifolia(Bunge)Hance alcohol extract
4 讨论
LTQ 的灵敏快速和Orbitrap 的高分辨、高质量准确度的结合使UHPLC-LTQ-Orbitrap MS技术应用于中药复杂系统的分析具有很大的优势,增加了苦碟子醇提物各洗脱部位中的微量成分的检出。研究中发现苦碟子醇提物中的多类成分在负离子检测模式下,色谱峰更丰富,质谱响应较强,故选择负离子模式检测各成分的质谱信息。按照化合物的极性大小将苦碟子醇提物分为30%、50%、70%和95%乙醇4 个洗脱部位,有利于降低液质联用分析成分时的共流出,减少质谱检测过程中离子的竞争,更好地采集到目标性成分,提高检测的灵敏度,可全面表征苦碟子药材醇提物的复杂成分体系,有利于进一步筛选其有效部位。
现代药理研究表明,本研究鉴定出的80 个成分大多具有降低心肌耗氧量、增加冠脉流量和血流量、抗血栓、抗肿瘤等作用。腺苷作为苦碟子注射液质量控制的指标性成分,具有明显的降低全血黏度、扩张血管、改善微循环和缺血缺氧的状态等作用。苦碟子中的有机酸类化合物具有抗炎、抗菌、抗病毒、止痛等作用,其中4-咖啡酰奎宁酸、5-咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸、咖啡酸、阿魏酸为抑制血小板聚集、防止血栓形成的活性成分。苦碟子中黄酮类化合物含量较高,是主要的生物活性物质,具有增强机体清除氧自由基能力、抑制脂质过氧化反应、降低血小板聚集、减轻心肌梗死等多种药理活性,其中,木犀草素和芹菜素为抗肿瘤作用的活性成分。有文献报道倍半萜内酯类化合物具有显著的抗肿瘤作用。三萜类化合物具有抗动脉粥样硬化的生理功能。原儿茶醛具有抗血栓形成、抗脓血、抗病毒、抗纤维化等广泛的药理活性。因此,苦碟子醇提物化学成分的全面表征将为进一步从苦碟子中分离出清热解毒、凉血活血的药效活性成分提供一定的依据。30%、50%、70%、95%乙醇洗脱部位中的共有成分为木犀草素、芹菜素、木犀草素-7-O
-β
-D
-葡萄糖苷、芹菜素-7-O
-β
-D
-葡萄糖苷和七叶内酯。30%和50%乙醇洗脱部位的特有成分较多,分别为13 个和21 个,提示苦碟子醇提物的活性成分群可能存在于30%和50%乙醇洗脱部位中。本研究建立了一种简便快速的苦碟子醇提物化学成分鉴定的UHPLC-LTQ-Orbitrap MS分析方法,并对各洗脱部位的成分差异进行了比较。研究结果为苦碟子醇提物活性部位的筛选提供了科学依据,同时,为苦碟子的质量控制和药效物质基础的研究提供了参考。

