正源方对过氧化氢诱导的血管内皮细胞氧化应激损伤的保护作用研究
周瑞,唐志书,苏洁,任美,任素娟,刘妍如,潘亚磊,宋忠兴(陕西中医药大学/陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳 712083)
放疗是临床上治疗肿瘤的重要手段,而机体经过多次辐照,射线在杀死肿瘤细胞的同时,对正常组织也会造成不可逆的损伤。文献报道辐照会导致水电解为氧化自由基,从而对机体细胞产生不可逆转的氧化应激损伤。血管内皮细胞是辐照诱发机体损伤的重要防御细胞,也是最易受到氧化损伤的细胞,因而,是用于体外研究药物抗氧化损伤的理想模型。
正源方是由西洋参、仙鹤草、南沙参、当归、重楼组方而成的临床经验方,是根据李东垣《内外病辨惑论》中的“当归补血汤”加减而来的,即原方去黄芪后,加西洋参、南沙参、仙鹤草、重楼而成,在临床已经应用近20年,其主要功效为益气养阴、清热解毒,对于恶性肿瘤放疗及特殊辐射损伤引起的血小板减少,白细胞下降,毛发脱落,皮肤红疹、斑疹、紫癜等症具有较好的疗效,能有效改善放疗后气血亏虚患者中医证候表现,并且缓解患者因放疗引起的毒副作用。前期本课题组完成了正源方的提取工艺研究及特征指纹图谱建立,也有研究证实了正源方对辐射动物和化疗引起的动物损伤具有较好的治疗效果。但是,正源方的体外抗氧化损伤作用尚不明确。因此,本文通过过氧化氢(HO)诱导人脐静脉血管内皮细胞(HUVEC)构建氧化损伤模型,探讨正源方对血管内皮细胞氧化损伤的保护作用及其机制,为其抗辐射作用及临床应用提供理论依据。
1 材料
1.1 细胞
HUVEC(北京吉纳生物科技有限公司)。
1.2 试药
正源方的提取及制备方法参考文献,Ham’s F-12K 培养基(武汉普诺赛生命科技有限公司);胎牛血清、青链霉素混合液(Biological Industries);30%HO、MTT、二甲基亚砜(DMSO)(天津市科密欧化学试剂有限公司);ECL 超敏发光液(上海天能科技有限公司);罗丹明123 检测试剂盒、活性氧检测试剂盒(碧云天生物);乳酸脱氢酶(LDH)检测试剂盒(批号:A020-2-2)、总超氧化物歧化酶(T-SOD)检测试剂盒(批号:A001-1-1)及丙二醛(MDA)检测试剂盒(批号:A003-4-1)(南京建成生物工程材料有限公司);RIPA 细胞裂解液(批号:HJ194302)、BCA 蛋白定量试剂盒(批号:U9229)(天根生物科技有限公司);p-38 蛋白抗体、p-p38 蛋白抗体(万类生物);p-JNK 蛋白抗体、JNK 蛋白抗体、p-ERK 蛋白抗体(Cell signaling Techenology 公司);ERK 蛋白抗体、兔二抗(美国Proteintech 公司)。
1.3 仪器
细胞培养箱、全波长酶标仪(美国赛默飞世尔科技公司);相差显微镜(重庆中显光电仪器有限公司);IX73 倒置荧光显微镜(日本奥林巴斯);超洁净工作台(苏净安泰仪器有限公司);流式细胞仪(美国BD 公司);凝胶电泳仪和凝胶成像仪、电泳条带灰度值分析软件Image Lab(美国Bio-Rad 公司)。
2 方法
2.1 细胞培养
HUVEC 的培养基组成为89% Ham’s F-12K培养基,10%胎牛血清和1%双抗,培养箱条件为37℃、5%CO。
2.2 正源方提取液的制备
正源方提取液的制备参考文献方法。称取干燥的正源方粉末10 mg,用1 mL PBS 超声条件下溶解,配制成 10 mg·mL的母液,于4 ℃冰箱保存备用。
2.3 正源方对细胞存活率的影响
将生长良好的HUVEC 按5×10个细胞/孔的密度接种于96 孔板中,过夜。分为5 组:对照组、模型组(500 μmol·LHO)、正源方低剂量组(50 μg·mL)、正源方中剂量组(100 μg·mL)和正源方高剂量组(200 μg·mL)。不同质量浓度正源方预培养3 h 后,加入500 μmol·LHO,培养24 h,弃去培养基,PBS洗涤2 次, 每孔加入100 μL MTT 溶液(0.5 mg·mL),4 h 后每孔加入 150 μL DMSO,在490 nm 处采用酶标仪检测各样本吸光度(A
),计算细胞存活率。2.4 正源方对H2O2 诱导的细胞线粒体膜电位的影响
将生长良好的HUVEC 按1×10个细胞/孔的浓度接种于6 孔板中。同“2.3”项下分为5 组。正源方预处理细胞3 h 后,加入500 μmol·LHO,培养24 h,弃去培养基,PBS 洗涤2 次,加入4%多聚甲醛固定细胞15 min,PBS 清洗2遍,避光条件下,在37℃中加入2 μmol·L罗丹明123 染色30 min。采用倒置荧光显微镜观察染色的细胞。使用Image J 1.43 统计各组中相同面积的十个区域的细胞平均荧光强度以及相同面积的十个区域内的平均细胞数目。
2.5 正源方对H2O2 诱导的细胞产生活性氧(ROS)的影响
将生长良好的HUVEC 按1×10个细胞/孔的浓度接种于6 孔板中。分为4 组:空白组(不含荧光探针)、对照组、HO处理组(500 μmol·L)和正源方处理组(200 μg·mL)。正源方预处理细胞3 h 后,加入500 μmol·LHO,培养24 h,用无血清培养基清洗细胞,用10 mmol·LDCFH-DA 在37℃染色20 min,离心收集细胞。用无血清培养基洗涤细胞,并使用流式细胞仪(BD Biosciences,San Jose,CA,USA)检测各组样品的荧光强度。
2.6 正源方对H2O2 诱导的细胞产生LDH、MDA及SOD 的影响
将生长良好的HUVEC 按1×10个细胞/孔的浓度接种于6 孔板中。按“2.3”项下方法分为5 组。正源方预处理细胞3 h 后,加入500 μmol·LHO,培养24 h,收集各组细胞上清液,使用LDH 和T-SOD 检测试剂盒,按照试剂盒说明书检测LDH 和超氧化物歧化酶(SOD)水平。此外,收集各组细胞匀浆样品,细胞匀浆采用MDA 检测试剂盒操作流程对MDA 水平进行检测。最后,通过酶标仪分别在450、530 及550 nm 下测定LDH、MDA 和SOD 的吸光度(A
)。并采用GraphPad Prism Version 5(GraphPad Software,Inc.,CA,美国)进行数据统计分析。2.7 正源方对H2O2 诱导的细胞中MAPK 通路关键蛋白表达的影响
将生长良好的HUVEC 按1×10个细胞/孔的浓度接种于6 孔板中。按照“2.3”项下方法分为4 组:对照组、模型组、正源方中剂量组、正源方高剂量组。正源方预处理细胞3 h 后,加入500 μmol·LHO,培养24 h,收集细胞,按照RIPA 裂解液说明书提取蛋白,采用BCA 蛋白定量试剂盒测定蛋白质浓度,加入上样缓冲液,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对等量的蛋白质进行电泳分离,并将其转移到聚偏二氟乙烯膜上。将膜在室温下用5%脱脂奶封闭1 h,然后加入p-ERK、ERK、p-JNK、JNK、p-p38 及p38 抗体,4℃孵育过夜,将膜用TBST 洗涤后,加入山羊抗兔二抗,在室温下孵育40 min。洗涤膜,加入ECL 发光液,采用凝胶成像系统曝光。
2.8 统计学方法
所有数据以至少3 次独立实验的x
±s
表示。均数的比较采用单因素方差分析(ANOVA)。使用GraphPad Prism Version 5 对结果进行统计分析。P
<0.05 为差异有统计学意义。3 结果
3.1 正源方对H2O2 诱导的细胞活力的影响
如图1 所示,与对照组相比,500 μmol·LHO处理可显著降低细胞活力,而经过不同浓度正源方预处理,可以抑制HO诱导的细胞活力减少,其中50 ~200 μg·mL呈现浓度依赖性的提高细胞活力(P
<0.001)。结果表明正源方处理能够改善HO诱导的细胞活力减少。
图1 正源方对H2O2 诱导的细胞活力减少的影响Fig 1 Effect of ZYP on the decreased cell viability in H2O2-induced HUVECs
3.2 正源方对H2O2 诱导的细胞线粒体膜电位的影响
采用罗丹明123 染色分析细胞线粒体膜电位的变化,以确定正源方对细胞线粒体膜电位的影响。如图2A 所示,与对照组相比,HO处理组的细胞中绿色荧光强度较弱,暗示线粒体膜电位可能受损,而不同浓度正源方预处理可以增强细胞中的绿色荧光强度。采用Image J 软件分析各处理组中10 个相同面积区域内细胞的平均荧光强度(见图2B)和平均细胞数量(见图2C)。通过比较发现,正源方可以显著保护HO诱导的细胞荧光强度减少(P
<0.001)和细胞数目减少(P
<0.001),提示其可能改善了HO诱导的线粒体功能损伤。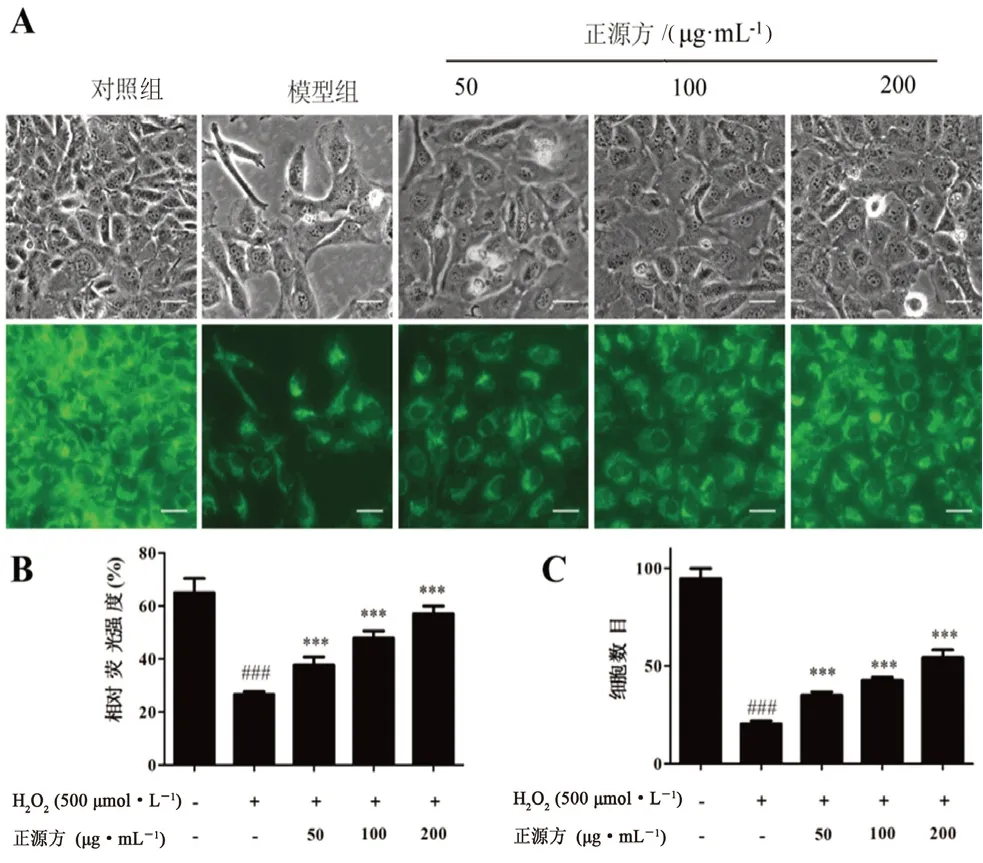
图2 正源方对H2O2 诱导的细胞线粒体膜电位的影响Fig 2 Effect of ZYP on the change of mitochondria membrane potential in H2O2-induced HUVECs
3.3 正源方对H2O2 诱导的细胞中ROS 水平的影响
本文通过流式细胞仪检测正源方对HO诱导的细胞中ROS 水平的影响。结果如图3A 所示,与对照组相比,500 μmol·LHO处理细胞显著增强了细胞内DCFH-DA 荧光(橘色峰),提示HO诱导细胞产生过量的ROS。然而200 μg·mL正源方处理后,可以显著减少细胞中DCFH-DA 荧光(绿色峰)。通过进一步分析每组样品中的平均荧光强度可知(见图3B),正源方能够显著抑制HO诱导的细胞内ROS 水平(P
<0.001)。结果表明正源方的抗氧化作用与抑制ROS 水平有关。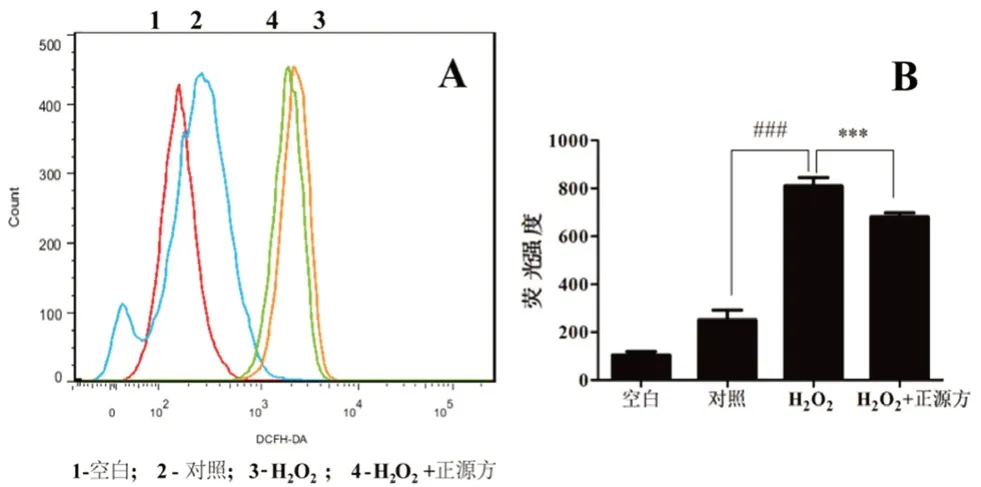
图3 正源方对H2O2 诱导的细胞中ROS 水平的影响Fig 3 Effect of ZYP on the level of ROS in H2O2-induced HUVECs
3.4 正源方对H2O2 诱导的细胞中LDH、MDA及SOD 水平的影响
与对照组相比,经500 μmol·LHO处理的细胞中LDH 和MDA 的水平显著提高,SOD水平显著下降,正源方不同浓度处理组可以浓度依赖性地降低HO诱导的LDH 和MDA,提高SOD 水平。结果表明正源方的抗氧化损伤可能与调节氧化因子LDH、MDA 和SOD 水平相关(见图4)。
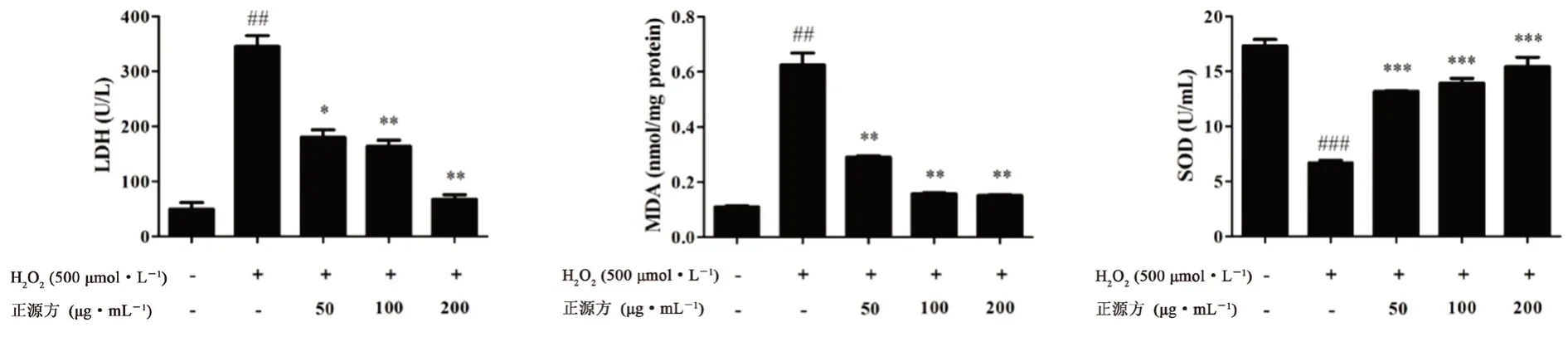
图4 正源方对H2O2 诱导的细胞中LDH、MDA 和SOD 水平的影响Fig 4 Effect of ZYP on the level of LDH,MDA and SOD in H2O2-induced HUVECs
3.5 正源方对H2O2 诱导的细胞中MAPK 通路关键蛋白表达的影响
结果如图5 所示,与对照组相比,500 μmol·LHO处理可以显著提高细胞中MAPK通路关键蛋白p-p38/p38、p-JNK/JNK、p-ERK/ERK 蛋白的表达,正源方处理后,可以显著抑制HO诱导的p-p38/p38、p-JNK/JNK、p-ERK/ERK 蛋白表达。结果表明,正源方的抗氧化损伤活性可能与调控MAPK 通路相关。
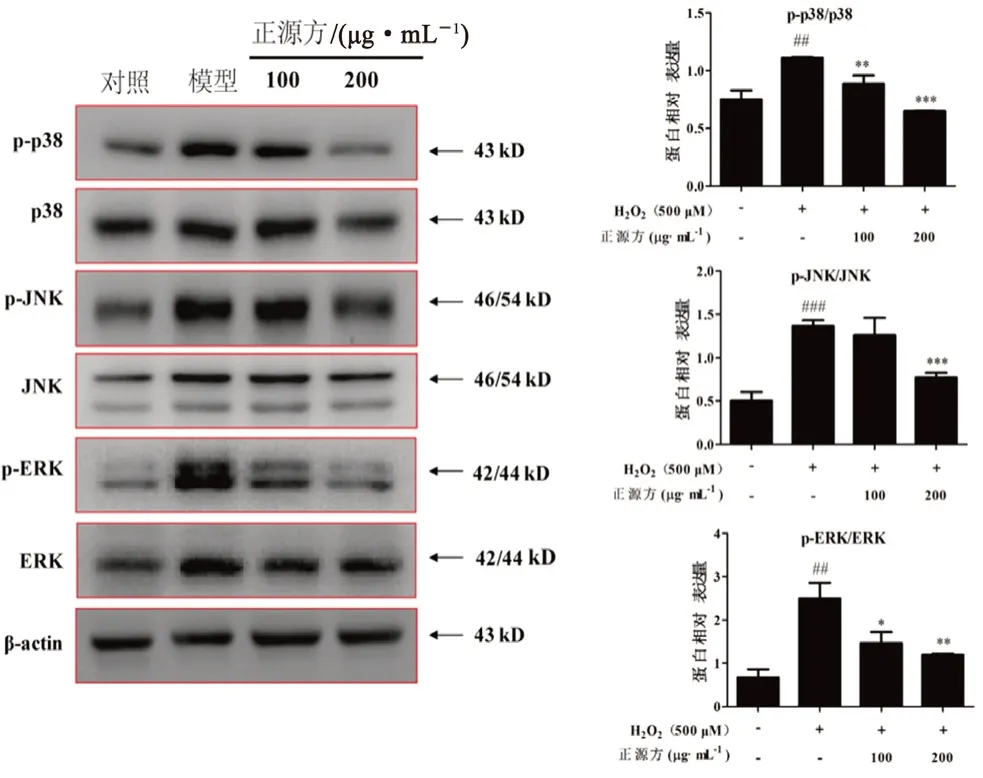
图5 正源方对H2O2 诱导的细胞中MAPK 通路关键蛋白表达的影响Fig 5 Effect of ZYP on the key proteins expression of MAPK pathway in H2O2-induced HUVECs
4 讨论
近年来由于临床肿瘤患者增多,放射治疗和放射损伤引起的毒副作用已不容忽视。正源方可减轻放射治疗引起的毒副作用。根据放射治疗可导致机体过量的氧化应激,进一步造成机体的氧化平衡失衡,我们推测正源方减轻放疗引起的毒副作用,可能与其抗氧化应激损伤的作用有关。因此,本文通过构建体外氧化应激造成的血管内皮细胞损伤模型,初步评价正源方的抗氧化损伤作用及其作用机制。正源方中含有的人参皂苷Rb及人参皂苷Rg对氧化应激的抑制作用,推测正源方的抗氧化活性可能是这些化合物的联合作用。
辐射产生高水平的ROS,破坏机体正常的氧化还原平衡,使细胞处于氧化应激状态。ROS能使酶失活,氧化蛋白质,破坏DNA,引起脂质过氧化,使蛋白质变性,破坏细胞功能和完整性。ROS 主要在线粒体中产生并在细胞辐射过程中发生积累。因此,抑制机体氧化应激可以起到抗辐射损伤的作用。LDH 是稳定存在于细胞质中的胞浆酶,当细胞膜受到氧化损伤时LDH 释放,细胞培养上清中LDH 表达升高,提示细胞膜破损。MDA 是自由基作用于脂质发生过氧化反应的氧化产物,是机体氧化应激的另一个关键指标,具有细胞毒性。MDA 的含量可反映机体脂质过氧化速率和程度,同时间接反映组织过氧化损伤程度。当机体发生氧化应激损伤时,MDA表达增多。此外,SOD 通过清除机体有害的超氧阴离子自由基(O),具抗氧化和抗衰老的作用。研究发现SOD 的产生可以降低ROS 的有害影响。 因此,ROS、LDH、MDA 及SOD 水平在抵御氧化应激研究中至关重要。本研究发现HO诱导的血管内皮细胞中ROS、LDH 及MDA 水平显著升高,SOD 水平显著降低,而不同浓度正源方处理能够显著抑制ROS、MDA 和LDH 的过量产生,提高SOD 的表达水平,表明正源方能够保护细胞免受HO诱导的氧化损伤。
MAPK 通路是参与细胞氧化应激、凋亡、增殖和应激反应等多种细胞过程的重要信号通路。以往研究表明,HO处理可激活血管内皮细胞中的MAPK 通路。ROS 引发氧化应激可以激活MAPK 通路,可以通过磷酸化ERK、JNK 和p38 MAPKs 的表达水平来监测。研究证实MAPK 家族信号通路在调控HO诱导的细胞氧化损伤和凋亡中发挥重要作用。据报道多个中药可通过调控HO诱导的MAPK 通路实现对细胞氧化损伤和凋亡的保护作用。因此,本文进一步检测了正源方对HO诱导的细胞中MAPK 通路关键蛋白的激活情况。与预期一致,HO处理组显著上调了p-p38/p38、p-JNK/JNK 和p-ERK/ERK 的表达水平,表明HO处理诱导MAPK 信号的过度活化,使氧化应激水平失衡,线粒体损伤,导致线粒体膜电位下降,细胞中ROS 表达水平升高,分泌LDH 和MDA 增多,SOD 产生减少,细胞活力下降。正源方预处理显著降低了p-p38/p38、p-JNK/JNK 和p-ERK/ERK的表达水平。可知正源方处理后细胞中线粒体膜电位升高,细胞分泌ROS、LDH 及MDA 减少,SOD 增加。基于以上发现,本文推测正源方促进细胞存活,抑制HO诱导的氧化应激相关因子,可能与抑制MAPK 通路的活化有关。
本研究证实了正源方对HO诱导的内皮细胞氧化应激损伤具有保护作用,并初步探讨了正源方的抗氧化损伤作用可能与抑制MAPK 通路的活化有关。本文不足之处主要有以下三方面:①HO诱导的损伤模型并不能完全模拟辐射引起的损伤,只是具有一定的可比性;② 只初步探索了正源方对HO诱导的氧化应激指标的抑制作用,并且对MAPK 通路活化的抑制作用,而未深入探究正源方调控MAPK 通路与氧化应激指标之间的关系;③ 未采用阳性对照药。在未来研究中,应采用辐射诱导的细胞和动物损伤模型,并选择合适的阳性对照药,进一步评价正源方抗辐射的作用机制。以上研究表明,通过HO诱导的细胞损伤可初步用来评价正源方的抗氧化损伤作用及作用机制,本研究可为正源方的氧化损伤保护作用及临床应用提供一定理论参考。

