cTnI-C质控物制备与评价
卢艳华,周志伟,陈小燕,卢航,王小明
(广州天宝颂原生物科技开发有限公司,广东广州 510663)
作为心肌损伤标志物,心肌肌钙蛋白I(cTnI)在临床应用已超过20年,随着技术的发展,cTnI检测方法的检出能力大大提升,已发展为高敏cTnI(hs-cTnI)检测方法。文献显示,hs-cTnI-VITROS用于急性心肌梗死诊断的AUC为0.95(95%CI,0.93~ 0.96),临 床 敏 感 性 达 到 100%(95%CI,94.1~ 100),临 床 特 异 性 达 到 95.6%(95%CI,93.4~97.2)[1]。hs-cTnI已成为急性心肌梗死分型的关键判定指标[2],并为非ST段抬高型急性冠状动脉综合征(NSTE-ACS)患者的诊断、风险分层和治疗方面提供了必要的补充[3]。cTnI应用广泛,市场产品种类众多,国家药品监督管理局的数据显示,cTnI检测产品超过96种,方法学原理超过13种。由于产品的方法学原理和抗体对的多样性,及cTnI分析物异质化,cTnI检测方法的标准化是个难点,单独使用天然心肌肌钙蛋白I或重组心肌肌钙蛋白复合物(cTnI-C)制备的参考物质作为校准物无法改善检测方法的差异,而采用混合临床样本作为校准物可将检测方法的变异系数(CV)从88%降至15.5%[4]。
混合临床样本可作为二级参考物质实现全球检测系统的一致化,但由于其存在临床样本资源有限、生物安全性不确定及易降解等问题,不适合用作终端用户cTnI检测系统的校准和质量控制。开发稳定、安全、充足的cTnI校准物和质控物,不仅可以用于将二级参考物质的准确性通过溯源途径传递至临床样本,保证检测系统具有跨时空的可比性,还能用于室内质量控制,保证cTnI检测系统的稳定性,提高临床检测质量。天然cTnI的N末端和C末端非常不稳定易发生降解,但其30~110氨基酸区域稳定,该区域因与心肌肌钙蛋白C(cTnC)结合紧密而受到保护。天然cTnI样本稳定性不佳,采血到分析检测的时间要控制在4 h以内[5],重组稳定区域(氨基酸28~110)cTnI和全长cTnC复合物的稳定性优于全长cTnI和全长cTnC复合物,能在2~8 ℃保存4个月、-20 ℃下保存1年、37 ℃下保存3 d,但部分检测系统无法识别[6]。
为了使校准物和质控物保存稳定时间更长,并适用于绝大部分检测系统,本研究选择基因工程合成的全长cTnI和全长cTnC复合物,筛选合适的基质及冻干保护剂,制备出了免疫反应性、均一性、稳定性优良的质控物,且该质控物原料和配方同样适用于生产定值校准品,可为提高临床实验室cTnI检测质量奠定物质基础。
1 材料与方法
1.1 仪器与试剂
胎牛血清,货号SH30406.05,Gibco;正常人血清,货号3SH002,Scantibodies Laboratory Inc;心肌质控品,货号CQ3100,英国朗道实验诊断有限公司;cTnI-C重组抗原,广州天宝颂原生物科技开发有限公司;海藻糖,分析纯,广州化学试剂厂;甘露醇、甘氨酸,分析纯,生工生物工程(上海)股份有限公司。
4种cTnI检测系统:AI8200化学发光免疫分析仪及配套cTnI试剂,广州天宝颂原生物科技开发有限公司;Access仪器及配套cTnI试剂,美国贝克曼库尔特有限公司;ARCHITECT i2000SR仪器及配套cTnI试剂,美国雅培公司;VIDAS仪器及配套cTnI试剂,法国生物梅里埃公司。依次编号为检测系统A、B、C、D。
DW-86W100型超低温冰箱,海尔集团;FD-1A-50型真空冷冻干燥机,博医康仪器有限公司。
1.2 基质筛选
基质a:正常人血清;基质b:胎牛血清;基质c:磷酸缓冲溶液(0.05 mol/L PB、0.15 mol/L NaCl、1%BSA、0.09%NaN3,pH=7.5);基质d:Tris缓冲溶液(0.2 mol/L Tris、0.15 mol/L NaCl、0.3%Tween-20、2.5% 甘 油、0.5%BSA、0.09%NaN3,pH=7.4);基质e:无缓冲体系溶液(0.15 mol/L NaCl、0.5%BSA、0.05%Tween-20、0.05%NaN3,pH=6.5)。将cTnI-C重组抗原分别使用上述基质配制成2种浓度水平的液态质控物,浓度水平1(C1)在0.1~0.3 ng/mL,浓度水平2(C2)在1~3 ng/mL,配制体积各为10 mL,使用离心管分装成1 mL/管,每组2管分别放置于-20 ℃、2~8 ℃、25 ℃条件下储存7 d后取出,使用cTnI检测系统A测定,每个样品检测8个重复,相比-20 ℃对照条件,在2~8 ℃、25 ℃的检测结果下降幅度最小组判定为最优基质。
1.3 冻干保护剂筛选
使用液态最稳定基质b按1.2方法配制质控物,配制体积为100 mL,质控物分装为4组,每组25 mL,按照质量分数分别添加不同的冻干保护剂。Ⅰ组:未添加保护剂;Ⅱ组:添加3%海藻糖;Ⅲ组:添加0.5%甘露醇;Ⅳ组:添加1%甘氨酸。质控物混匀后,分装为1 mL/管,在质控物瓶身作好组别和水平浓度的标识,然后放置于-80 ℃超低温冰箱预冻18~24 h,预冻结束后快速转移至已预冷的真空冷冻干燥机中干燥24 h,所有冻干品取出后立即加塞加盖。每组取5瓶放置于37 ℃烘箱中加速7 d,取5瓶放置于37 ℃烘箱中加速14 d,剩余10瓶放置于2~8 ℃ 保存7 d,保存时间结束后取出放置于-20 ℃条件下,所有样品在保存结束的最后一天,同一时间段,使用cTnI检测系统A测定。取各类保存条件下的5瓶质控品进行检测,每瓶检测2个重复,计算10个数据的均值,统计37 ℃加速7 d和14 d组与2~8 ℃对照组检测结果的相对偏差,下降程度最小组判定为最优保护剂。
使用上述确定的cTnI-C质控物配方和冻干工艺制备一批cTnI-C质控物,数量为200瓶,用于后续的免疫反应性、均匀性和稳定性研究。
1.4 免疫反应性
用A、B、C、D检测系统同步评估检测自制cTnI-C质控物及朗道心肌质控品免疫反应性。检测之前,按照制造商要求使用配套校准物和质控物对检测系统进行校准和质控,质控合格后检测cTnI-C质控物和朗道心肌质控品,每个浓度水平重复3次。
1.5 均匀性评估
参照《体外诊断实际用质控物通用技术要求》(YYT 1652—2019)所述方法,检测质控品均匀性[7]。随机抽取10瓶质控物并编号1~10,使用cTnI检测系统A重复检测3次,检测顺序为1、3、5、7、9、2、4、6、8、10、10、9、8、7、6、5、4、3、2、1、2、4、6、8、10、1、3、5、7、9。采用单因素方差分析方法,计算F值,若F≤F0.05(ν1,ν2)=F0.05(9,20)=2.39时,则瓶间均匀性无显著性差异。
1.6 稳定性评估
检测系统存在随机误差,并可能对环境温度、湿度及操作敏感[8]。为使检测结果具有可比性,稳定性评估宜采用同步设计,但实时稳定性周期较长,为有利于及时发现问题宜采用经典设计,质控物保存第0、1、2、3、4、6、9、11、12和13个月时,取出4瓶质控物进行检测,每瓶重复检测2次,检测结果参照《体外诊断试剂稳定性评估指南》(EP 25-A)中“5.3数据分析”方法进行统计,将所有保存时间点的检测结果平均值(y轴)与试验日(x轴)进行线性回归,对回归系数进行t检验,通过P值判定回归系数是否具有统计学显著性,当P>0.05时,回归系数没有统计学显著性,在保存时间内试剂稳定。
2 结果与分析
2.1 基质筛选
以不同基质溶解、稀释重组cTnI-C抗原,并采用不同温度保存后测定效价,结果显示其效价因基质不同存在差异。如表1所示,在2~8 ℃条件保存7 d后,稀释液a、b、c、d和e基质配制的cTnI-C质控物效价稳定;在25 ℃条件保存7 d后,所有基质配制的cTnI-C效价均呈现不同程度的下降。其中,b基质配制的cTnI-C质控物效价下降幅度为10%~20%,c、d基质配制的cTnI-C质控物下降幅度为20%~30%,a、e基质配制下降幅度30%~40%。根据25 ℃条件下的稳定性结果可知,cTnI-C质控物对温度敏感,液态形式无法进行常规运输,保存期限少于1年,需要制备成冻干质控物。而b基质热稳定性最优,意味着使用该基质制备成冻干质控物,复溶后质控物的使用稳定性可满足临床实验室的校准和质控需求。
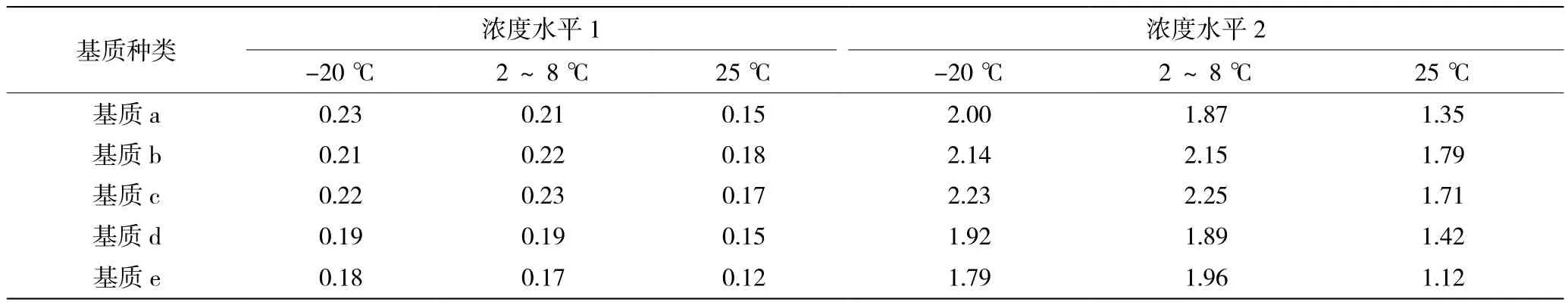
表1 不同基质cTnI-C质控物在各条件保存7 d的结果(单位:ng/mL)
2.2 保护剂筛选
如表2所示,在cTnI-C质控物中添加3%的海藻糖可提高质控物的热稳定性,质控物37 ℃加速7 d和14 d后效价无显著变化;添加甘氨酸有一定程度改善作用,但是改善不明显;而添加甘露醇无改善作用。后续性能评价用cTnI-C质控物的配方采用cTnI-C重组抗原+基质b+3%海藻糖,冻干工艺为预冻18 h,冻干24 h。
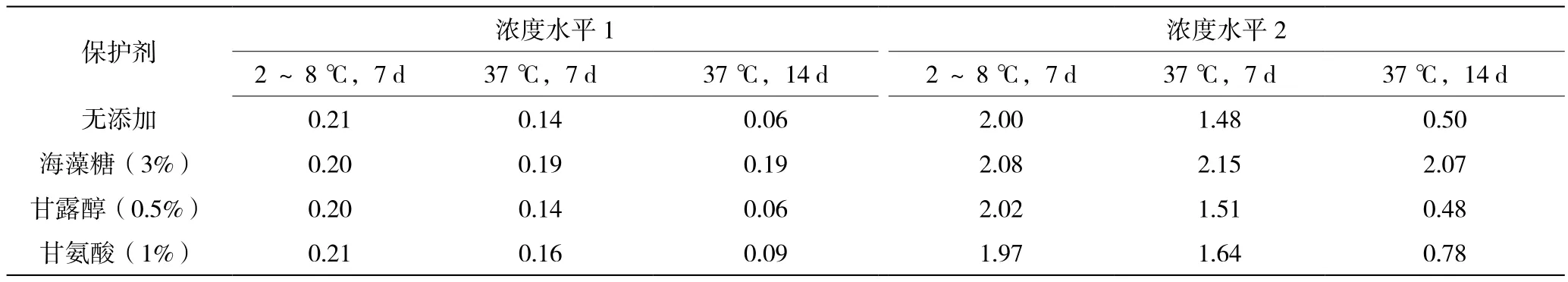
表2 添加不同保护剂的cTnI-C质控物冻干品在37 ℃加速后的检测结果(单位:ng/mL)
2.3 免疫反应性
采用市场主流检测系统可以检测到cTnI-C质控物,并与预期一致,呈现浓度梯度效应(见表3)。说明本研究制备的质控品可作为本公司及其他厂家校准物或质控物的原料。
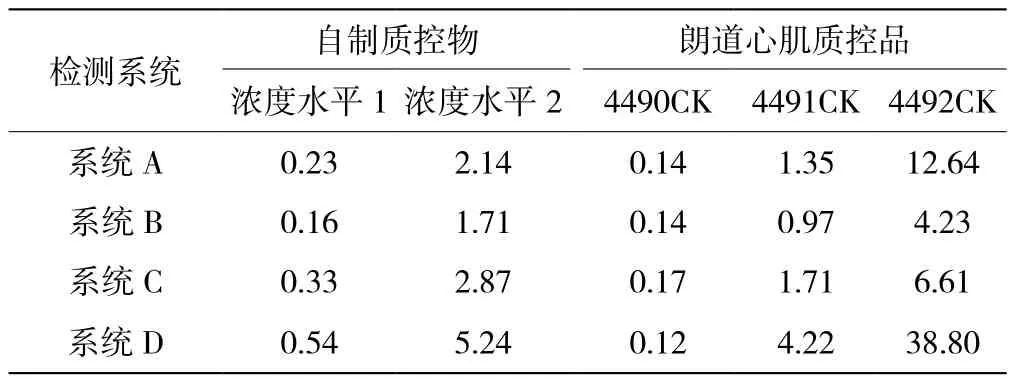
表3 主流检测系统测试cTnI-C质控物和朗道心肌质控品的结果(单位:ng/mL)
2.4 均匀性
2个浓度水平的cTnI-C质控物均匀性检测结果均符合要求,瓶间效价无显著性差异,瓶间CV均小于10%。见表4、表5、表6和表7。

表4 浓度水平1均匀性检测结果(单位:ng/mL)
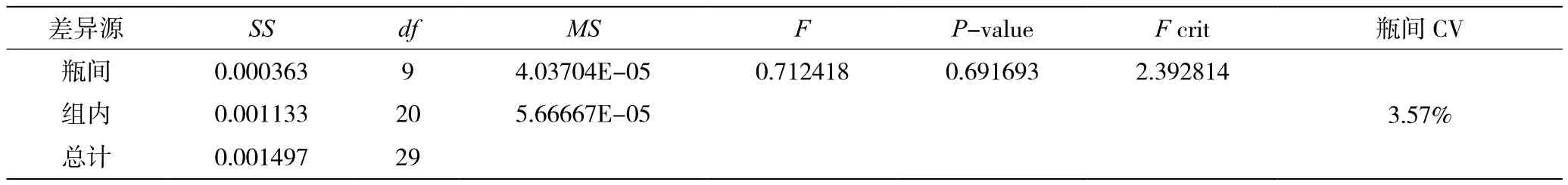
表5 浓度水平1均匀性检测结果方差分析

表6 浓度水平2均匀性检测结果(单位:ng/mL)

表7 浓度水平2均匀性检测结果方差分析
2.5 稳定性
2个浓度水平的cTnI-C质控物在0、1、2、3、4、6、9、11、12和13个月的检测结果线性回归斜率的P>0.05,没有统计学显著性,质控物在2~8 ℃条件下保存13个月稳定。结果见表8、表9、表10。
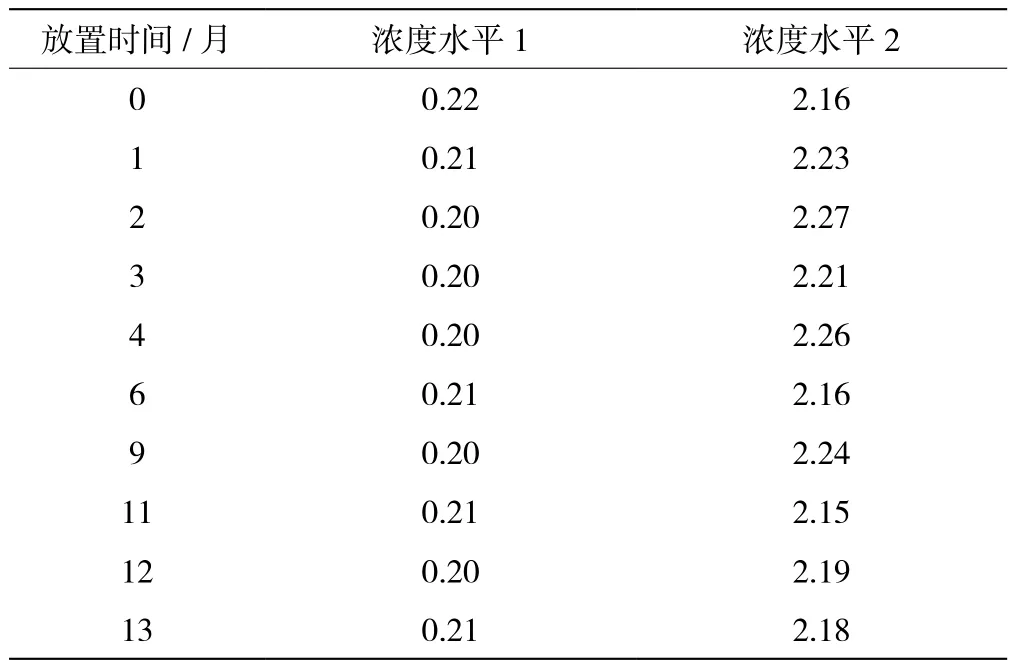
表8 cTnI-C质控物实时保存稳定性检测和统计结果(单位:ng/mL)

表9 浓度水平1稳定性结果方差分析

表10 浓度水平2稳定性结果方差分析
3 结论
cTnI质控品的研制主要由试剂公司研发人员或是医院临床检验科人员开展,试剂公司研发者倾向于研究cTnI抗原的原核表达及应用[9-10],他们对抗原表达的原料和工艺的研究详细具体,但在质控物的性能评估方面不如临床检验科人员的研究充分[11]。临床自制的混合样本质控品由于资源有限性而无法广泛推广应用,而重组抗原制备的cTnI冻干质控品以健康人血清为基质,且未添加保护剂,在真空冷冻干燥过程中,由于低温和失水可能会使蛋白质空间结构变化,使得冻干制品稳定性变差[12]。因此,本研究基于试剂公司在原料和工艺开发上的资源,借鉴临床实验室在质控品的科学评价体系,研究了cTnI质控品的配方,评估了免疫反应性、均一性、稳定性。结果表明3%海藻糖可显著改善cTnI蛋白的热稳定性,液态质控物和未添加保护剂的质控物在37 ℃保存无法超过7 d,添加3%海藻糖的cTnI-C质控物在37 ℃条件稳定时间不少于14 d。根据类似产品的阿伦尼乌斯公式推测,cTnI-C质控物2~8 ℃保存有效期超过2年。实时稳定性结果显示cTnI-C质控物2~8 ℃保存有效期不少于13个月。冻干保护剂常见于各类菌种、疫苗的应用,在检验医学领域标准品、校准品、质控品中的应用和机理还需要深入研究,以期为生产稳定的校准和质控物奠定理论基础。
cTnI分析物存在多种形式,通过室间质评(EQA)结果发现cTnI的检测结果变异很大,一致性差,cTnI的稳健CV可达120%[13]。国际临床化学联合会(IFCC)已成立工作组致力于cTnI的一致化研究,但由于不同试剂厂家使用的cTnI抗体对不同及阳性病人血清中cTnI的复杂性的影响,cTnI一致化可能短时间内无法实现[14]。国际范围内未实现cTnI一致化的情况下,各制造商依旧需要通过内部校准物保证各批次试剂、不同类型仪器间cTnI检测结果的准确性,各临床实验室需要通过质控物保证检测系统准确度未发生偏倚,精密度在规定范围内。本研究的cTnI-C质控物和朗道心肌质控品均可以被主流检测系统识别,由于抗体、方法学原理等差异,不同检测系统检测质控物的结果不具有一致性,使用待监控检测系统进行赋值后可应用于临床室内质量控制。
cTnI-C质控物是临床室内质量控制、室间质评、产品检验和校准的基础物质。随着cTnI联合其他心肌和心衰生物标志物在临床上的应用越来越广泛[15-16],且对检验质量要求越来越高[17],对cTnI-C质控物的需求会更大,质量要求也更高。本研究获得的cTnI-C质控物配方对制造商生产的cTnI检测系统质量和临床实验室终端用户检验质量的提高都具有积极的意义。

