IgA肾病患者IgA1分子糖基化异常与Th17细胞的相关性分析
侯 静, 蔺 艳, 刘 勇, 王玉洁
(1.西南医科大学附属医院, 四川 泸州 646000 2.西南医科大学肿瘤研究所, 四川 泸州 646000)
经流行病学调查[1]发现,IgA肾病约占原发性肾小球疾病的20.0%~50.0%,其中约有三分之一的患者在疾病诊断后的25年内可发展到终末期肾衰竭(end-stage renal disease,ESRD)。尽管患者接受肾移植等方法治疗,仍有50%以上患者在术后2年出现IgA肾病复发现象。有研究[2]指出,IgA肾病的发生与IgA1分子糖基化异常有关。也有研究[3]表示,Th17细胞失衡是导致IgA肾病发生的关键。但临床上关于Th17细胞与Gd-IgA1在IgA肾病作用及机制的研究报道较少,尚未阐明。故本次选取50例IgA肾病患者与50例健康体检人员的临床资料进行回顾性分析,旨在探讨IgA肾病患者IgA1分子糖基化异常与Th17细胞的相关性分析。现将其报告如下:
1 资料与方法
1.1临床资料:回顾性分析2018年2月至2020年5月诊治的50例IgA肾病患者与50例健康体检人员的临床资料。诊断标准:符合“原发性IgA肾病诊治循证指南(2016)”[4]中关于IgA肾病的诊断标准,经肾脏病理活检以系膜细胞和系膜基质增生为主,伴有IgA为主的免疫复合物沉积,且伴有血尿、蛋白尿、肾功损害等表现。IgA肾病组纳入标准:①临床资料完整,如血清指标等;②纳入实验前未经糖皮质激素或其他免疫抑制剂治疗;③无恶性肿瘤等疾病。健康对照组纳入标准:①认知功能正常;②身体健康;③生化指标资料完整。排除标准:①伴有严重心功能不全;②妊娠、哺乳阶段;③凝血功能异常。
1.2方 法
1.2.1调查内容及其方法:设计统一的病例调查表,由专业医师收集IgA肾病患者与健康体检人员的临床资料,包括Th17细胞、Treg细胞、Th17/Treg、异常糖基化IgA1(Gd-IgA1)、转化生长因子-β(Transforming Growth Factor-β,TGF-β)、白介素-6(Interleukin-6,IL-6)、白介素-17(Interleukin-17,IL-17)、白介素-21(Interleukin-21,IL-21)、白介素-23(Interleukin-23,IL-23)、血肌酐、白蛋白及尿蛋白定量等。
1.2.2血清指标检测方法:于清晨状态下采集受检人员外周静脉血5mL,3000r/min离心15min,提取血清待检。其中,Th17细胞、Treg细胞采用流式细胞仪检测,计算Th17/Treg比值,试剂盒由美国eBioscience公司提供;TGF-β、IL-6、IL-17、IL-21、IL-23采用ELISA法检测,试剂盒由杭州联科生物科技有限公司提供;Gd-IgA1采用人半乳糖缺乏IgA1酶联免疫检测试剂盒检测;血肌酐采用电化学发光免疫分析法检测,白蛋白采用溴甲酚绿法检测,试剂盒均由中生北控生物科技股份有限公司提供。
1.2.3尿液指标检测方法:留取受检人员24h尿液,采用比色法检测尿蛋白。
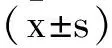
2 结 果
2.1一般资料比较:两组在性别、年龄、BMI等一般资料比较中,差异无统计学意义(P>0.05)。详见表1。
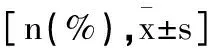
表1 两组一般资料比较
2.2Gd-IgA1及Th17细胞、Treg细胞比较:IgA肾病组的Th17细胞、Th17/Treg、Gd-IgA1均高于健康对照组,而Treg细胞低于健康对照组(P<0.05)。详见表2。
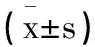
表2 Th17细胞 Treg细胞及Gd-IgA1比较
2.3Th17细胞相关细胞因子比较:IgA肾病组的TGF-β低于健康对照组,而IL-6、IL-17、IL-21、IL-23高于健康对照组(P<0.05)。详见表3。
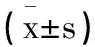
表3 两组TGF-β IL-6 IL-17 IL-21 IL-23比较
2.4血肌酐、血清白蛋白及尿蛋白定量比较:IgA肾病组的血肌酐、尿蛋白定量高于健康对照组,而白蛋白低于健康对照组(P<0.05)。详见表4。
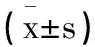
表4 两组血肌酐血清白蛋白及尿蛋白定量比较
2.5相关性分析
2.5.1Th17细胞、Treg细胞与Gd-IgA1的相关性分析Pearson相关性显示,Gd-IgA1与Th17细胞、Th17/Treg呈正相关(r=0.737、0.810,P<0.05),与Treg细胞呈负相关(r=-0.487,P<0.05)。详见表5。
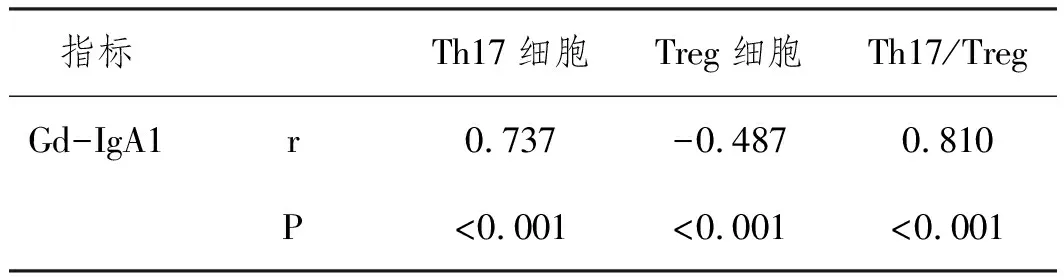
表5 分析Gd-IgA1与Th17细胞 Treg细胞的相关性
2.5.2细胞因子与Gd-IgA1的相关性分析Pearson相关性显示,Gd-IgA1与TGF-β呈负相关(r=-0.260,P<0.05),与IL-6、IL-17、IL-21、IL-23呈正相关(r=0.796/0.776/0.714/0.819,P<0.05)。详见表6。

表6 分析细胞因子与Gd-IgA1的相关性
3 讨 论
目前临床上对于IgA肾病的发病机制尚未阐述,因此临床上缺乏特异有效的治疗措施。近年来,有众多研究[4]发现,IgA1分子糖基化异常在IgA肾病的发生、发展中具有至关重要的作用,因其能刺激机体产生抗聚糖IgG自身抗体,再通过与抗体结合,形成免疫复合物,通过逃避血液循环中正常的清除机制,使得IgA沉淀于肾小球系膜区,继而诱导炎症反应及促使系膜细胞增殖,造成肾小球损伤。其中,IgA1分子糖基化异常与遗传因素、环境因素,以及参与糖基化过程的相关酶类异常表达有关[5]。且有大量研究数据[6]表明,辅助性T细胞(Th细胞)免疫失衡在调控IgA1分子产生和糖基化过程中起着重要作用。当Th细胞免疫失衡,可释放大量的细胞因子,如IL-6、IL-17、IL-21、IL-23等,通过抑制参与糖基化过程的β-1,3-半乳糖基转移酶(β3GalT)及其分子伴侣Cosmc的表达,促进IgA1分子的糖基化异常。研究结果显示,IgA肾病组的Th17细胞、Treg细胞、Th17/Treg表达均高于健康对照组,提示Th细胞参考了IgA肾病的发生发展。
Th17细胞是新近发现的一类Th细胞亚群,与Th1、Th2细胞不同,主要作用在于通过产生IL-17、IL-17F、IL-22等,诱导组织细胞产生促炎症细胞因子、趋化因子及金属蛋白酶类,清除Th1和Th2细胞无法清除的细胞外病原体[7]。研究结果显示,Th17细胞与IL-6、IL-17、IL-21、IL-23呈正相关,说明细胞因子会随着Th17细胞的失衡而大量分泌。其中,IL-17是Th17细胞的标志性细胞因子,因Th17细胞介导产生的生物学效应是通过IL-17细胞因子所发挥,但当Th17细胞失衡,则会促使IL-17高表达,继而促进IgA抗体的产生,且诱导Th2型细胞反应,故临床认为Th17细胞可能会在一定程度上影响Th2细胞的生物学效应[8]。而Th2型细胞,目前已证实其参与调控IgA肾病中的IgA1分子糖基化异常。基于上述结果,认为Th17细胞与Th2细胞能相互作用,故推测Th17细胞也会影响IgA1分子产生和糖基化异常。在Pearson相关性中,Gd-IgA1与Th17细胞呈正相关,说明两者相互影响,从而促使IgA肾病的发生。另外,有研究[9]表示,炎症状态下细胞因子会在一定程度上影响IgA1分子糖基化异常。虽然目前尚无相关文献报道,炎症介质是否参与调控IgA1分子产生和糖基化异常,但在本文相关性分析中,发现Gd-IgA1与TGF-β呈负相关,与IL-6、IL-17、IL-21、IL-23呈正相关,故推测炎性细胞因子可能参与了IgA1分子糖基化异常,但因本研究样本较小,所收治的均为本院IgA肾病患者,仍需扩大样本,进一步研究及证实。
综上所述,Th17细胞与Gd-IgA1呈正相关,即参与了IgA1分子糖基化异常的过程,可通过评估Th17细胞表达量,为临床诊治IgA肾病提供客观依据。

