FOXM1通过靶向上调PHB2的转录改善线粒体功能障碍保护脂多糖诱导的肾小管上皮细胞损伤
陈 娟, 陈拉斯, 陈 丽, 唐文庄, 张琼果, 王善志
(海南医学院第一附属医院, 海南 海口 570000)
急性肾损伤(acute kidney injury,AKI)是临床上常见的由多种事件引起的危重急症,发病率高,病死率高。在重症监护病房住院的患者中,大约45~70%的AKI病例是由脓毒症引起的[1]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌的主要外膜成分,是主要的内毒素之一[2]。LPS通过诱导炎症反应、氧化应激和细胞凋亡,在脓毒症相关AKI的发病机制中发挥重要作用[3]。因此,有必要了解LPS诱导肾小管细胞损伤的潜在机制。Forkhead box M1(FOXM1)是一个有翼螺旋/叉头类转录因子,是FOX转录因子家族的一员[4]。研究表明,过表达FOXM1可改善LPS诱导的人脐静脉内皮细胞损伤,促进细胞活力和血管生成,抑制细胞凋亡和炎症因子的产生[5]。目前,关于FOXM1在LPS诱导的肾小管细胞损伤中的作用及其可能的作用机制尚不明确。线粒体内膜蛋白prohibitin 2(PHB2)是线粒体吞噬作用的受体,调节线粒体的多种功能,包括线粒体呼吸修饰、线粒体嵴的维持和有丝分裂激活[6]。目前的证据显示,PHB2介导的有丝分裂通过改善线粒体功能障碍和抑制NLRP3炎性小体激活来减轻肾小管上皮细胞损伤[7]。因此,PHB2可能是治疗肾脏疾病的一个有前途的靶点。生物信息学软件分析结果显示,PHB2启动子区域存在FOXM1的潜在结合靶点。因此,本研究旨在探究FOXM1是否通过调控PHB2表达在LPS诱导的肾小管细胞损伤中发挥作用,以期为明确LPS诱导肾小管细胞损伤的潜在机制及开发新的脓毒症相关AKI治疗靶点提供新的科学资料。
1 材料与方法
1.1主要材料:人近曲小管上皮细胞HK-2购自武汉普诺赛生命科技有限公司;LipofectamineTM2000转染试剂购自美国Thermo Fisher Scientific;2×SYBR Green qPCR MasterMix购自北京索莱宝科技有限公司;FOXM1、PHB2和GAPDH抗体购自英国Abcam;CCK-8试剂盒、ATP检测试剂盒、荧光素酶报告基因检测试剂盒和增强型线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物技术有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自翌圣生物科技(上海)股份有限公司;过表达载体阴性对照(oe-NC)、FOXM1过表达载体(oe-FOXM1)、shRNA阴性对照(sh-NC)和PHB2特异性shRNA(sh-PHB2)、PHB2的3’-UTR端的野生型(KIF20A-WT)和突变型(KIF20A-MUT)荧光素酶报告质粒由金斯瑞生物科技股份有限公司构建。
1.2细胞培养:HK-2细胞用含10% FBS的DMEM培养基,于37℃、5% CO2条件下培养。细胞每2天更换一次新鲜培养基,待细胞覆盖率达到80~90%时,胰酶液消化细胞,进行传代或铺板操作。
1.3细胞分组及转染:将对数期生长的HK-2细胞接种于6孔板(1×106个/孔),细胞继续培养24h后,将细胞随机分为对照组、LPS组、LPS+oe-NC组、LPS+oe-FOXM1组、LPS+oe-NC+sh-NC组、LPS+oe-FOXM1+sh-NC组、LPS+oe-NC+sh-PHB2组、LPS+oe-FOXM1+sh-PHB2组,根据LipofectamineTM2000转染试剂说明书所示按照分组,分别转染oe-NC、oe-FOXM1、sh-NC和sh-PHB2。细胞继续培养48h后,向细胞中添加LPS(终浓度1μg/mL),对照组加入等量溶剂。细胞继续培养24h后,进行后续实验操作。
1.4qRT-PCR检测细胞FOXM1和PHB2 mRNA表达:收集HK-2细胞,Trizol法提取细胞的总RNA,随后进行反转录操作生成cDNA。采用2×SYBR Green qPCR MasterMix进行后续检测。反应程序:95℃、10 min;95℃、15s,60℃、30s,72℃、10s,40个循环。以GAPDH为内参,采用2-ΔΔCt法计算FOXM1和PHB2 mRNA表达。qRT-PCR实验所需引物见表1。
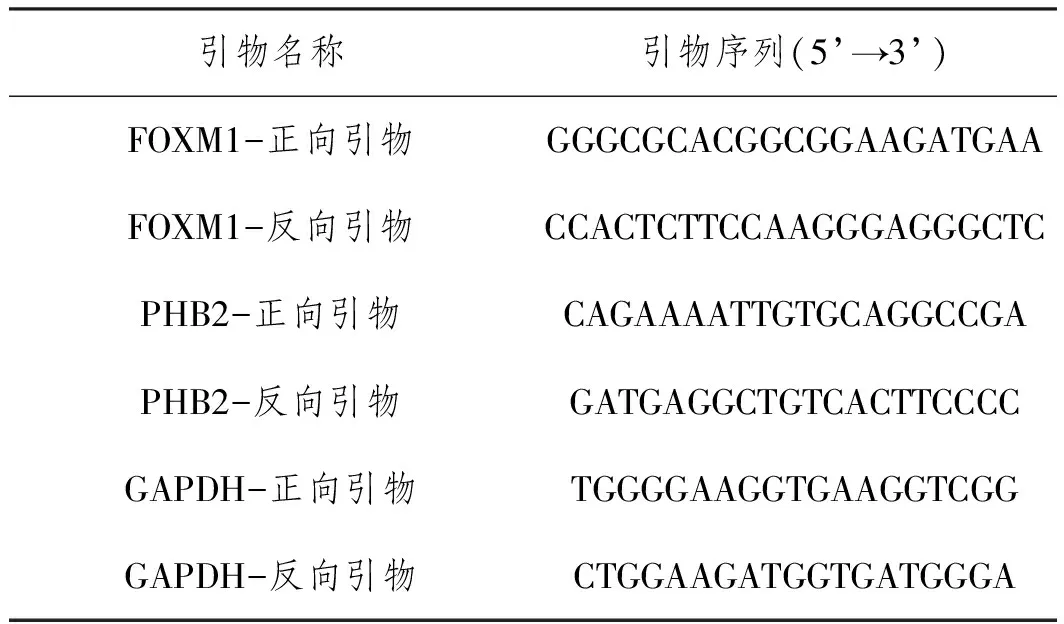
表1 qRT-PCR所需引物序列
1.5Western blot检测细胞FOXM1和PHB2蛋白表达:收集HK-2细胞,RIPA裂解液裂解细胞后,收集细胞上清液并测定其蛋白浓度。取30μg样品进行SDS-PAGE电泳和转膜操作。5%脱脂奶粉室温孵育封闭2h。加入FOXM1抗体(1∶2000)、PHB2抗体(1∶1000)和GAPDH抗体(1∶2000),于4℃条件下孵育过夜。加入特异性二抗(1∶5000),室温条件下孵育1h后,凝胶成像系统检测蛋白条带。Image J软件分析各蛋白条带的灰度值。
1.6CCK-8检测细胞活力:将对数期生长的HK-2细胞接种于96孔板(1×104个/孔),按照1.3所示进行分组处理,另设置空白组(未接种细胞)用作读值调零。随后按照CCK-8试剂盒说明书所示,酶标仪检测各孔细胞在450nm处的光密度(OD)值。细胞活力(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%或者是细胞活力(%)=(实验组OD值-空白组OD值)/(LPS+oe-NC+sh-NC组OD值-空白组OD值)×100%。
1.7流式细胞术检测细胞凋亡:收集HK-2细胞,预冷PBS清洗细胞3次。重新收集细胞,向细胞中加入1×Binding Buffer重悬细胞沉淀,并将细胞密度调整为1×106个/mL。取100μL细胞悬液置于新的离心管内,加入5μL FITC-Annexin V和5μL PI工作液,充分混匀后,室温条件下避光孵育15min。向细胞中加入400μL 1×Binding Buffer,充分混匀后,立即用流式细胞仪检测。
1.8JC-1染色检测线粒体膜电位:弃去HK-2细胞培养基,PBS清洗细胞后,加入1mL新鲜培养基。向细胞中加入JC-1染色工作液,37℃培养箱中孵育20min,弃去上清液,JC-1染色缓冲液清洗细胞2次后,加入培养基,荧光显微镜下观察并拍照。Image J软件测量荧光强度,通过红绿荧光的比例来衡量线粒体去极化的比例。
1.9试剂盒检测细胞ATP含量:收集HK-2细胞,按照ATP检测试剂盒说明书所示检测各组细胞中ATP含量。
1.10荧光素酶报告实验检测FOXM1和PHB2的靶向结合:通过Consite(http://consite.genereg.net/)和JASPAR(http://jaspar.binf.ku.dk/)软件分析预测FOXM1和PHB2的转录结合位点,分别构建针对PHB2预测结合位点的野生型(PHB2-WT)和突变型(PHB2-MUT)荧光素酶报告质粒。分别将PHB2-WT+oe-NC、PHB2-MUT+oe-NC、PHB2-WT+oe-FOXM1和PHB2-MUT+oe-FOXM1转染至HK-2细胞中。细胞继续培养48h后,根据荧光素酶报告基因检测试剂盒说明书所示,检测荧光素酶活性。
1.11ChIP-PCR实验检测FOXM1对PHB2启动子调控作用:收集HK-2细胞,加入甲醛固定细胞后,超声破碎细胞,获得200bp~1000bp的染色质片段,离心收集细胞上清液。应用FOXM1抗体,按照SimpleChIP®Plus Sonication Chromatin IP试剂盒说明书进行后续实验操作,将与FOXM1蛋白结合的DNA序列分离出来。以该DNA片段作为qRT-PCR实验中的模板,以检测PHB2的转录富集。

2 结 果
2.1LPS对肾小管上皮细胞中FOXM1表达的影响:与对照组相比,LPS组细胞中FOXM1 mRNA和蛋白表达均明显降低(P<0.05),结果见图1。
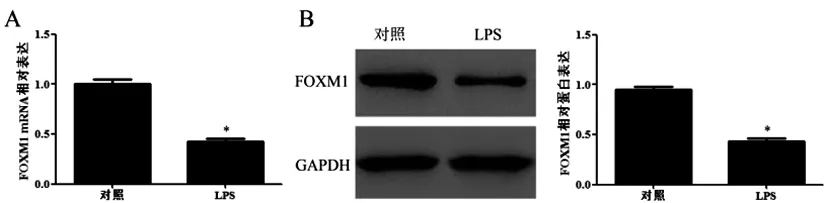
图1 LPS对肾小管上皮细胞中FOXM1表达的影响
2.2过表达FOXM1对LPS诱导的肾小管上皮细胞损伤的影响:与对照组相比,LPS组细胞中FOXM1 mRNA和蛋白表达明显降低(P<0.05),细胞活力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05);与LPS组比较,LPS+oe-NC组细胞中FOXM1 mRNA和蛋白表达、细胞活力、细胞凋亡率差异无统计学意义(P>0.05);与LPS+oe-NC组相比,LPS+oe-FOXM1组细胞中FOXM1 mRNA和蛋白表达明显升高(P<0.05),细胞活力明显升高(P<0.05),细胞凋亡率明显降低(P<0.05)。见图2和图3。

图2 各组细胞中FOXM1 mRNA和蛋白表达

图3 过表达FOXM1对LPS诱导的肾小管上皮细胞损伤的影响
2.3过表达FOXM1对LPS诱导的肾小管上皮细胞线粒体功能障碍的影响:与对照组相比,LPS组细胞红/绿荧光强度比值和ATP含量明显降低(P<0.05);与LPS组比较,LPS+oe-NC组细胞红/绿荧光强度比值和ATP含量差异无统计学意义(P>0.05);与LPS+oe-NC组相比,LPS+oe-FOXM1组细胞红/绿荧光强度比值和ATP含量明显升高(P<0.05)。见图4。

图4 过表达FOXM1对LPS诱导的肾小管上皮细胞线粒体功能障碍的影响
2.4FOXM1对细胞PHB2表达的影响:与对照组相比,LPS组细胞中PHB2 mRNA和蛋白表达明显降低(P<0.05);与LPS组比较,LPS+oe-NC组细胞中PHB2 mRNA和蛋白表达差异无统计学意义(P>0.05);与LPS+oe-NC组相比,LPS+oe-FOXM1组细胞中PHB2 mRNA和蛋白表达明显升高(P<0.05)。与oe-NC组相比,oe-FOXM1组细胞中PHB2-WT相对荧光素酶活性明显升高(P<0.05),PHB2启动子区明显富集(P<0.05)。见图5。
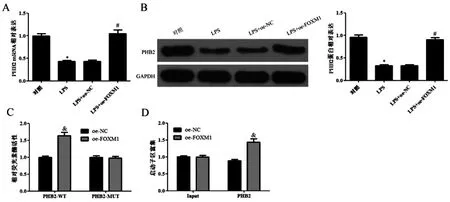
图5 FOXM1对细胞PHB2表达的影响
2.5FOXM1/PHB2轴对LPS诱导的肾小管上皮细胞损伤的影响:与LPS+oe-NC+sh-NC组相比,LPS+oe-FOXM1+sh-NC组细胞中FOXM1和PHB2蛋白表达、细胞活力明显升高(P<0.05),细胞凋亡率明显降低(P<0.05);与LPS+oe-NC+sh-NC组相比,LPS+oe-NC+sh-PHB2组细胞中PHB2蛋白表达和细胞活力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05),FOXM1蛋白表达差异无统计学意义(P>0.05);与LPS+oe-FOXM1+sh-NC组相比,LPS+oe-FOXM1+sh-PHB2组细胞中FOXM1蛋白表达差异无统计学意义(P>0.05),PHB2蛋白表达和细胞活力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05)。见图6和图7。

图6 各组细胞中FOXM1和PHB2蛋白表达

图7 FOXM1/PHB2轴对LPS诱导的肾小管上皮细胞损伤的影响
2.6FOXM1/PHB2轴对LPS诱导的肾小管上皮细胞线粒体功能障碍的影响:与LPS+oe-NC+sh-NC组相比,LPS+oe-FOXM1+sh-NC组细胞红/绿荧光强度比值和ATP含量明显升高(P<0.05);与LPS+oe-NC+sh-NC组相比,LPS+oe-NC+sh-PHB2组细胞红/绿荧光强度比值和ATP含量明显降低(P<0.05);与LPS+oe-FOXM1+sh-NC组相比,LPS+oe-FOXM1+sh-PHB2组细胞中红/绿荧光强度比值和ATP含量明显降低(P<0.05)。见图8。
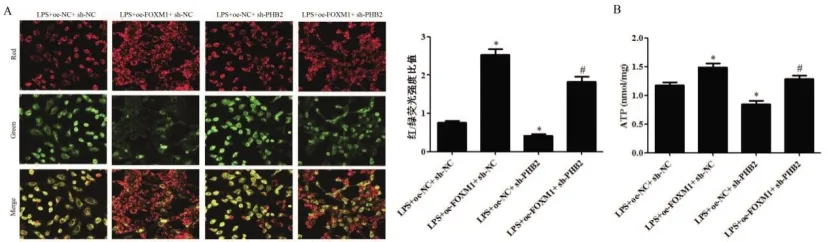
图8 FOXM1/PHB2轴对LPS诱导的肾小管上皮细胞线粒体功能障碍的影响
3 讨 论
脓毒症所致AKI的肾脏病理特征包括肾实质严重炎症、肾小球内血栓形成、内皮功能障碍和严重的肾小管损伤[8]。肾小管损伤是LPS诱导的AKI的一个显著特征,其特征是细胞脱落、空泡化和刷状边缘消失。因此,有必要继续探究LPS诱导肾小管损伤的具体机制,这对于开发新的治疗靶点以改善脓毒症所致AKI具有重要作用。
线粒体在病理生理过程中都有重要作用,调节钙稳态、细胞信号通路、转录调控和细胞凋亡等过程[9]。心脏和肾脏拥有最丰富的线粒体,它们协同工作来提供能量[10]。线粒体功能障碍的多个方面,如三磷酸腺苷(adenosine triphosphate,ATP)的耗竭、线粒体膜电位的破坏以及细胞凋亡的加剧,被认为是影响脓毒症AKI的因素[11]。因此,改善线粒体功能障碍是脓毒症AKI潜在的预防和治疗策略。FOXM1是一种增殖特异性转录因子,主要表达于高周期器官,如睾丸和胸腺。在发育过程中,它也会在不同的器官中表达,包括肾脏和各种类型的癌症。目前,已有证据显示,FOXM1参与了线粒体功能的调节,FOXM1可通过促进有丝分裂来改善细胞线粒体功能障碍[12]。FOXM1在组织损伤修复中发挥重要作用,如FOXM1可促进急性缺血性肾损伤修复过程中近端小管增殖。敲低FOXM1会导致细胞增殖减少,并下调参与细胞周期的下游靶基因的表达[13];此外,下调FOXM1表达可抑制促增殖因子的产生和细胞增殖,并减少肾缺血/再灌注诱导的AKI小鼠肾小管的再生[14]。本研究结果显示,LPS可抑制HK-2细胞活力、线粒体膜电位和ATP产生,促进细胞凋亡。过表达FOXM1可促进LPS处理的HK-2细胞活力、线粒体膜电位和ATP产生,抑制细胞凋亡。该研究结果显示,FOXM1可在LPS诱导的HK-2细胞损伤中发挥保护作用。
PHB2是一种高度保守的蛋白,参与调控转录、细胞周期、细胞表面信号传递、细胞衰老、细胞凋亡、姐妹染色单体凝聚以及线粒体的多效性[15]。PHB2通过其多样的生物学功能,在多种疾病中发挥保护作用,如PHB2在线粒体功能维持方面具有重要作用。敲低PHB2可抑制肾小管上皮细胞线粒体遗传完整性和线粒体呼吸,导致线粒体氧化应激和线粒体凋亡,从而促进AKI疾病进程;蛛网膜下腔出血呈时间依赖性抑制大鼠脑组织中PHB2表达[16]。抑制PHB2表达可明显促进氧化应激相关神经元细胞死亡和神经损伤,从而促进蛛网膜下腔出血后脑损伤;小鼠足细胞中PHB2的缺失可导致小鼠肾脏线粒体结构缺陷、进行性蛋白尿、肾衰竭和动物死亡。目前已有证据显示,PHB2通过改善线粒体功能障碍来减轻血管紧张素Ⅱ诱导的肾小管上皮细胞损伤[7]。关于PHB2在LPS诱导的肾小管上皮细胞中的作用尚不明确。本研究结果显示,敲低PHB2可抑制LPS处理的HK-2细胞活力、线粒体膜电位和ATP产生,促进细胞凋亡。此外,FOXM1可靶向结合PHB2启动子区域,促进PHB2表达。进一步实验结果显示,敲低PHB2可部分逆转过表达FOXM1对LPS处理的HK-2细胞的作用,导致HK-2细胞活力、线粒体膜电位和ATP产生降低,细胞凋亡率升高。该研究结果表明,FOXM1可通过促进PHB2转录在LPS诱导的HK-2细胞损伤中发挥保护作用。
综上所述,本研究结果显示,FOXM1可通过促进PHB2转录来上调PHB2的表达,促进LPS诱导的HK-2细胞活力、线粒体膜电位和ATP产生,抑制细胞凋亡,从而在LPS诱导的HK-2细胞损伤中发挥保护作用。该研究结果为明确LPS诱导肾小管上皮细胞损伤的分子机制及开发新的治疗靶点提供了新的科学资料。

