miR-182对前列腺癌PC-3细胞增殖凋亡迁移的影响及机制研究
甘 卓, 李艳平, 史 冰, 王 群
(湖南中医药大学第一附属医院核医学科, 湖南 长沙 410007)
前列腺癌是男性泌尿生殖系统中最为多见的恶性肿瘤之一,2017年美国的最新数据显示前列腺癌有161360例的新发病例,发病率仍位居男性泌尿生殖系统恶性肿瘤发病的第1位[1]。微小RNA-182(miR-182)是微小RNA-183(miR-183)基因簇[miR-183、miR-182、微小RNA-96(miR-96)]的成员,它参与了多种癌症的重要功能并影响肿瘤的发展[2]。miR-182介导了细胞的运动性和迁移,下调miR-182表达可调控多种靶标抑制肿瘤细胞的侵袭、存活和化学抵抗性。罗俊波等[3]研究显示,下调miR-182可促进细胞命运决定子(NUMB)过表达进而抑制结直肠癌HT-29细胞的增殖、迁移、侵袭。异黏蛋白(MTDH)是一类多功能细胞增殖调控因子,其过表达影响恶性肿瘤的生物学特性。MTDH可以促进癌细胞的增殖、生长、转移和抑制凋亡,阻断MTDH的信号传导将会恢复细胞的表型、促进凋亡、提高化疗的敏感性,并减少癌细胞转移的倾向[4]。李文超等[5]研究显示,MTDH基因沉默可抑制B淋巴瘤细胞增殖和迁移。但miR-182的表达情况是否影响前列腺癌细胞生物学行为尚未见报道。因此,本研究以前列腺癌PC-3细胞为对象,探讨miR-182对前列腺癌PC-3细胞增殖、凋亡、迁移的及MTDH表达的影响,以期为前列腺癌的治疗寻找新的靶点。
1 材料与方法
1.1细胞来源、主要试剂与仪器:人前列腺癌PC-3细胞(上海弘顺生物科技有限公司,批号EY-J0907);miR-182过表达载体(miR-182 mimics)、miR-182低表达载体(miR-182 inhibitor)由北京西美杰科技有限公司合成,批号JS009R、JS011R;胎牛血清(FBS)、DMEM培养基、Lipofectamine 2000转染试剂、细胞计数试剂盒8(CCK-8)、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡试剂盒(美国Hyclone公司,批号HD70313、HD70529、HD90657、HD10356、HD10257);TRIzol试剂、逆转录试剂盒、PCR试剂盒、蛋白裂解液、蛋白定量试剂盒(美国Invitrogen公司,批号BI5478、BI6917、B7915、B3749K、B8011);MTDH、β-肌动蛋白(β-actin)单克隆抗体、兔抗鼠二抗、化学发光检测试剂盒(美国Proteintech Group公司,批号12560-1-AP、11357-4-AP、20674-9-AP、3449-3-AP);酶标仪、凝胶成像系统(美谷分子仪器上海有限公司,型号SpectraMax iD3、ImageXpress Micro 4);显微镜(闳龙生物科技上海有限公司,批号BX53M);流式细胞仪(北京吉源生物科技有限公司,型号CyFlow Cube8);Transwell小室(北京冬璞泰和科技有限责任公司,型号353102);荧光定量PCR仪(济南爱来宝仪器设备有限公司,型号LEPGEN-96)。
1.2细胞培养及分组:前列腺癌PC-3细胞在DMEM培养基中(补充有10% FBS),放置于37℃、5% CO2的加湿培养箱中培养。取对数生长期的前列腺癌PC-3细胞随机分为:对照组、miR-182 inhibitor组、miR-182 mimics组。各组培养方法如下,对照组:将前列腺癌PC-3细胞提供有10% FBS和青霉素/链霉素的DMEM培养基中培养,培养环境为:5%CO2、37℃、95%N2。miR-182 inhibitor组:前列腺癌PC-3细胞培养方法同对照组,并使用Lipofectamine 2000试剂转染miR-182 inhibitor。miR-182 mimics组:前列腺癌PC-3细胞培养方法同对照组,并使用Lipofectamine 2000试剂转染miR-182 mimics。以上各组细胞每孔设6个平行样,培养72h。
1.3细胞存活率及单克隆形成数目测定:各组细胞在96孔板中培养72h后,将5μL CCK-8试剂添加到每个孔中,并在37℃下孵育1h,另设空白组(只加培养液、CCK-8试剂),使用酶标仪测定每个样品在570nm处的吸光度(OD值),计算细胞存活率,细胞存活率=实验组OD值/空白组OD值×100%。各组细胞接种在6孔板中(300个/孔)培养72h后,用4%多聚甲醛固定并用结晶紫染色,显微镜随机拍摄10张图像,并进行细胞计数。
1.4细胞凋亡率测定:各组细胞培养72h后,采用胰蛋白酶消化收集前列腺癌PC-3细胞,在PBS中洗涤两次,并重悬于500μL结合缓冲液中,然后加入5μL Annexin V-FITC和5μL PI,在室温下黑暗中孵育10 min后,用流式细胞仪分析细胞凋亡率。
1.5细胞迁移能力测定:采用Transwell小室进行细胞迁移能力测定,具体操作如下:将各组细胞(每组1×105个)接种在上室中,含有10% FBS的0.6mL DMEM培养基作为化学吸引剂施加到下室中,温育24h后,用棉签去除上室中的细胞,将下室中的细胞用4%多聚甲醛固定并用结晶紫染色,以显微镜进行拍照并计数(穿膜数)。
1.6细胞miR-182、MTDH mRNA表达水平测定:各组细胞培养72h后,使用TRIzol试剂提取前列腺癌PC-3细胞的总RNA,逆转录合成cDNA,然后进行荧光定量PCR反应。miR-182、MTDH、U6引物由北京擎科新业生物技术有限公司合成,引物序列如下:miR-182正向:5'-TTGTGCGGCTCCTACTAA-3',miR-182反向:5'-CATCATCATAGAGGGCAT-3';MTDH正向:5'-CCTGGATACCGCAGCTAGGA-3',MTDH反向:5'-GCGGCGCAATACGAATGCAT-3';U6正向:5'-CTCGCTTCGGCAGCACA-3',U6反向:5'-AACGCTTCACGAATTTGCGT-3'。按PCR试剂盒说明书合成反应体系,然后在以下条件下进行反应:95℃ 4 min,95℃ 15 s、75℃ 10 s进行40个循环,60℃ 20 s。2-ΔΔCt法评估miR-182、MTDH mRNA表达水平。
1.7细胞MTDH蛋白表达水平测定:各组细胞培养72h后,使用蛋白裂解液从前列腺癌PC-3细胞中提取总蛋白,对总蛋白进行定量分析之后,上样进行凝胶电泳,将蛋白质转移到硝酸纤维素膜上,然后将膜在封闭缓冲液中封闭1h,并与MTDH、β-actin一抗在4oC下孵育过夜。用TBST缓冲溶液洗涤后,将膜与兔抗鼠二抗在室温下孵育1h,并用TBST洗涤3次,使用化学发光检测试剂盒进行显影,并分析蛋白质的灰度值。
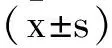
2 结 果
2.1各组前列腺癌PC-3细胞存活率和单克隆形成数目比较:与对照组比较,miR-182 inhibitor组细胞存活率、单克隆形成数目明显降低(P<0.05),miR-182 mimics组细胞存活率、单克隆形成数目明显升高(P<0.05);与miR-182 inhibitor组比较,miR-182 mimics组细胞存活率、单克隆形成数目明显升高(P<0.05),见表1、图1。
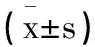
表1 各组前列腺癌PC-3细胞存活率和单克隆形成数目比较
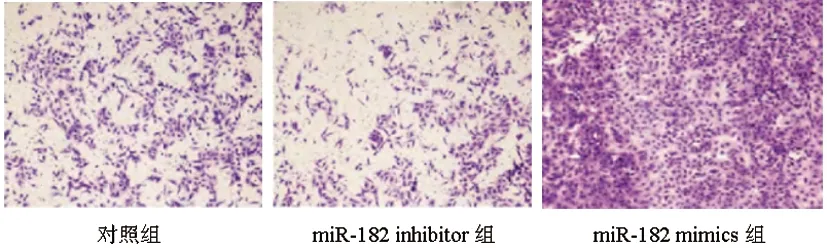
图1 各组前列腺癌PC-3细胞单克隆形成数目比较(结晶紫染色,×200)
2.2各组前列腺癌PC-3细胞凋亡率比较:与对照组比较,miR-182 inhibitor组细胞凋亡率明显升高(P<0.05),miR-182 mimics组细胞凋亡率明显降低(P<0.05);与miR-182 inhibitor组比较,miR-182 mimics组细胞凋亡率明显降低(P<0.05),见表2、图2。
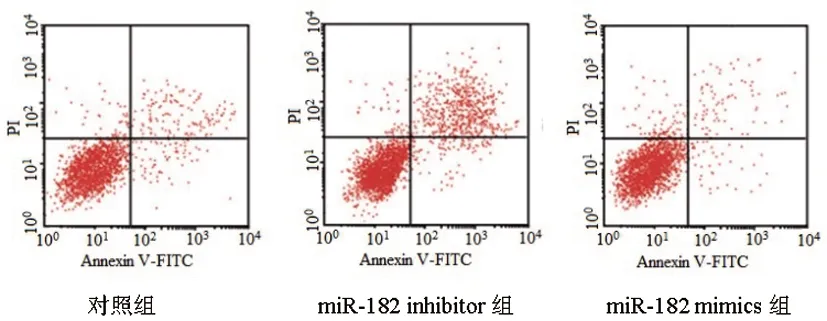
图2 各组前列腺癌PC-3细胞凋亡率比较
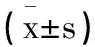
表2 各组前列腺癌PC-3细胞凋亡率比较
2.3各组前列腺癌PC-3细胞迁移能力的比较:与对照组比较,miR-182 inhibitor组穿膜数明显降低(P<0.05),miR-182 mimics组穿膜数明显升高(P<0.05);与miR-182 inhibitor组比较,miR-182 mimics组穿膜数明显升高(P<0.05)。见表3。
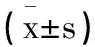
表3 各组前列腺癌PC-3细胞穿膜数比较
2.4各组前列腺癌PC-3细胞miR-182、MTDH mRNA表达水平比较:与对照组比较,miR-182 inhibitor组前列腺癌PC-3细胞miR-182、MTDH mRNA表达水平明显降低(P<0.05),miR-182 mimics组前列腺癌PC-3细胞miR-182、MTDH mRNA表达水平明显升高(P<0.05);与miR-182 inhibitor组比较,miR-182 mimics组前列腺癌PC-3细胞miR-182、MTDH mRNA表达水平明显升高(P<0.05),见表4。
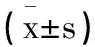
表4 各组前列腺癌PC-3细胞miR-182 MTDH mRNA表达水平比较
2.5各组前列腺癌PC-3细胞MTDH蛋白表达水平比较:与对照组比较,miR-182 inhibitor组前列腺癌PC-3细胞MTDH蛋白表达水平明显降低(P<0.05),miR-182 mimics组前列腺癌PC-3细胞MTDH蛋白表达水平明显升高(P<0.05);与miR-182 inhibitor组比较,miR-182 mimics组前列腺癌PC-3细胞MTDH蛋白表达水平明显升高(P<0.05),见表5、图3。
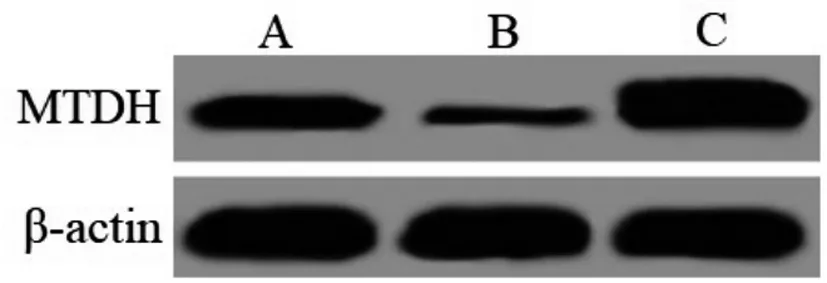
图3 各组前列腺癌PC-3细胞MTDH蛋白印迹图
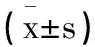
表5 各组前列腺癌PC-3细胞MTDH蛋白表达水平比较
3 讨 论
我国前列腺癌发病率处于升高趋势,多数患者诊断时已处于晚期,预后较差[6]。近几十年来,前列腺癌的主要治疗方法有所改进。然而,晚期前列腺癌患者的生存率仍然很差。因此,了解前列腺癌发生发展的分子机制具有重要意义。
miR-182已被证明是一种肿瘤促进因子。梁喜鹏等[7]研究发现在非小细胞肺癌组织中miR-182过表达,miR-182过表达可促进非小细胞肺癌细胞增殖。Baumann等[8]研究表明miR-182的异常表达在前列腺癌的发生和发展中起着重要作用,可能成为治疗前列腺癌的潜在靶点。陈灿等[9]研究发现上调miR-182表达可提高直肠癌细胞增殖、侵袭和迁移能力。武云飞等[10]发现胃癌组织中miR-182呈高表达,且miR-182高表达的早期胃癌患者内镜黏膜下剥离术后复发率较高。本研究结果显示,miR-182 inhibitor组细胞存活率、单克隆形成数目、穿膜数、miR-182表达水平低于对照组,凋亡率高于对照组;miR-182 mimics组细胞存活率、单克隆形成数目、穿膜数、miR-182表达水平高于对照组,凋亡率低于对照组。表明miR-182转染成功,且miR-182低表达对前列腺癌PC-3细胞增殖、迁移具有明显抑制作用,对其凋亡具有促进作用;miR-182过表达可逆转前列腺癌PC-3细胞的生物学行为。可能原因是miR-182作为促癌基因对前列腺癌具有促进作用。
MTDH位于染色体8q22,是一种多功能癌基因,在多种人类癌症中过度表达,包括胃癌、食管鳞状细胞癌和乳腺癌等,MTDH有助于癌症发生和进展过程中的多种生物学过程,包括细胞生长、凋亡、转移、侵袭、化学抗性和血管生成[11]。Li等[12]研究表明,上调MTDH表达可促进结直肠癌细胞的生长和侵袭。杨淑慧等[13]发现肺癌组织中MTDH表达水平高于癌旁正常组织,且MTDH过表达可促进肺癌细胞的活力。研究证实MTDH被鉴定为miR-182的靶基因[14]。前列腺癌细胞中MTDH呈过度表达,下调MTDH可抑制前列腺癌的进展[15]。本研究结果显示,miR-182 inhibitor组MTDH mRNA和蛋白表达水平低于对照组,miR-182 mimics组MTDH mRNA和蛋白表达水平高于对照组。表明抑制miR-182表达可降低MTDH的表达,并阻止前列腺癌PC-3细胞的生长和转移。可能原因是miR-182和MTDH具有靶向关系,调控miR-182可影响MTDH的水平进而影响前列腺癌PC-3细胞的生物学行为。
综上所述,miR-182低表达对前列腺癌PC-3细胞增殖、迁移具有明显抑制作用,对其凋亡具有明显促进作用;其机制可能与miR-182低表达靶向抑制前列腺癌PC-3细胞MTDH mRNA和蛋白的表达有关。

